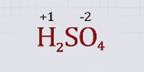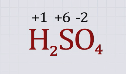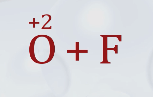Главная > Химия 8 класс > Степень окисления
Степень окисления – видеоурок
На этом видео уроке по химии для 8 класса по учебнику Габриеляна объясняется как определять степень окисления химических элементов в соединениях. Определяем степени окисления металлов, щелочных металлов, кислорода, хлора, азота, фтора, водорода. Рассматривается упрощенная модель строения атома, электроотрицательность химических элементов в периодической таблице Менделеева, зависимость степени окисления от номера группы в таблице Менделеева.
09:16
СТЕПЕНЬ ОКИСЛЕНИЯ 8 класс определяем степени окисления элементов
19 дек 20198 349 просмотров
-
Комментарии0
-
2
-
Добавить в закладки
-
-
Пожаловаться
-
Видео группы ОГЭ, ЕГЭ математика и физика – решение задач
Автор: ОГЭ, ЕГЭ математика и физика – решение задач
РЕШЕНИЕ задач и ПРИМЕРОВ – https://vk.com/club49102005
типы химических связей – https://youtu.be/-08jLQlajT8
таблица Менделеева – https://youtu.be/0E4AGnq6uNc
ХИМИЯ 8 класс все темы – https://www.youtube.com/playlist?list=PLBnDGoKqP7bYXp4WwE-EdrrWqro7fcCRI
На этом видео уроке по химии для 8 класса по учебнику Габриеляна объясняется как определять степень окисления химических элементов в соединениях. Определяем степени окисления металлов, кислорода, хлора, азота, фтора, водорода.
#физикаОГЭматематикаЕГЭ #степеньОКИСЛЕНИЯ #химия8класс #химия8классГабриелян #химия8классВИДЕОУРОКИ
•••
В химических процессах главную роль играют атомы и молекулы, свойства которых определяют исход химических реакций. Одной из важных характеристик атома является окислительное число, которое упрощает метод учета переноса электронов в частице. Как определить степень окисления или формальный заряд частицы и какие правила необходимо знать для этого?
Оглавление
- Определение
- Правила определения степени окисления
- Полезное видео: определение степени окисления
- Как определить степень окисления
- Таблица оксидации
- Полезное видео: учимся определять степень окисления по формулам
- Вывод
Определение

Термин окисление (оксидация) в химии означает реакцию, в ходе которой группа атомов или один из них теряют электроны или приобретают, в случае приобретения реакцию называют «восстановлением».
Степень окисления – это величина, которая измеряется количественно и характеризует перераспределяемые электроны в ходе реакции. Т.е. в процессе оксидации электроны в атоме уменьшаются или увеличиваются, перераспределяясь между другими взаимодействующими частицами, и уровень оксидации показывает, как именно они реорганизуются. Данное понятие тесно связано с электроотрицательностью частиц – их умением притягивать и отталкивать от себя свободные ионы.
Это интересно! Что такое алканы: строение и химические свойства
Определение уровня оксидации зависит от характеристик и свойств конкретного вещества, поэтому нельзя однозначно назвать процедуру вычисления легкой или сложной, но ее результаты помогают условно записать процессы окислительно-восстановительных реакций. Следует понимать, что полученный результат вычислений является результатом учета переноса электронов и не имеет физического смысла, а также не является истинным зарядом ядра.
Важно знать! Неорганическая химия часто использует термин валентности вместо степени окисления элементов, это не является ошибкой, но следует учитывать, что второе понятие более универсальное.
Понятия и правила вычислений движения электронов являются основой для классификации химических веществ (номенклатура), описания их свойств и составления формул связи. Но наиболее часто данное понятие используется для описания и работы с окислительно-восстановительными реакциями.
Правила определения степени окисления
Как узнать степень окисления? При работе с окислительно-восстановительными реакциями важно знать, что формальный заряд частицы всегда будет равен величине электрона, выраженного в числовом значении. Эта особенность связана с тем предположением, что электронные пары, образующие связь, всегда полностью смещаются в сторону более отрицательных частиц. Следует понимать, что речь идет об ионных связях, а в случае реакции при ковалентной связи электроны будут делиться поровну между одинаковыми частицами.
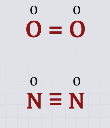
Окислительное число может иметь как положительные, так и отрицательные значения. Все дело в том, что в процессе реакции атом должен стать нейтральным, а для этого нужно либо присоединить к иону некое количество электронов, если он положительный, либо отнять их, если он отрицательный. Для обозначения данного понятия при записи формулы обычно прописывают над обозначением элемента арабскую цифру с соответствующим знаком. Например, или
и т.д.
Следует знать, что формальный заряд металлов всегда будет положительным, а в большинстве случаев, чтобы определить его, можно воспользоваться таблицей Менделеева. Существует ряд особенностей, которые необходимо учитывать, чтобы определять показатели правильно.
Как определить степень окисления
Степень оксидации:
- У простых элементов всегда равна нулю:
или
.
- У фтора всегда будет равна -1.
- Как и у металлов, у элементов из групп IA, IIA и IIIA групп всегда одинаковая – это номер группы, в которой они расположены.
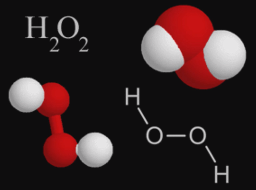
- У кислорода в любой связи равна -2, кроме связей с пероксидами (Н2О2), когда значение равно -1 и оксидом фтора (O+2F2-1, O2+1F2-1), когда она равна +2.
- У водорода всегда +1, кроме его взаимодействия с гидридами (Na+H- и связями по типу C+4H4-1).
- У простого вещества без связей с другими элементами всегда равна нулю.
- У простого иона с одним атомом равна числу его электрона (Na+, Ca+2).
- Если рассматривается связь двух веществ различной природы (металл и неметалл), то отрицательное окислительное число будет наблюдаться у вещества, которое обладает большей электроотрицательностью (H+F-, Cu+Br-), а положительное, соответственно, у элемента с электроотрицательностью больше нуля.
- У щелочных металлов, таких как литий, натрий, калий и прочих, всегда +1.
- У металлов из главной подгруппы II (магний, барий, кальций и стронций) равна +2.
- У алюминия всегда одинаковое значение — +3.
Запомнив эти особенности, достаточно просто будет определять окислительное число у элементов, независимо от сложности и количества уровней атомов.
Полезное видео: определение степени окисления
Как определить степень окисления
Периодическая таблица Менделеева содержит почти всю необходимую информацию для работы с химическими элементами. Например, школьники используют только ее для описания химических реакций. Так, чтобы определить максимальные положительные и отрицательные значения окислительного числа необходимо свериться с обозначением химического элемента в таблице:
- Максимально положительное – это номер группы, в которой находится элемент.
- Максимально отрицательная степень окисления – это разница между максимально положительной границей и числом 8.
Таким образом, достаточно просто узнать крайние границы формального заряда того или иного элемента. Такое действие можно совершить с помощью вычислений на основе таблицы Менделеева.
Важно знать! У одного элемента могут быть одновременно несколько различных показателей оксидации.
Различают два основных способа определения уровня оксидации, примеры которых представлены ниже. Первый из них – это способ, который требует знаний и умений применять законы химии. Как расставлять степени окисления с помощью этого способа?
Правило определения степеней окисления
Для этого необходимо:
- Определить, является ли данное вещество элементарным и находится ли оно вне связи. Если да, то его окислительное число будет равно 0, независимо от состава вещества (отдельные атомы или многоуровневые атомные соединения).
- Определить, состоит ли рассматриваемое вещество из ионов. Если да, то степень оксидации будет равна их заряду.
- Если рассматриваемое вещество металл, то посмотреть на показатели других веществ в формуле и вычислить показания металла путем арифметических действий.
- Если все соединение имеет один заряд (по сути это сумма всех частиц представленных элементов), то достаточно определить показатели простых веществ, затем вычесть их от общей суммы и получить данные металла.
- Если связь нейтральная, то общая сумма должна быть равна нулю.
Это интересно! Уроки химии: что это такое галогены
Для примера можно рассмотреть объединение с ионом алюминия, чей общий заряд равен нулю. Правила химии подтверждают тот факт, что ион Cl имеет окислительное число -1, а в данном случае их три в соединении. Значит ион Al должен быть равен +3, чтобы все соединение было нейтральным.
Этот способ весьма хорош, поскольку правильность решения всегда можно проверить, если сложить все уровни оксидации вместе.
Второй метод можно применять без знания химических законов:
- Найти данные частиц, по отношению к которым нет строгих правил и точное количество их электронов неизвестно (можно путем исключения).
- Выяснить показатели всех прочих частиц и после из общей суммы путем вычитания найти нужную частицу.
Рассмотрим второй метод на примере вещества Na2SO4, в котором не определен атом серы S, известно лишь, что он отличен от нуля.
Это интересно! Уроки химии: катионы и анионы – что это такое
Чтобы найти, чему равны все степени окисления необходимо:
- Найти известные элементы, помня о традиционных правилах и исключениях.
- Ион Na = +1, а каждый кислород = -2.
- Умножить количество частиц каждого вещества на их электроны и получить степени оксидации всех атомов, кроме одного.
- В Na2SO4 состоят 2 натрия и 4 кислорода, при умножении получается: 2 X +1 = 2 – это окислительное число всех частиц натрия и 4 X -2 = -8 – кислородов.
- Сложить полученные результаты 2+(-8) =-6 – это общий заряд соединения без частицы серы.
- Представить химическую запись в виде уравнения: сумма известных данных + неизвестное число = общий заряд.
- Na2SO4 представлено следующим образом: -6 + S = 0, S = 0 + 6, S = 6.
Таким образом, чтобы использовать второй метод, достаточно знать простые законы арифметики.
Таблица оксидации
Для простоты работы и вычисления показателей оксидации для каждого химического вещества используют специальные таблицы, где прописаны все данные.
Она выглядит следующим образом:
Полезное видео: учимся определять степень окисления по формулам
Вывод
Нахождение степени окисления для химического вещества – это простое действие, которое требует лишь внимательности и знания основных правил и исключений. Зная исключения и пользуясь специальными таблицами, это действие не будет занимать много времени.
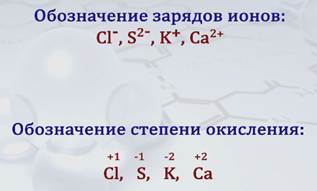
§ 1 Степень окисления и ее обозначение
Для характеристики состояния атомов в сложных веществах введено понятие «степень окисления». Степень окисления характеризует связанные между собой атомы в ионных и ковалентных полярных соединениях.
Степень окисления – это условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов.
Степень окисления – это количественная характеристика элемента в химическом соединении.
При определении степени окисления атомов элементов исходят из предположения, что в соединении все связывающие атомы валентные электроны перешли к более электроотрицательному элементу, а потому соединение состоит из положительно и отрицательно заряженных ионов.
Степень окисления определяется числом электронов, полностью или частично смещенных от одного атома к другому, с обозначением соответствующего заряда, положительного или отрицательного.
В отличие от обозначения зарядов ионов, которое ставят вверху справа символа элемента, степень окисления также обозначаюn цифрой со знаками «+» или «–», но ее ставят над символом элемента, причем знак «+» или «–» ставят перед цифрой.
§ 2 Вычисление степени окисления
Вычисление степени окисления элементов в соединении требует учета валентных электронов и направления их смещения при связывании атомом. Так, в хлориде водорода HCl один электрон водорода смещен в сторону хлора. Водород имеет в соединении степень окисления, равную +1, а хлор –1. У атома азота три внешних неспаренных электрона, у атома водорода – один.
При образовании химической связи в молекуле аммиака NH3, один атом азота как более электроотрицательный элемент оттягивает 3 электрона от 3 атомов водорода. Его степень окисления в соединении равна –3. В целом химическое соединение электронейтрально: сумма положительных степеней окисления равна сумме отрицательных степеней окислении составляющих его элементов.
Степень окисления водорода в соединениях обычно равна +1, а кислорода –2. Степени окисления металлов главных подгрупп I-III групп периодической системы равны номеру группы.
Зная это, легко найти степень окисления других элементов.
Определим степени окисления центральных атомов в соединении, состоящем из трех элементов, например в серной кислоте H2SO4. Для этого сравним значения относительной электроотрицательности элементов, выделим элементы с наибольшим и наименьшим значениями относительной электроотрицательности.
В молекуле серной кислоты наибольшим значением электроотрицательности обладает кислород, следовательно, он имеет отрицательную степень окисления –2. Водород имеет степень окисления, равную +1.
Запишем значения известных степеней окисления водорода и кислорода над формулой серной кислоты. Вычислим степень окисления третьего элемента – серы, приняв ее значение за х, в соответствии с правилом равенства сумм положительных и отрицательных степеней окисления.
–2 · 4 = –8
Значит, 1 · 2 + х = 8, х = 6.
Запишем значение степени окисления серы +6 над формулой серной кислоты.
Высшая положительная степень окисления элемента обычно равна номеру группы периодической системы. Так, кальций находится во II группе, следовательно, его высшая степень окисления равна +2, у элемента V группы азота она равна +5.
Высшая степень окисления углерода и кремния равна +4, низшая равна –4.
Многие элементы, и особенно элементы побочных подгрупп, имеют переменную степень окисления. Так, например, марганец имеет степень окисления в разных его соединениях +2, +3, +4, +6, +7.
Степень окисления тесно связана с относительной электроотрицательностью элемента, а также обусловлена его местом в периодической системе Дмитрия Ивановича Менделеева.
В природе элементы встречаются в соединениях, где проявляют характерную и устойчивую степень окисления. Так, у кислорода такой устойчивой степенью окисления является –2, но в соединении с более электроотрицательным элементом фтором он имеет положительную степень окисления +2
В свободном атомарном состоянии и в простых веществах степень окисления элементов равна нулю, так как их валентные электроны не смещены.
Степень окисления не следует отождествлять с валентностью элементов.
Валентность – это реальное свойство атомов, которое проявляется в их способности образовывать химические связи с другими атомами. Валентность в ковалентном соединении измеряется числом химических связей или числом связывающих электронных пар.
Так, молекула О2 образована двумя ковалентными связями, валентность кислорода в данном веществе равна II, а степень окисления равна нулю. Молекула азота образована с помощью трех ковалентных связей, следовательно, азот здесь трехвалентный.
В большинстве случаев численные значения валентности и степени окисления элементов в соединениях совпадают, но не во всех случаях они численно равны. Например, в пероксиде водорода Н2О2 степень окисления кислорода равна –1, так как от водорода к атому кислорода оттягивается лишь один электрон, а у атомов кислорода одинаковая электроотрицательность.
Понятие валентности применимо лишь к ковалентным соединениям, как простым, так и сложным.
Как найти степень окисления
Смотреть видео:
СМОТРЕТЬ ВИДЕОРОЛИК:
youtu.be/Bt91EwyFseo
#химия #химияпросто #неорганика #егэпохимии #эксперименты #химик #егэхимия #химияегэ #огэхимия
Свежая информация для ЕГЭ и ОГЭ по Химии (листай):
С этим видео ученики смотрят следующие ролики:

Степень окисления в органике. Как найти?
Вурдихан Вурдиханов

Степень окисления в органике . Как найти 1 способом?
Вурдихан Вурдиханов

Степень окисления. Определение степеней окисления. Часть 1
Your system education

Прямой эфир Вебинар Химия 2019 ОГЭ ЕГЭ 8 класс Как считать степень окисления элементов в соединениях
Репетитор химии
Облегчи жизнь другим ученикам – поделись! (плюс тебе в карму):
18.06.2019
- Комментарии
RSS
Написать комментарий
Нет комментариев. Ваш будет первым!
Ваше имя:
Загрузка…