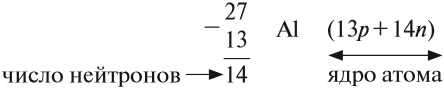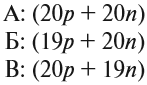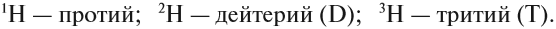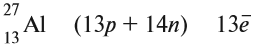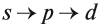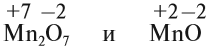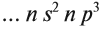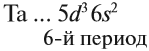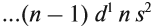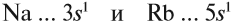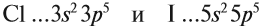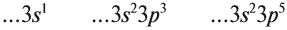Загрузить PDF
Загрузить PDF
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-
3
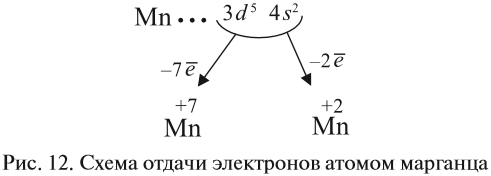
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-
4
Определите количество электронов. Протоны – это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер – это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-
1
Определите число ионов. Ион – это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 950 363 раза.
Была ли эта статья полезной?
В древние времена считалось, что все состоит из земли, воды и воздуха, другого — нет. И сравнительно недавно люди смогли показать всю составляющую нашего мира. Важным вопросом было: что из себя представляет вещество?
Вещество — это материя, которая есть во всех физических телах на нашей планете.
Оно может быть простым и сложным.
Различие этих двух групп состоит в том, что простые вещества состоят из одного вида атомов, а сложные — из нескольких, поэтому впервые в ходе реакций не могут раскладываться на другие атомы, как это делают вторые.
Образцом сложного вещества можно назвать воду (H2O). Если провести химическую реакцию, то оно образует 2 элемента — водород (Н) и кислород (О). То, что получилось, — простые вещества, без последующего разложения.
В 19 веке считалось, что сами элементы не поддаются изменениям и независимы от объединения. Но такие высказывания были опровергнуты русским химиком Дмитрием Ивановичем Менделеевым, который доказал обратное, при этом указав на то, что качественная характеристика каждого элемента влияет на его атомный вес, из-за чего происходит повтор их свойств. Это умозаключение он олицетворил в своей периодической системе, назвав в честь себя.
Атом
Атом — мелкая частица, которая не разлагается в реакции на другие компоненты.
Есть что-то меньше вещества — это атомы.
Атомы можно различать по нескольким параметрам (приведем самые распространенные):
- Масса;
- Размер;
- Физические хар-ки;
- Химические хар-ки;
- Энергия;
- Вес атома.
Любой атом отличается от частицы другого элемента. Если сравнить атом водорода (Н) с атомом кислорода (О), то, очевидно, что у них будет несоответствие по многим характеристикам.
Размер атома
Если сравнить размеры атома и составляющих его частиц, то первый преобладает по своим масштабам. Ядро атома — ничто, по сравнению с ним самим. Взяв один кубический метр платины (Pt) и сплюснув его до такого состояния, где атомные расстояния просто бы исчезли, то он его кубический метр превратился бы в кубический миллиметр.
Из определения атома следует, что это маленькая частица. По форме они напоминают шар, а размер их поперечников составляет стомиллионную долю сантиметра. Чтобы это было нагляднее, рассмотрим поперечник атома водорода (Н), считающийся самым маленьким. Его размер составляет 10-8 доле сантиметра. Большим атомом является уран (U), чья величина составляет 3 х10-8 долей сантиметра.
Масштаб и вес атомов небольшие.
Вес атома
Чтобы посчитать вес какого-либо элемента, принято использовать 0,0625 долю кислорода (О), которая показывает насколько значение этого элемента больше. Если обратиться к таблице Менделеева, то можно увидеть под номерами всех элементов цифру, обозначающую атомный вес. Например, у водорода (Н) он составляет 1,008 (значение округляется, поэтому 1),а у радия — 226,025 (или же 226).Тут можно проследить разницу веса.
На заметку: при работе с периодической таблицей учтите, что если у вещества номер выше, тем вес атома будет больше.
Чаще всего у многих их вес будет дробный. Это объясняется тем, что они вмещают определенное количество частиц со своим весом, но признаки у всех абсолютно идентичны. Но такое не только у атомов. То же самое есть и самих элементов. Их называют изотопами.
Изотопы — химические элементы, занимающие один порядковый номер, но разную массу ядер.
Изотопы есть практически у каждого элемента (у кальция (Са) их целых четыре), при этом, чаще всего, их выводят искусственным путем.
Элементарные частицы
Протоны, нейтроны
Протоны — положительно заряженные части ядра. Заряд равен заряду электрона. Вес составляет 0,0625 грамм.
Нейтроны — нейтральная часть ядра. Чтобы узнать их значение, нужно из атомного веса элемента вычесть значение протонов (= электронов).
Поскольку электроны отделены от своих “напарников”, кружась вокруг них, стоит уделить им отдельное внимание.
Электроны
Электроны — частицы, у которых самый маленький отрицательный электрический заряд.
До настоящего времени считалось, что атомы, разложенные из элементов, являются конечным продуктом. На сегодняшний день эта мысль была развеяна учеными, которые доказали, что даже эти разложенные атомы содержат в себе крохотные молекулы.
Обратимся к одной из гипотез, объясняющую вещественную структуру. Там говорится, что элементный атом — некая совокупность, где есть центр, вокруг которого происходит вращение других крупинок.
Начнем с рассмотрения окраин центра, а именно с электронных уровней и электронов.
Как и говорилось ранее, значение электронов такое же, как и у протонов.
Их можно сравнить с шаром , а диаметр 40-13 сантиметров (что доказывает свою мизерность по сравнению с обычными атомами).
Электроны способны находиться в бездействии. Их масса при этом составляет 91-27 грамм. Это подчеркивает скудность инертных свойств, благодаря которым электроны способны быстро вращаться вокруг свой оси.
Масса электрона зависит от его скорости. Поговорив про массу “покоя”, которая есть у всех тел на Земле, нужно посмотреть и на массу “скорости”. Когда электрон занимается перемещением, то он образовывает электромагнитное поле. Оно играет большую роль, ибо именно из-за проявления ее инертных свойств набирается масса и энергия, передавая это все частицам. Сделаем вывод, что ускоренный динамизм этой частицы, приводит к набору его веса.
Но перемещение электронов не происходит ровно. Научно доказано, что эти частицы двигаются волнообразно из-за интерференции и дифракции.
Интерференция электронов — слияние нескольких волн электронов.
Дифракция электронов — волновое обтекание области места, через которое проходит ток.
Помимо того, что электроны двигаются волнами, так еще они крутят вокруг самих себя. Крутящееся и волновое движение говорит о нем (электроне) как о некоем магните.
Все три вида элементарных частиц фигурируют в постоянном обменивающемся контакте. Между электроном и протоном возникает связь, заставляющая их содействовать, поскольку их заряды противоположны, а вот две одинаковые частицы (например, два электрона) отталкиваются, т.к. заряды одинаковы (так же и у протона).
Нахождение частиц у элемента
Найти у какого-либо элемента эти частицы несложно. Разберем это на примере алюминия (Al).
Его порядковый номер — 13, соответственно, это есть ядро. Атомная масса алюминия составляет 26,98154 (значение округляется, поэтому 27). Протоны равны массе заряда (р=13), так же и электроны (е=13). Чтобы узнать значение нейтронов, нужно из атомной массы вычесть значение заряда ядра (n=27-13=14).
Взаимосвязь частиц
Каждая частица имеет свое электрическое поле, через которое оно “соприкасается” с остальными. Такие поля можно обозначить определенной материей, в которой, помимо этих частиц, есть и другие, наполняющие эту материю — фотоны.
Фотон — частица, не имеющая массы. Является переносчиком электромагнитного “общения”.
Все они имеют конкретный запас энергии. Именно через фотоны происходит коммуникация частиц. В такой связи происходит “бартер” фотонами, что служит для хорошей энергетической силы, то есть взаимосвязи частиц.
И в самом ядре происходит “общение” протона и нейтрона, но здесь уже нет электрического поля, поскольку нейтрон его не образовывает. Здесь все проходит при помощи особого поля, исходящего от ядра.
Ядерное поле — вид материи, который состоит из протонов, нейтронов и мезонов.
Мезон — частица, которая способствует взаимодействию протонов и нейтронов, а также влияет на то, чтобы эти частицы оставались в ядре.
Благодаря мезонам, протоны и нейтроны способны внутри своего ядра передавать определенную информацию путем ядерной силы. Ее работа в ядре происходит на определенной дистанции (приблизительно сантиметров).
Ядерная сила — сила влияния протона и нейтрона друг на друга.
Ядерные силы, происходящие внутри ядра, способны делать из протонов нейтроны и наоборот при помощи мезонов.
Можно сказать, что ядерные силы намного мощнее электрических, но вместе они не дают протонам выйти за границы ядра. Несмотря на то, что частицы сопротивляются, объединение двойной силы подавляет их, при этом создавая крепкое ядро. Из-за них и зависит его прочность.
Все три частицы называются элементарными, потому что их невозможно разложить на другие упрощенные элементы, но они могут становиться и образовываться друг из друга.
Химическое строение атомов
Работа электрона
Структура водорода (Н) заслуживает внимания. Это единственный элемент, который содержит в себе две частицы — один протон, находящийся в ядре, и один электрон, вращающийся вокруг него. Но даже тут есть нюанс: у электрона нет определенного барьера, отгораживающего его от окружающей среды.
Путь электрона вокруг ядра достаточно пластичен и поддается изменениям (причиной может стать увеличение массы электрона). А поскольку в ядре и на оболочке противоположно заряженные частицы, то они имеют свойство присоединяться. Но есть один момент: когда отрицательно заряженная частица облетает ядро, то образовывается центробежная сила, которая пытается максимально отдалить частицу. Все эти моменты создают спорную ситуацию.
Самое важное, чтобы была стабильность, тогда электрон будет спокойно находиться на своем месте. Поскольку вес орбитальной частицы небольшой, то для стабилизации ему придется летать возле ядра намного быстрее (примерно 60 15 облетов).
Получается, что электрон водорода (Н) находится неподалеку от протона, сохраняя минимум своей энергии. Но если какая-либо частица вторгнется в данную схему, и водород (Н) отдалится от ядра, то его энергия станет больше, но не надолго. Дело в том, что электрон все равно будет пытаться вернуться на место, приближенное к ядру. Электрон таким действием (переходом на другую орбиту) предоставил определенную часть своей энергии — лучистой энергии.
Если электрону дадут энергию, то он перейдет на другое место (чем больше энергии, тем дальше от протона). При этом, когда он будет возвращаться к ядру, то будет происходить активная выработка электромагнитной энергии с последующем излучением.
Когда ученые наблюдали за такими переходами этой частицы, они сделали вывод, что как и в любом элементе, так и в водороде (Н) электрон может совершать отойти только на конкретный круг, опираясь на полученное извне питание.Слои, на которых электрон способен перемещаться, называют дозволенными.
Работа протона и нейтрона в ядре
Как говорилось ранее, протон и электрон водорода (Н) — разноименные и аналогичные по значениям, поэтому их совместный заряд составляет — ноль. Из этого выходит, что водород (в обычном его состоянии) — нейтральная частица.
Такой вывод относится ко всем элементам из таблицы Менделеева. Все их атомы в нормальном состоянии нейтральны из-за равновесия разных зарядов.
Вернемся к ядру водорода (Н). Известно, что в нем находится только один протон. Обратимся к массе ядра.
Масса ядра — общее число протонов и нейтронов внутри ядра. Ее можно найти у всех элементов периодической таблицы.
Согласно этому, масса ядра водорода тоже будет составлять один (так как есть 1 протон и полностью отсутствуют нейтроны).
Что говорилось выше, относилось к природному водороду (Н), равному единице. Но существует еще и тяжелый водород (Н) — он же изотоп дейтерий (2H, имеет название тяжелого водорода). Масса равна двум. Если в ядре простого водорода (Н) всего лишь один протон, то у дейтерия — дейтоны.
Дейтон — объединение протона и нейтрона в ядре.
Водород и его изотопы
В природе обычный водород (Н) может вмещать в себя дейтерий, но в очень маленьком количестве (на 6 000 атомов Н один 2H). Но есть еще более тяжелый изотоп водорода (Н) — тритий (³Н, сверхтяжелый водород). В его ядре уже не одна, и не две частицы, а три — два нейтрона и один протон, между которыми есть ядерная сила. Масса трития составляет три. Получается, что он в целых три раза превосходит самый легкий водород.
Несмотря на то, что вес водорода и его изотопов различается, их объединяют некоторые общие свойства. Например, если самый простой водород (Н) вступит в связь с кислородом (О), то получится вода (Н2О). То же самое происходит и в цепи дейтерия ( 2H) и кислорода (О). У этого изотопа тоже на выходе получается вода, но тяжелая, которая пользуется спросом в производстве атомной энергии.
Читайте про свойства магнитного поля.
Из примера можно сделать вывод, главную роль в химических свойствах играет электронная оболочка и ее устройство, а не массу ядра. Водород и его изотопы несут в себе разную массу, но общее у них — это электроны возле ядра, которые и сохраняют идентичные свойства.
Водород (Н) взял первое место в менделеевской таблице. Такое решение было неслучайным. Как мы знаем, порядковый номер напрямую зависит от числа заряда ядра. То же самое и у водорода (Н) (номер в таблице — один = заряд ядра — один). Если правильно сказать, то: всякое вещество, занимающее место в периодической таблице Менделеева, имеет свой порядковый номер, соотносящийся заряду ядра и числу электронов на его оболочках.
Из всего сказанного получается, что водород (Н), занимающий первое место, имеет заряд ядра — +1 и один электрон на орбите.
Гелий и его изотопы
На втором месте в таблице стоит гелий (Не). Как и говорилось ранее про все элементы, его номер и заряд ядра однозначны, поэтому второй будет равен +2 (внутри ядра два протона), а оболочка будет содержать два электрона.
Как и все составляющие таблицы, гелий (Не) имеет изотопы. Их целых девять, но самыми стабильными из них считаются легкий и тяжелый, поэтому ими пользуются чаще. Рассмотрим первый.
Легкий гелий (³Не, еще имеет название гелион). Масса его ядра составляет 3, состоит из двух протонов, одного нейтрона и трех электронов на оболочке. Считается, что содержание гелиона в природном гелии 1/1 000 000 тяжелого гелия. Выводится искусственным путем.
Тяжелый гелий (⁴Не). Считается самым востребованным из всех изотопов гелия (Не). Ядро содержит два протона и два нейтрона, а на орбитах расположены четыре электрона.Образовывает около 99% гелия на нашей планете. Есть забавный факт про это вещество: если охладить его (-271 ºС) и поместить в открытую емкость, то этот изотоп вытечет из нее.
Затруднение состава атома в элементе обусловлено возрастанием объема элементарных частиц: протонов и нейтронов в ядре и электронов на оболочке. При помощи таблицы Менделеева можно узнать все эти необходимые данные об элементе (а именно про частицы).
В науке доказано, что легкие элементы имеют большое преимущество: их ядра, содержащие одинаковое количество протонов и нейтронов, считаются самыми крепкими, поскольку ядерная сила превышена, чем у остальных. Рассмотрим тяжелый гелий (⁴Не). В его составе располагаются два протона и два нейтрона, соответственно, у него неплохая прочность, точно так же, как и возникающая сила ядра.
Такие тяжелые вещества содержат разное количество частиц (протонов, нейтронов и электронов), из-за чего в ядре контакт между ними теряется, чего не происходит в легких. В тяжелых элементах возможно расщепить их ядра при разрыве атомных бомб.
Радиоактивные элементы
У тяжелых элементов есть и подразделение радиоактивных. Они отличаются тем, что их ядра настолько непрочны, что они способны самостоятельно расщепляться на отдельные частицы. Радий (Ra) — самый известный радиоактивный химический элемент. Его порядковый номер — 88. Масса атома равна 226 (если быть точнее, то 226,025).
Состав протонов в ядре — 88, а нейтронов — 138. Все они занимаются распадом, где позже они трансформируются в атомы радона (Rn, радиоактивный газ, номер в периодической таблице — 86). Все происходит точно так же: атомы радона (Rn) занимаются распадом, после чего тоже преобразовываясь в другие элементы.
Электронные оболочки
Электронные оболочки — это тоже важная часть, без которой представление какого-то химического элемента просто не было бы. Как было рассмотрено ранее, электроны единственные, кто размещен за ядром, при этом крутится вокруг него, собираясь определенными группами по разным “отсекам”.
Познание с ядрами и их частицами подошло к концу, поэтому теперь стоит уделить внимание тому, что находится за пределами этой главной точки.
Нахождение электронных оболочек и его содержимого
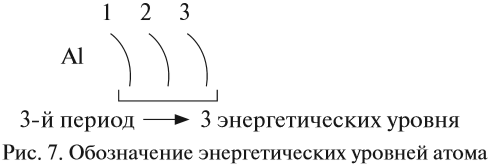
Чтобы определить количество электронных слоев элемента, нужно обратиться к его номеру периода. Например, алюминий (Al) с порядковым номером 13, находится в третьем периоде, поэтому число его слоев равно 3.
Еще одной удивительной характеристикой оболочек является закрепленное число электронов, которые могут находиться на слое. На первой орбите могут расположиться два электрона, на втором — восемь, на третьем — 16 и т.д. (с каждым разом нужно умножать на четыре).
Завершенным считается тот слой, который достиг окончательного предела. Электроны, которые расположены дальше всего от ядра, более активны, поэтому предпочитают вступать в контакт с другими атомами (научно это можно назвать валентностью). Число электронов на внешней оболочке зависит от номера группы. Например, бор (В) имеет заряд — +5, он находится во втором периоде, поэтому количество электронных слоев равно двум. Первый слой равен двум, а второй — трем, поскольку бор (В) находится в 3 группе.
Когда электронный слой полностью заполнен, то он считается стабилизированным. Это говорит о том, что атому не требуется брать дополнительные силы (электроны) из окружающей среды или других веществ. Если взять гелий (Не), у которого два электрона, находящиеся на одной оболочке, а у неона (Ne) электронов десять, располагающиеся на двух электронных слоях(на первом — 2, на втором — 8). Из этого выходит, что и гелий, и неон полностью заполнены, поэтому они не нуждаются в посторонней помощи, так как их оболочки завершенные. Такие элементы являются инертными в химическом плане (не идут на контакт с другими элементами, чтобы “занять” или “обменяться” этими частицами).
Но таких самодостаточных элементов достаточно мало, больше всего тех, где на внешней оболочке будет не хватать электронов, поэтому такие элементы охотнее прибегают к воздействию с другими. Калий (К) имеет 19 электронов, находящихся на четырех слоях (первый — 2, второй — 8, третий — 8, четвертый — 1). Больше всего интересует последняя оболочка. Поскольку там всего лишь один электрон, который очень далеко от ядра, то последнее не в силах удержать электрон, поэтому он с легкостью может перейти к другому элементу.
Если же взять кислород (О), у которого восемь электронов и две электрические оболочки (на первом — 2, на втором — 6). Как видно, второй слой является незавершенным, до предела ему не хватает еще двух частиц. Кислород пытается сохранить недостающее число, а также найти два электрона, чтобы завершить свой последний круг. Это может произойти в реакции с другими элементами, у которых внешний слой тоже является незавершенным и достаточно отдаленным от ядра, чтобы тот, в свою очередь, не пытался что-либо удержать.
Элементы с проблемой недостатка электронов довольно энергичны в реакциях друг с другом, поскольку у них есть потребность в присоединении или отдаче нужного числа электронов.
Распределение электронов по слоям
Размещение электронов на оболочках происходит в установленном для них порядке. Если же получается, что частица изменяет свое местонахождение или число, то электронный слой просто меняется (а именно его физические и химические свойства).
Одинаковое число протонов и электронов в элементе является доказательством того, что общий заряд (электрический) равняется нулю.
Ионы
Изменение количества двух этих частиц способно привести к тому, что атом преобразуется в электрически заряженный.
Если же у атома возникает проблема с большим объемом электронов, он меняется на отрицательный ион.
Ион — заряженная молекула. Ионы бывают катионами и анионами. Есть во всех веществах.
Катион — положительный ион.
Анион — отрицательный ион.
Хлор (Cl), который вобрал в себя всего лишь один электрон, превращается отрицательным ионом (или же анионом). Такой ион будет считаться однозарядным, так как вместил в себя одну частицу. Писаться он будет уже так: Cl⁻.
Кислороду (О), чтобы стать отрицательным ионом, нужно присоединить два электрона. Он будет считаться двухзарядным. Записываться будет вот так: О⁻.
Когда атом превращается в ион, то для окружающего мира он является системой, которая электрически заряжена, что подразумевает появление определенного электрического поля, объединяющее и сам атом, и все происходящее в его зоне контроля. Это электрическое поле позволяет атому контактировать с другими такими же частицами, имеющими заряженность (ионы, электроны и т.д.).
Как и в остальных случаях, ионы, обладающие разными зарядами, притягиваются химически, что приводит к появлению новых, сложных частиц. Ими считаются молекулы.
Окисление
Степень окисления — заряд элемента, находящегося в соединении, который вычислен путем того, что в соединении ковалентная полярная связь превратилась в ионную.
Окисление — важная часть в образовании новых соединений.
Частицы в реакциях
Когда происходит химическая реакция, электроны либо объединяются, либо переходят к более отрицательному атому, чтобы стать заряженными.
Если бы вещества состояли только из ионов, то их заряды имели целые числа, которые равнялись бы количеству электронов (отданных или не отданных). Рассмотрим хлорид натрия (NaCl). Хлор (Cl) отнимает у натрия (Na) один электрон, при этом два элемента становятся ионами, но с разными зарядами. Натрий (Na) становится положительным, то есть катионом (записывается Na⁺¹), а хлор (Cl) — отрицательным, то есть анионом (записывается Cl⁻¹). Перейдем к соляной кислоте (HCl).
В этой паре хлор (Cl) считается самым отрицательным в электрическом плане, поэтому все два электрона (от водорода (Н) и от него) больше направлены к хлору (Cl), а если электрон водорода (Н) перейдет к хлору, что заряды будут полными, а не частичными как в первом случае. Правильная запись выглядит вот так: H+1CI-1.
Эти надстрочные значки и являются степенью окисления.
Правила записи степени окисления
Чтобы правильно записать степень окисления, нужно знать несколько правил:
- Степень окисления располагается над элементом справа;
- Первым делом записывается знак заряда (плюс или минус), не записывать его нельзя, это считается грубой ошибкой;
- После знака следует само значение;
- Даже если степень окисления равна +1 или -1, то она так и записывается без сокращения ( с сокращением, то есть + или -, пишутся только ионы);
- Заряд ионов записывается над ними справа;
- На первом месте в написании заряда стоит значение, а уже только потом знак.
Пример степени окисления: H+2O-2
Пример заряда иона: AL3+ii.
Вычисление степени окисления
Вычисление степени окисления проводится по некоторым пунктам, которых стоит придерживаться:
1.Есть элементы, у которых степень окисления неизменна, к ним относятся:
- щелочные металлы (степень окисления всегда +1);
- металлы из 2А группы (+2);
- алюминий (FI+3) и бор (B+3);
- фтор (F-1);
- часто кислород (О) имеет степень окисления — 2, но есть исключение у пероксидов, где у кислорода (О) -1;
- водород (Н). С неметаллами его степень равна +1, с металлами — -2.
2. Остальное в периодической таблице с плавающей степенью. Если рассмотреть хлор (Cl), то его значения нечетны: начиная от -1, заканчивая +7 (сюда входит +1, +3, +5). А вот у серы (S) все наоборот — она имеет лишь четные: от -2 до +6 (входит +2, +4).
Главное правило: если сложить все степени из соединения, то должен получиться ноль. Также, если состав какого-либо вещества из одного элемента, то его степень будет нулем.
Бывает такое, что соединение из трех составляющих. Ни в коем случае нельзя делать так, как в соединении двух элементов. Значение первого и последнего элементов известны, а значение третьего нужно считать по специальной формуле.
Пример
Возьмем Н3РО4 (фосфорная кислота).
Из правила водород (Н) будет +1, а кислород (О) — -2, осталось узнать о фосфоре (Р). Мы должны сложить все известные значения.
Здесь будем использовать уравнение.
(+1) × 3 + Х + (-2) × 4 = 0
Х = +5
Мы знаем, что сумма всех элементов должна быть нулем, поэтому приравниваем весь пример ему. Перед водородом (Н) стоит цифра 3, поэтому его степень умножаем на это число, то же самое и с кислородом (О). Фосфор (Р) у нас неизвестен, поэтому обозначаем его иксом. Дальше решаем обычным уравнением и вписываем полученное значение над ним.
Если говорить про степень окисления и валентность, то это абсолютно разные вещи. Первое имеет отрицательное или нулевое значения, а второе только положительное.
Ключевые мометы
Эта тема переплела два ответвления — физику и химию, показывая всю многогранность нашей природы и взаимосвязь этих наук. Как мы поняли, некоторые моменты до сих пор непонятны нам, но ученые не останавливаются на достигнутом, продвигаясь дальше. Данный предмет обсуждения, находящийся в этой работе — базовые понятия, написанные доступным языком.
Этот материал разбирал такие маленькие, но важные для нас моменты — атомы, которых мы не видим, хотя они влияют на все вокруг, даже на нас самих.
Чтобы лучше усвоить материал, здесь собраны ключевые моменты из текста, требующие особого внимания:
- Вещества бывают простыми и сложными;
- Атомы — это неразлагающиеся мелкие частицы;
- Чем выше порядковый номер у элемента, тем больше его атомный вес;
- Изотопы — химические элементы под одним порядковым номером, но с разной массой ядер. Есть у любого элемента;
- У атомов есть частицы (элементарные): протоны, нейтроны, электроны;
- Протоны — положительно заряженные частицы, находящиеся в ядре;
- Нейтроны — беззарядные частицы;
- Электроны — частицы, с самым маленьким отрицательным электрическим зарядом;
- Значение протона равно значению электрона;
- Чем быстрее скорость электрона, тем его масса больше;
- Движение электрона волнообразное, упорядоченное, при этом он вращается;
- Интерференция электронов — слияние нескольких волн электронов;
- Дифракция электронов — волновое обтекание области места, через которое проходит ток;
- Порядковый номер — это заряд ядра;
- У каждой частицы есть электрическое поле, позволяющее взаимодействовать с другими частицами;
- Фотон — переносчик электромагнитного “общения” частиц;
- Ядерное поле — вид материи, который состоит из протонов, нейтронов и мезонов.
- Мезон — частица, позволяющая протонам и нейтронам контактировать, а также удерживает их внутри ядра ядерной силой;
- Ядерная сила — сила влияния протона и нейтрона друг на друга;
- Ядерные силы могут из протонов нейтроны и наоборот при помощи мезонов;
- Ядерные силы мощнее электрических;
- Протон, нейтрон и электрон называются элементарными, потому что их невозможно разложить на более простые частицы, но они могут становиться друг другом и образовываться друг из друга;
- Если электрон отдалится от ядра, то он ненадолго образует энергию, но все равно вернется на свое место, тоже образовывая энергию, переходящую в излучение;
- Дозволенные слои — орбиты, на которые электрон может переходить;
- Дейтон — объединение протона и нейтрона в ядре;
- Легкие элементы считаются лучше, потому что их ядра прочнее из-за одинакового числа частиц;
- Число электронных слоев = номер периода;
- У каждой электронной оболочки есть определенное конечное число электронов, которое оно способно вместить;
- Те элементы, у которых оболочки не полностью заполнены, лучше вступают в контакт с другими элементами;
- Ион — заряженная молекула.
- Катион — положительный ион.
- Анион — отрицательный ион;
- Степень окисления — заряд элемента, который вычислен путем того, что в соединении ковалентная полярная связь превратилась в ионную;
- Есть элементы, чья степень окисления постоянна, а есть те, у кого она изменяется;
- Если сложить все степени окисления в соединении, то всё будет равно нулю.
Короткое, но познавательное видео про элементарные частицы:
Элементарные частицы: нейтроны, протоны, электроны. Действительно элементарные?
Когда речь заходит о том, из чего состоят различные окружающие нас объекты, мы сразу начинаем говорить о молекулах, затем об атомах. А из чего же состоят сами атомы? Так ли просто они устроены, как шарик, который мы видели на уроках химии и физике в школе? На самом деле, все не так уж и просто. Для простоты в самом начале скажем, что абсолютное большинство всех вещей в мире состоит из элементарных частиц. Почему не все? Дело в том, что далеко не вся Вселенная изучена человеком, поэтому мы не можем однозначно сказать, все ли состоит из частиц.
Например, свет — это волна, состоящая из элементарных частиц — фотонов, но раньше наука не могла такое сказать.
Теперь об этих самых частицах. Элементарные частицы — это такие частицы, которые человек сейчас расщепить на более маленькие не может, поэтому пока считается, что из них все и состоит. Таких частиц бывает огромное множество, но сегодня же мы будем больше говорить о наиболее популярных из них, а именно — нейтроны, протоны, электроны.
Где встречаются нейтроны, протоны, электроны?
Почему мы сказали выше, что эти три элементарные частицы считаются наиболее популярными? Все просто — из них состоит абсолютно любой атом. Если говорить об этом чуть более подробно, то атом состоит из двух частей:
- ядро атома
- электроны
В свою же очередь ядро атома включает в себя протоны и нейтроны. Таким образом, атом состоит из трех элементарных частиц, две из которых составляют ядро, а множество третьих вращается вокруг этого ядра.
Классификация элементарных частиц
Чтобы получше разобраться в том, какие бывают элементарные частицы и как они взаимодействуют друг с другом, нам нужно разделить их на группы по принципу схожести определенных свойств. Это и называется классификация. Сейчас все поймете.
Разделим по времени жизни
Делить какие-то там частицы по времени жизни звучит очень странно, ведь это неодушевленные предметы и о жизни здесь речь идти не должна. Вы будете абсолютно правы, имея такую точку зрения. Однако в данном случае имеется в виду не жизнь, как существование живого организма, а скорей пребывание в одном и том же состоянии. Если говорить проще, то не все из элементарных частиц могут сохранять свои свойства в течение большого отрезка времени, поэтому мы и решили их так разделить. Итак, разделить в данном случае можно на две группы:
- стабильные (это те частицы, которые как раз могут очень долго сохранять свойства, некоторые даже говорят бесконечно долго). Сюда относятся электроны, фотоны, протоны и другие частицы)
- нестабильные (а это те, которые через некоторый промежуток времени меняют свои свойства и переходят в другие формы). Сюда относятся все остальные виды частиц.
Разделим по тому, как они взаимодействуют
Интересно, что при довольно схожем строении, разные частицы могут взаимодействовать друг с другом совсем по-разному. Давайте посмотрим, как можно разделить элементарные частицы по такому принципу:
- составные
- бесструктурные
Действительно, частицы тоже бывают составные и фундаментальные (по сути самые простые), и от этого многое зависит. Давайте подробно разберемся с каждым из этих видов.
Составные частицы, которые по-другому еще называются адронами (вы наверняка слышали про Адронный коллайдер в Швейцарии) взаимодействуют со всеми частицами. Такое взаимодействие еще называют фундаментальным. Они в свою очередь тоже подразделяются на мезоны и барионы.
Теперь давайте поговорим о фундаментальных частицах. Здесь все гораздо более интересно, ведь таких частиц в мире открыто великое множество. Давайте для начала узнаем, на какие виды разделяются фундаментальные или же бесструктурные частицы:
- кварки
- лептоны
- калибровочные бозоны
Теперь давайте остановимся на каждом виде отдельно и поговорим о нем более подробно. А начать предлагаем с кварков.
Кварки — это такие частицы, которые находятся в составе адронов. Отдельно их встретить ученым пока не удавалось, только в составе других частиц. Для того, чтобы их изучать, ученым приходится использовать различные хитрые методы. Они подразделяются еще на шесть подтипов, но о них сегодня мы говорить не будем. Интересной особенностью кварков является то, что они, являясь фундаментальными частицами, все же участвуют в сильных взаимодействиях.
Теперь давайте перейдем к лептонам (точечным частицам). Это тоже довольно важный вид бесструктурных частиц. Они в отличие от кварков уже не участвуют в сильных взаимодействиях. Однако именно заряженные лептоны все же могут принимать участие в взаимодействии электромагнитном. Здесь так же, как и в кварках, отмечается целых шесть подтипов.
Ну а теперь последний тип с довольно странным для многих названием — калибровочные бозоны. Это тоже немаловажный тип, ведь именно он служит своего рода посредником в различных взаимодействиях между частицами. Чтобы вам было легче запомнить, приведем несколько примеров таких частиц: фотон, гравитон и глюон.
Ядро протон нейтрон электрон
Отлично, когда мы уже знаем довольно много про то, как устроены остальные элементарные частицы, давайте вернемся обратно к протону, нейтрону и электрону. Теперь самое время поговорить об устройстве ядра атома.
Начнем с того, что в ядре атома собран весь его положительный заряд, который обеспечивается протонами. Несмотря на большой заряд, размеры ядра очень малы по сравнению с электронными орбитами (орбиты, по которым вращается электрон вокруг ядра). В среднем они колеблются от 10 в минус 15 степени до 10 в минус 14 степени. Как мы помним из школьного курса химии количество протонов атома — это номер Z атома и порядковый номер элемента в таблице Менделеева. Примечательно также то, что количество протонов и электронов в атоме всегда одинаково.
Наверняка вам очень интересно, почему ядро атома, которое тоже состоит из элементарных частиц, такое плотное. Дело в том, что связь между протонами и нейтронами не является ни гравитационной, и электромагнитной, но при этом она в несколько раз сильнее, чем связь между ядром и электроном.
Число протонов нейтронов и электронов
Как мы уже поняли выше, в атоме абсолютно всегда количество протонов и электронов равно. Это обусловлено тем, что заряд должен быть нейтрален, а значит и количество положительных должно равняться количеству отрицательных частиц (отметим, что заряд протона +1, а заряд электрона -1). Также напомним, что количество протонов дает нам порядковый номер в таблице Менделеева этого атома. Теперь поговорим о нейтронах. Можно ли каким-то образом определить их количество внутри атома? Конечно можно. Это можно сделать, зная массу атома и количество протонов. Нужно просто вычесть из массы атома количество протонов и мы получим количество нейтронов (иногда нужно округлять). Для примера возьмем Медь (Cu). Ее атомная масса примерно равна 64, а номер в таблице 29, значит количество нейтронов будет равно 64 — 29 = 35. Все очень просто.
3 протона 3 нейтрона 3 электрона
Теперь для того, чтобы получше разобраться в этой теме, давайте попробуем все понять на примере другого атома. Это, как вы могли уже догадаться, атом Лития. У него 3 протона, 3 нейтрона и 3 электрона. По той формуле, которую мы уже узнали выше, тут сразу можно понять, что примерная масса атома Лития будет равна 6 (3 нейтрона + 3 протона). Также мы сходу можем сказать, что номер Лития в таблице Менделеева тоже 3 (количество протонов).
Теперь давайте посмотрим на таблицу Менделеева, представленную выше. Действительно, у Лития именно 3 номер и масса равна 6,941.
Видите, как все легко и просто. Однако особенно внимательный читатель уже давно заметил ошибку. Действительно, округлив массу Лития мы понимаем, что здесь количество нейтронов будет равно 4. Как же так получается, что у нас 3 нейтрона. Это подводит нас к следующей теме, о которой мы сейчас и поговорим.
Протон изотоп нейтрон электрон
Наверное, на одном из школьных уроков вы слышали такой термин, как изотоп. В школе это была та самая тема, после которой я полюбил естественные науки. Сейчас я не могу дать однозначный ответ, почему, просто было очень интересно. Итак, изотопы.
Что такое изотоп
Если говорить просто, то Изотопы представляют собой измененную модель обычного атома какого-то вещества. То есть возьмем любой атом какого-то вещества. У него есть фиксированное количество электронов, протонов и электронов. Однако, как мы уже заметили выше, это количество может быть и другим благодаря существованию изотопов. У изотопов такой же порядковый номер элемента в таблице Менделеева, а значит, как мы уже поняли, у них точно такое же количество протонов. Однако, есть отличия в массе элемента, а значит и в количестве нейтронов. Теперь давайте узнаем, как нам пригодится эта информация и как определить, что перед нами изотоп какого-то элемента.
Как определить, что перед нами изотоп
Наверняка самые догадливые и внимательные из вас уже догадались, что обычная формула с определением количества нейтронов с изотопами не работает от слова совсем, ведь это уже измененная модель обыкновенного элемента. Раз так, то мы можем просто попробовать подставить данные по атому в нашу формулу и понять, работает она или нет. Если нет, то перед нами изотоп. Но естественно, для удобства ученые придумали специальные обозначения для изотопов, чтобы нам, обычным людям, было удобнее с ними работать и изучать их. Как же эти обозначения работаю. А очень просто!
У изотопов после названия еще дописывается количество нуклонов в ядре (то есть количество элементарных частиц внутри ядра, сумма протонов и нейтронов). Давайте разберемся на примере очень популярного изотопа урана-235, радиоактивного урана. Обычный же уран по сути называется уран-238.
Зачем нам это знать?
Как вы уже могли понять, все многообразие элементарных частиц не ограничивается таблицей Менделеева и элементами, которые в ней представлены. У некоторых элементов бывает сразу несколько популярных изотопов, поэтому если вы хотите действительно хорошо разбираться в этой теме, то и запоминание всех популярных изотопов не будет лишним. А эта таблица вам в этом поможет:
Отлично, теперь мы уже неплохо разобрались с массой атома, таблицей Менделеева и разобрали основные типы элементарных частиц. Пришло время поговорить о более серьезных вещах. О чем же?
Радиоактивность
Для многих, кто в школе проходил эту тему лишь вскользь, это понятие выглядит очень страшным и непонятным. Кроме того, у многих на ум приходят различные катастрофы, косвенно связанные с этим понятием. Ну кто из вас сейчас не подумал о Хиросиме или о Чернобыле? Однако мы сейчас будем развеивать все эти мифы и стереотипы и хорошенько разберемся в этой далеко не легкой, но при этом очень интересной теме.
Как это работает?
Для того, чтобы разобраться в чем-либо, нужно сначала понять, с чего все начинается. В данном случае все идет от превращения атомов, а точнее от превращения их ядер. Интересно здесь то, что процесс этот самопроизвольный, то есть для того, чтобы он начался, нужно все-таки воздействовать извне, но как только превращения ядер начались, их уже не остановить! Да, далее произойдет именно то, о чем вы думаете. Ядро, с которого и начнется этот необыкновенно интересный с одной стороны и ужасно опасный с другой процесс называется материнским. Соответственно, если радиоактивный процесс затрагивает какое-то ядро помимо материнского, оно будет считаться дочерним, а 2 ядра, между которыми произошел обмен, называют генетически связанными — все как у людей.
Что такое радиоактивный распад?
Разумеется, радиоактивный распад встречается и в природе, однако происходит он крайне редко и не приносит никакого весомого вреда. А вот искусственный распад — штука очень опасная, если уметь ей управлять. Вся суть в том, что самопроизвольно меняется количество элементарных частиц. Существует несколько типов распадов и зависит этот тип от того, какие частицы будет испускать наш атом. Если это будут 2 протона и 2 нейтрона, то это положительно заряженная частица, называемая альфа-частицей. Соответственно, такой распад будет называться альфа-распадом. А вот с бета-частицами все немного посложнее.
Существует сразу 2 типа таких частиц: электроны и позитроны. Если эта частица электрон, то она обязательно образована нейтроном, распавшимся на протон и электрон. Если же эта бета-частица позитрон, то она всегда образована протоном, который распался на нейтрон и электрон. Распад, при котором из атома вылетает бета-частица — это уже бета-распад. Существует еще и менее популярный тип распада (изомерный переход или гамма-распад), при котором из атома вылетают гамма-кванты. Тут все еще сложнее, ведь такой изомерный переход никогда не бывает один. О чем я говорю? Дело в том, что гамма-распад очень часто сопровождают и другие типы распада. Это происходит в тот момент, когда частица распадается в первый раз. На этом этапе могут произойти другие виды распадов, а уж только потом процесс переходит непосредственно к гамма-распаду.
А в природе где это все можно встретить?
Как мы уже сказали выше, в природе тоже встречается радиоактивность. Если немного подумать, то оказывается, что радиоактивны по сути все вещества, у которых нет стабильных изотопов (кто еще не знает, что это, почитайте о них выше). Так вот, ученые пошли еще дальше и подошли к этому вопросу системно. В итоге они получили, что оказывается по таблице менделеева радиоактивны по своей природе вещества, у которых номер 83 или больше. Однако это если мы говорим о тех веществах, которые однозначно радиоактивны.
А ведь встречаются и немного другие. Например среди элементов с атомной массой поменьше встречаются такие, у изотопов которых очень большой период полураспада. Для примера возьмем теллур-128. У обычного теллура номер в таблице Менделеева 52, а значит он не подходит под первую группу, верно? И это неудивительно, ведь его изотоп теллур-128 так стабилен, что его период полураспада примерно в 2 раза больше, чем( 10 в степени 15 миллиардов лет). Неплохо, верно? Спешим вас успокоить, это элемент с самым большим периодом полураспада, но все-таки это очень много, ведь наша земля в миллиарды раз моложе. А для чего нужны все эти цифры? Это как-то практически применимо? Ну конечно, с помощью этих данных можно определять возраст многих минералов, горных пород и даже возраст планет в космосе! А ведь вы еще не знаете, что же такое период полураспада. Давайте разберемся с этим важнейшим понятием.
А что такое период полураспада?
Говоря о том, где можно встретить радиоактивность в природе, мы затронули такой термин, о котором еще не говорили. Что-ж, это неплохой повод, что это сделать сейчас. Так вот, период полураспада — это такое время, за которое частица распадается.
Но почему же именно ПОЛУраспад? Ну да, здесь все не так просто. Если говорить точнее, то это время, за которое она (частица) распадается с вероятностью 50 процентов. Теперь более понятно, верно?
Как вы уже могли догадаться у одной и той же частицы периоды полураспада могут отличаться в зависимости от изотопов. Однако для изотопа частицы это число постоянно.
Заключение
Как вы уже поняли, об элементарных частицах можно говорить очень много и говорить о них можно бесконечно много. Однако на этом наше небольшое вводное повествование о них предлагаем закончить. Если вам понравилась эта статья и вы хотите, чтобы мы публиковали больше материала на эту тему, то не забудьте проявить немного активности ниже. Напомним также, что на нашем сайте есть множество статей на смежные тематики, поэтому предлагаем вам с ними ознакомиться. До скорых встреч!
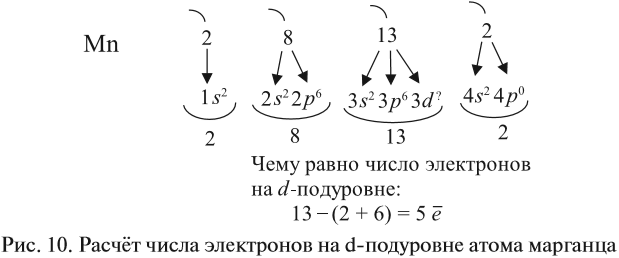
Темы кодификатора ЕГЭ: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Одну из первых моделей строения атома — «пудинговую модель» — разработал Д.Д. Томсон в 1904 году. Томсон открыл существование электронов, за что и получил Нобелевскую премию. Однако наука на тот момент не могла объяснить существование этих самых электронов в пространстве. Томсон предположил, что атом состоит из отрицательных электронов, помещенных в равномерно заряженный положительно «суп», который компенсирует заряд электронов (еще одна аналогия — изюм в пудинге). Модель, конечно, оригинальная, но неверная. Зато модель Томсона стала отличным стартом для дальнейших работ в этой области.
И дальнейшая работа оказалась эффективной. Ученик Томсона, Эрнест Резерфорд, на основании опытов по рассеянию альфа-частиц на золотой фольге предложил новую, планетарную модель строения атома.
Согласно модели Резерфорда, атом состоит из массивного, положительно заряженного ядра и частиц с небольшой массой — электронов, которые, как планеты вокруг Солнца, летают вокруг ядра, и на него не падают.
Модель Резерфорда оказалась следующим шагом в изучении строения атома. Однако современная наука использует более совершенную модель, предложенную Нильсом Бором в 1913 году. На ней мы и остановимся подробнее.
Атом — это мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
При этом электроны двигаются не по определенной орбите, как предполагал Резерфорд, а довольно хаотично. Совокупность электронов, которые двигаются вокруг ядра, называется электронной оболочкой.
Атомное ядро, как доказал Резерфорд — массивное и положительно заряженное, расположено в центральной части атома. Структура ядра довольно сложна, и изучается в ядерной физике. Основные частицы, из которых оно состоит — протоны и нейтроны. Они связаны ядерными силами (сильное взаимодействие).
Рассмотрим основные характеристики протонов, нейтронов и электронов:
| Протон | Нейтрон | Электрон | |
| Масса | 1,00728 а.е.м. | 1,00867 а.е.м. | 1/1960 а.е.м. |
| Заряд | + 1 элементарный заряд | 0 | — 1 элементарный заряд |
1 а.е.м. (атомная единица массы) = 1,66054·10-27 кг
1 элементарный заряд = 1,60219·10-19 Кл
И — самое главное. Периодическая система химических элементов, структурированная Дмитрием Ивановичем Менделеевым, подчиняется простой и понятной логике: номер атома — это число протонов в ядре этого атома. Причем ни о каких протонах Дмитрий Иванович в XIX веке не слышал. Тем гениальнее его открытие и способности, и научное чутье, которое позволило перешагнуть на полтора столетия вперёд в науке.
Следовательно, заряд ядра Z равен числу протонов Np, т.е. номеру атома в Периодической системе химических элементов.
Атом — это электронейтральная частица, следовательно, число протонов Np равно числу электронов Ne:
Ne = Np = Z.
Масса атома (массовое число A) примерно равна суммарной массе крупных частиц, которые входят в состав атома — протонов и нейтронов. Поскольку масса протона и нейтрона примерно равна 1 атомной единице массы, можно использовать формулу, связывающую массовое число М число протонов Np и число нейтронов Nn:
M = Np + Nn
Массовое число указано в Периодической системе химических элементов в ячейке каждого элемента.
Обратите внимание! При решении задач ЕГЭ массовое число всех атомов, кроме хлора, округляется до целого по правилам математики. Массовое число атома хлора в ЕГЭ принято считать равным 35,5.
Таким образом, рассчитать число нейтронов в атоме можно, вычтя из массового числа номер атома: Nn = M – Z.
В Периодической системе собраны химические элементы — атомы с одинаковым зарядом ядра. Однако, может ли меняться у этих атомов число остальных частиц? Вполне. Например, атомы с разным числом нейтронов называют изотопами данного химического элемента. У одного и того же элемента может быть несколько изотопов.
Попробуйте ответить на вопросы. Ответы на них — в конце статьи:
- У изотопов одного элемента массовое число одинаковое или разное?
- У изотопов одно элемента число протонов одинаковое или разное?
Химические свойства атомов определяются строением электронной оболочки и зарядом ядра. Таким образом, химические свойства изотопов одного элемента практически не отличаются.
Поскольку атомы одного элемента могут существовать в форме разных изотопов, в названии часто указывается массовое число, например, хлор-35, и принята такая форма записи атомов:
Еще немного вопросов:
3. Определите количество нейтронов, протонов и электронов в изотопе брома-81.
4. Определите число нейтронов в изотопе хлора-37.
Строение электронной оболочки
Согласно квантовой модели строение атома Нильса Бора, электроны в атоме могут двигаться только по определенным (стационарным) орбитам, удаленным от ядра на определенное расстояние и характеризующиеся определенной энергией. Другое название стационарны орбит — электронные слои или энергетические уровни.
Электронные уровни можно обозначать цифрами — 1, 2, 3, …, n. Номер слоя увеличивается мере удаления его от ядра. Номер уровня соответствует главному квантовому числу n.
В одном слое электроны могут двигаться по разным траекториям. Траекторию орбиты характеризует электронный подуровень. Тип подуровня характеризует орбитальное квантовое число l = 0,1, 2, 3 …, либо соответствующие буквы — s, p, d, g и др.
В рамках одного подуровня (электронных орбиталей одного типа) возможны варианты расположения орбиталей в пространстве. Чем сложнее геометрия орбиталей данного подуровня, тем больше вариантов их расположения в пространстве. Общее число орбиталей подуровня данного типа l можно определить по формуле: 2l+1. На каждой орбитали может находиться не более двух электронов.
| Тип орбитали | s | p | d | f | g |
| Значение орбитального квантового числа l | 0 | 1 | 2 | 3 | 4 |
| Число атомных орбиталей данного типа 2l+1 | 1 | 3 | 5 | 7 | 9 |
| Максимальное количество электронов на орбиталях данного типа | 2 | 6 | 10 | 14 | 18 |
Получаем сводную таблицу:
|
Номер уровня, n |
Подуровень | Число
АО |
Максимальное количество электронов |
| 1 | 1s | 1 | |
| 2 | 2s | 1 | |
| 2p | 3 | ||
|
3 |
3s | 1 | |
| 3p | 3 | ||
| 3d | 5 | ||
|
4 |
4s | 1 | |
| 4p | 3 | ||
| 4d | 5 | ||
| 4f | 7 |
|
Заполнение электронами энергетических орбиталей происходит согласно некоторым основным правилам. Давайте остановимся на них подробно.
Принцип Паули (запрет Паули): на одной атомной орбитали могут находиться не более двух электронов с противоположными спинами (спин — это квантовомеханическая характеристика движения электрона).
Правило Хунда. На атомных орбиталях с одинаковой энергией электроны располагаются по одному с параллельными спинами. Т.е. орбитали одного подуровня заполняются так: сначала на каждую орбиталь распределяется по одному электрону. Только когда во всех орбиталях данного подуровня распределено по одному электрону, занимаем орбитали вторыми электронами, с противоположными спинами.
Таким образом, сумма спиновых квантовых чисел таких электронов на одном энергетическом подуровне (оболочке) будет максимальной.
Например, заполнение 2р-орбитали тремя электронами будет происходить так: , а не так:
Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n + l. Если сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n.
| АО | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| n | 1 | 2 | 2 | 3 | 3 | 3 | 4 | 4 | 4 | 4 | 5 | 5 | 5 | 5 | 5 |
| l | 0 | 0 | 1 | 0 | 1 | 2 | 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | 4 |
| n + l | 1 | 2 | 3 | 3 | 4 | 5 | 4 | 5 | 6 | 7 | 5 | 6 | 7 | 8 | 9 |
Таким образом, энергетический ряд орбиталей выглядит так:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f~5d < 6p < 7s <5f~6d …
Электронную структуру атома можно представлять в разных формах — энергетическая диаграмма, электронная формула и др. Разберем основные.
Энергетическая диаграмма атома — это схематическое изображение орбиталей с учетом их энергии. Диаграмма показывает расположение электронов на энергетических уровнях и подуровнях. Заполнение орбиталей происходит согласно квантовым принципам.
Например, энергетическая диаграмма для атома углерода:
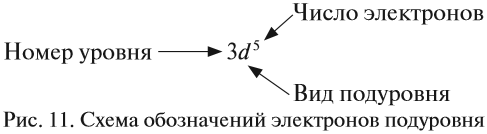
Электронная формула — это запись распределения электронов по орбиталям атома или иона. Сначала указывается номер уровня, затем тип орбитали. Верхний индекс справа от буквы показывает число электронов на орбитали. Орбитали указываются в порядке заполнения. Запись 1s2 означает, что на 1 уровне s-подуровне расположено 2 электрона.
Например, электронная формула углерода выглядит так: 1s22s22p2.
Для краткости записи, вместо энергетических орбиталей, полностью заполненных электронами, иногда используют символ ближайшего благородного газа (элемента VIIIА группы), имеющего соответствующую электронную конфигурацию.
Например, электронную формулу азота можно записать так: 1s22s22p3 или так: [He]2s22p3.
1s2 = [He]
1s22s22p6 = [Ne]
1s22s22p63s23p6 = [Ar] и так далее.
Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s22s1 1s 2s
У бериллия 2s-подуровень заполнен:
+4Be 1s22s2 1s 2s
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s22s22p1 1s 2s
2p
У следующего элемента, углерода, очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s22s22p2 1s 2s
2p
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
5. Азот
6. Кислород
7. Фтор
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s22s22p6 1s 2s
2p
У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s22s22p63s1 1s 2s
2p
3s
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
8. Магний
9. Алюминий
10. Кремний
11. Фосфор
12. Сера
13. Хлор
14. Аргон
А вот начиная с 19-го элемента, калия, иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей, а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия:
+19K 1s22s22p63s23p64s11s 2s
2p
3s
3p
4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K [Ar]4s1 [Ar] 4s
У кальция 4s-подуровень заполнен:
+20Ca [Ar]4s2 [Ar] 4s
У элемента 21, скандия, согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc [Ar]3d14s2 [Ar] 4s 3d
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия:
+22Ti [Ar]3d24s2 [Ar] 4s 3d
+23V [Ar]3d34s2 [Ar] 4s 3d
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr [Ar]3d54s1 [Ar] 4s 3d
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d44s2) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбиталей. Этот эффект так и называется — «провал» или «проскок» электрона. И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца:
+25Mn [Ar]3d54s2
Аналогично у кобальта и никеля. А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень:
+29Cu [Ar]3d104s1
На цинке завершается заполнение 3d-подуровня:
+30Zn [Ar]3d104s2
У следующих элементов, от галлия до криптона, происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия:
+31Ga [Ar]3d104s24p1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно.
Некоторые важные понятия:
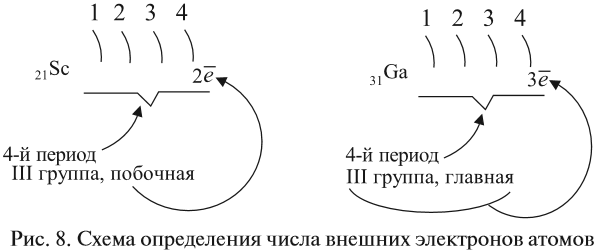
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны.
Например, у меди ([Ar]3d104s1) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвовать в образовании химической связи. Например, у хрома (+24Cr [Ar]3d54s1) валентными являются не только электроны внешнего энергетического уровня (4s1), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Основное и возбужденное состояние атома
Электронные формулы, которые мы составляли до этого, соответствуют основному энергетическому состоянию атома. Это наиболее выгодное энергетически состояние атома.
Однако, чтобы образовывать химические связи, атому в большинстве ситуаций необходимо наличие неспаренных (одиночных) электронов. А химические связи энергетически очень для атома выгодны. Следовательно, чем больше в атоме неспаренных электронов — тем больше связей он может образовать, и, как следствие, перейдёт в более выгодное энергетическое состояние.
Поэтому при наличии свободных энергетических орбиталей на данном уровне спаренные пары электронов могут распариваться, и один из электронов спаренной пары может переходить на вакантную орбиталь. Таким образом число неспаренных электронов увеличивается, и атом может образовать больше химических связей, что очень выгодно с точки зрения энергии. Такое состояние атома называют возбуждённым и обозначают звёздочкой.
Например, в основном состоянии бор имеет следующую конфигурацию энергетического уровня:
+5B 1s22s22p1 1s 2s
2p
На втором уровне (внешнем) одна спаренная электронная пара, один одиночный электрон и пара свободных (вакантных) орбиталей. Следовательно, есть возможность для перехода электрона из пары на вакантную орбиталь, получаем возбуждённое состояние атома бора (обозначается звёздочкой):
+5B* 1s22s12p2 1s 2s
2p
Попробуйте самостоятельно составить электронную формулу, соответствующую возбуждённому состоянию атомов. Не забываем проверять себя по ответам!
15. Углерода
16. Бериллия
17. Кислорода
Электронные формулы ионов
Атомы могут отдавать и принимать электроны. Отдавая или принимая электроны, они превращаются в ионы.
Ионы — это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним, что число протонов в атоме равно числу электронов, а при отдаче электронов число протонов будет больше числа электронов). Положительно заряженные ионы — это катионы. Например: катион натрия образуется так:
+11Na 1s22s22p63s1 -1е = +11Na+ 1s22s22p63s0
Если атом принимает электроны, то приобретает отрицательный заряд. Отрицательно заряженные частицы — это анионы. Например, анион хлора образуется так:
+17Cl 1s22s22p63s23p5 +1e = +17Cl— 1s22s22p63s23p6
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома. Обратите внимание, при образовании катионов электроны уходят с внешнего энергетического уровня. При образовании анионов электроны приходят на внешний энергетический уровень.
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са2+
19. Ион S2-
20. Ион Ni2+
В некоторых случаях совершенно разные атомы образуют ионы с одинаковой электронной конфигурацией. Частицы с одинаковой электронной конфигурацией и одинаковым числом электронов называют изоэлектронными частицами.
Например, ионы Na+ и F—.
Электронная формула катиона натрия: Na+ 1s22s22p6, всего 10 электронов.
Электронная формула аниона фтора: F— 1s22s22p6, всего 10 электронов.
Таким образом, ионы Na+ и F— — изоэлектронные. Также они изоэлектронны атому неона.
Тренажер по теме «Строение атома» — 10 вопросов, при каждом прохождении новые.
412
Создан на
03 января, 2022 От Admin
Тренировочный тест “Строение атома”
Тренировочный тест по теме “Строение атома”
1 / 10
1) C 2) N 3) F 4) Be 5) Ne
Определите, атомы каких из указанных в ряду элементов в основном состоянии не содержат неспаренных электронов.
2 / 10
1) Cr 2) P 3) Na 4) Si 5) N
Определите элементы, атомы которых в основном состоянии содержат на внешнем уровне один неспаренный электрон.
3 / 10
1) S 2) Cu 3) Cl 4) Si 5) Mg
Определите элементы, атомы которых в основном состоянии содержат один неспаренный электрон.
4 / 10
1) Sn 2) Fe 3) C 4) Pb 5) Cr
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют валентные электроны как на s-, так и на d-подуровнях.
5 / 10
1) N 2) Mn 3) Ca 4) Br 5) F
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют одинаковую электронную конфигурацию внешнего энергетического уровня.
6 / 10
1) Cs 2) Be 3) B 4) Cr 5) N
Определите элементы, атомы которых в основном состоянии имеют электронную формулу внешнего энергетического уровня ns1.
7 / 10
1) S 2) Na 3) Al 4) Si 5) Mg
Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат один неспаренный электрон.
8 / 10
1) K 2) Na 3) Cr 4) Mg 5) Se
Определите элементы, атомы которых в основном состоянии имеют одинаковую электронную конфигурацию внешнего слоя.
9 / 10
1) Na 2) K 3) Al 4) N 5) Rb
Определите элементы, катионы которых имеют электронную формулу внешнего энергетического уровня 2s22p6.
10 / 10
1) O 2) C 3) Al 4) Si 5) P
Определите, атомы каких из указанных в ряду элементов в возбуждённом состоянии содержат четыре неспаренных электрона.
Ваша оценка
The average score is 37%
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
3. Массовое число изотопа брома-81 равно 81. Атомный номер = заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота:
+7N 1s22s22p3 1s 2s
2p
6. Электронная формула кислорода:
+8О 1s22s22p4 1s 2s
2p
7. Электронная формула фтора:
8. Электронная формула магния:
+12Mg 1s22s22p63s2 1s 2s
2p
3s
9. Электронная формула алюминия:
+13Al 1s22s22p63s23p1 1s 2s
2p
3s
3p
10. Электронная формула кремния:
+14Si 1s22s22p63s23p2 1s 2s
2p
3s
3p
11. Электронная формула фосфора:
+15P 1s22s22p63s23p3 1s 2s
2p
3s
3p
12. Электронная формула серы:
+16S 1s22s22p63s23p4 1s 2s
2p
3s
3p
13. Электронная формула хлора:
14. Электронная формула аргона:
+18Ar 1s22s22p63s23p6 1s 2s
2p
3s
3p
15. Электронная формула углерода в возбуждённом состоянии:
+6C* 1s22s12p3 1s 2s
2p
16. Электронная формула бериллия в возбуждённом состоянии:
+4Be 1s22s12p1 1s 2s
2p
17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са2+: +20Ca2+ 1s22s22p63s23p6
19. Электронная формула аниона серы S2-: +16S2- 1s22s22p63s23p6
20. Электронная формула катиона никеля Ni2+: +28Ni2+ 1s22s22p63s23p63d84s0. Обратите внимание! Атомы отдают электроны всегда сначала с внешнего энергетического уровня. Поэтому никель отдаёт электроны сначала с внешнего 4s-подуровня.
Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами)
Вспомните:
- что такое атом;
- из чего состоит атом;
- изменяется ли атом в химических реакциях?
АТОМ — это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Число электронов в ходе химических процессов может изменяться, но заряд ядра всегда остается неизменным. Зная распределение электронов в атоме (строение атома), можно предсказать многие свойства данного химического элемента, а также простых и сложных веществ, в состав которых этот элемент входит.
Содержание
- Структура Периодической системы Менделеева
- Ядро атома. Изотопы
- Распределение электронов в поле ядра атома
- Строение атома и свойства элементов
- Выводы
Структура Периодической системы Менделеева
Строение атома, т. е. состав ядра, распределение электронов вокруг ядра, несложно определить по положению элемента в Периодической системе. В Периодической системе Менделеева химические элементы располагаются в определённой последовательности. Эта последовательность тесно связана со строением атома этих элементов. Каждому химическому элементу в системе присвоен порядковый номер, кроме того, для него можно указать:
- номер периода;
- номер группы;
- вид подгруппы.
Зная точный «адрес» химического элемента, т. е. его группу, подгруппу и номер периода, можно однозначно определить строение его атома.
Период — это горизонтальный ряд химических элементов. В современной Периодической системе семь периодов. Первые три — малые, так как они содержат 2 или 8 элементов:
- 1-й период — Н, Не — 2 элемента;
- 2-й период — Li…Nе — 8 элементов;
- 3-й период — Na…Аr — 8 элементов.
Остальные периоды — большие. Каждый из них содержит 2–3 ряда элементов:
- 4-й период (2 ряда) — К…Кr — 18 элементов;
- 6-й период (3 ряда) — Сs…Rn — 32 элемента. В этот период входит ряд лантаноидов.
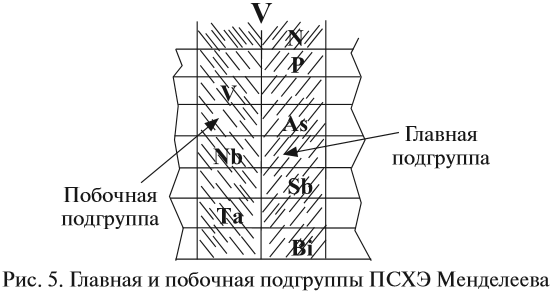
Группа — вертикальный ряд химических элементов. Всего групп восемь. Каждая группа состоит из двух подгрупп: главной подгруппы и побочной подгруппы (см. рис. 5).
Главную подгруппу (подгруппу А) образуют химические элементы малых периодов и больших периодов. На рисунке 5 показано, что главную подгруппу пятой группы составляют элементы малых периодов (N, P) и больших периодов (As, Sb, Bi).
Побочную подгруппу (подгруппу Б) образуют химические элементы только больших периодов. В нашем случае это V, Nb, Ta.
Визуально эти подгруппы различить легко: главная подгруппа «высокая», начинается с первого или второго периода. Побочная подгруппа — «низкая», начинается с 4-го периода.
Итак, каждый химический элемент Периодической системы имеет свой адрес:
- период;
- группу;
- подгруппу;
- порядковый номер.
Например, ванадий (V) — это химический элемент 4-го периода, V группы, побочной подгруппы, порядковый номер 23.
Задание 3.1. Укажите период, группу и подгруппу для химических элементов с порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и название химического элемента, если известно, что он находится:
- в 4-м периоде, VI группе, побочной подгруппе;
- в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать эти сведения об элементе со строением его атома?
Ядро атома. Изотопы
Атом состоит из ядра, которое имеет положительный заряд, и электронов, которые имеют отрицательный заряд. В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
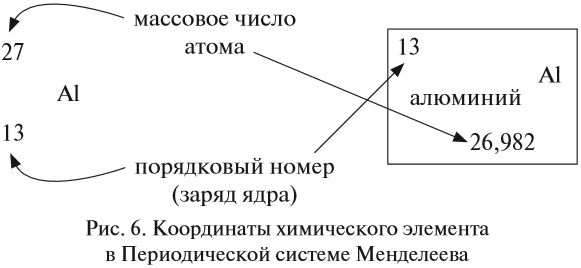
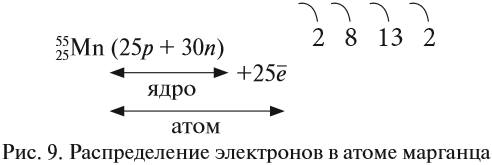
Ядро атома — сложная частица. В ней сосредоточена почти вся масса атома. Поскольку химический элемент — совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают (рис. 6).
По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
- Протон (р) имеет массу, равную 1 (1,0073 а. е. м.) и заряд, равный +1.
- Нейтрон (n) заряда не имеет (нейтрален), а масса его приблизительно равна массе протона (1,0087 а. е. м.).
Какие частицы определяют заряд ядра? Протоны! Причём число протонов равно (по величине) заряду ядра атома, т. е. порядковому номеру:
Число нейтронов определяют по разности между величинами: «масса ядра» и «порядковый номер».
Задание 3.3. Определите состав ядер атомов, если химический элемент находится в:
- 3-м периоде, VII группе, главной подгруппе;
- 4-м периоде, IV группе, побочной подгруппе;
- 5-м периоде, I группе, главной подгруппе.
Обратите внимание, что при определении массового числа ядра атома приходится округлять атомную массу, указанную в Периодической системе! Почему? Ведь массы протона и нейтрона практически целочисленны, а массой электронов можно пренебречь.
Для того,чтобы ответить на этот вопрос, нужно понять:
- Что происходит с атомом в ходе химических процессов;
- Что такое «химический элемент».
В химических процессах обязательно изменяется распределение электронов вокруг ядра или даже изменяется их число. В последнем случае атом отдаёт или принимает электроны и превращается в заряженную частицу — ион. Но в химических реакциях никогда не меняется состав ядра атома, его заряд. Поэтому заряд ядра атома является своеобразным «паспортом» химического элемента.
Химический элемент — совокупность атомов или ионов с одинаковым зарядом ядра.
Для того чтобы разобраться, попробуйте определить, какие из ядер, состав которых указан ниже, принадлежат одному и тому же химическому элементу:
Атомам одного химического элемента принадлежат ядра А и В, так как они содержат одинаковое число протонов, т. е. заряд этих ядер одинаковый. Но ведь у них разная масса! Исследования показывают, что масса атома не оказывает существенного влияния на его химические свойства. Поэтому атомы одного и того же химического элемента (одинаковое число протонов), но с разной массой (разное число нейтронов) являются ИЗОТОПАМИ* этого элемента.
* Слово «изотоп» означает по смыслу «одно место», т. е. все изотопы данного химического элемента находятся в одной клетке ПСХЭ.
В таблице Менделеева указана средняя атомная масса всех природных изотопов данного элемента (Аr). Изотопы и их химические соединения отличаются друг от друга по физическим свойствам, но химические свойства у изотопов одного химического элемента одинаковы. Так, изотоп углерода-14 (14С) имеет такие же химические свойства, как и углерод-12 (12С), который входит в ткани любого живого организма, отличаясь от него только радиоактивностью. Поэтому изотопы применяют для диагностики и лечения различных заболеваний, для научных исследований.
Элемент «водород» встречается в природе в виде трёх изотопов:
Химический элемент «кислород» также представлен тремя природными изотопами:
Задание 3.4. Укажите состав ядер этих изотопов водорода и кислорода.
Если разные вещества содержат атомы одного и того же химического элемента, это не означает, что эти вещества имеют одни те же свойства. Например, химический элемент «хлор» в виде атомарного хлора Cl• разрушает метан, а также атмосферный озон. Тот же элемент в виде молекулярного хлора Cl2 ядовит, активно реагирует с водой, многими металлами, а ионы хлора (химический элемент — тот же!) в составе NaCl химически инертен, а с биологической точки зрения не только безвреден, но и полезен для нас. Эти ионы являются макроэлементами нашей пищи, которые входят в состав крови, желудочного сока. Суточная потребность — до 6 граммов.
Но вернемся к описанию строения атома.
Распределение электронов в поле ядра атома
Как известно, ядро атома в химических процессах не меняется. А что меняется? Общее число электронов и распределение электронов. Общее число электронов определить несложно: оно равно порядковому номеру, т. е. заряду ядра атома:
Электроны имеют отрицательный заряд –1, а масса их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны отталкиваются и поэтому находятся на разных расстояниях от ядра. При этом электроны, имеющие приблизительно равный запас энергии, образуют энергетический уровень.
Число энергетических уровней в атоме равно номеру периода, в котором находится химический элемент. Энергетические уровни условно обозначают так (рис. 7).
Задание 3.5. Определите число энергетических уровней в атомах кислорода, магния, кальция, свинца.
На каждом энергетическом уровне может находиться ограниченное число электронов:
- на первом энергетическом уровне не более 2 электронов;
- на втором энергетическом уровне не более 8 электронов;
- на третьем энергетическом уровне не более 18 электронов.
ЗАПОМНИТЕ ЭТИ ЧИСЛА!
Они показывают, что, например, на втором энергетическом уровне может находиться 2 или 5 или 7 электронов, но не может быть 9 или 12 электронов.
Важно знать, что, независимо от номера энергетического уровня, на внешнем (последнем) уровне не может быть больше восьми электронов. Внешний восьмиэлектронный энергетический уровень является наиболее устойчивым и называется завершённым. Такие энергетические уровни имеются у самых неактивных элементов — благородных газов.
Как определить число электронов на внешнем уровне остальных атомов? Для этого существует простое правило – число внешних электронов равно:
- для элементов главных подгрупп — номеру группы;
- для элементов побочных подгрупп — оно не может быть больше двух (рис. 8).
Например:
Задание 3.6. Укажите число внешних электронов для химических элементов с порядковыми номерами 15, 25, 30, 53.
Задание 3.7. Найдите в Периодической системе химические элементы, в атомах которых имеется завершённый внешний уровень.
Очень важно правильно определять число внешних электронов, так как именно с ними связаны важнейшие свойства атома. Так, в химических реакциях атомы стремятся «приобрести» устойчивый, завершённый внешний уровень (8ē). Для этого атомы, на внешнем уровне которых мало электронов, «предпочитают» их отдать.
Химические элементы, атомы которых способны только отдавать электроны, относятся к МЕТАЛЛАМ. Очевидно, что на внешнем уровне атома металла должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома много электронов, то такие атомы стремятся принять электроны до завершения внешнего энергетического уровня, т. е. до восьми электронов. Такие элементы относятся к НЕМЕТАЛЛАМ.
Вопрос. К каким элементам (металлам или неметаллам) относятся химические элементы побочных подгрупп? Почему?
Металлы и неметаллы главных подгрупп в таблице Менделеева отделяет линия, которую можно провести от бора к астату. Выше этой линии (и на линии) располагаются неметаллы, ниже — металлы.
Задание 3.8. Определить, к металлам или неметаллам относятся: фосфор, ванадий, кобальт, селен, висмут. Вывод сделайте, определив положение элемента в Периодической системе химических элементов и число электронов на внешнем уровне.
Для того чтобы составить распределение электрона по остальным уровням и подуровням, следует воспользоваться следующим АЛГОРИТМОМ:
- Определить общее число электронов в атоме (по порядковому номеру).
- Определить число энергетических уровней (по номеру периода).
- Определить число внешних электронов (по виду подгруппы и номеру группы).
- Указать число электронов на всех уровнях, кроме предпоследнего.
- Рассчитать число электронов на предпоследнем уровне.
Например, согласно пунктам 1…4 для атома марганца определено:
Получили распределение электронов в атоме марганца (рис. 9):
Задание 3.9. Отработайте алгоритм, составив схемы строения атомов для элементов № 16, 26, 33, 37. Укажите: металлы это или неметаллы? Ответ поясните.
Составляя вышеприведенные схемы строения атома, мы не учитывали, что электроны в атоме занимают не только определённые уровни, но и определённые подуровни каждого уровня. Вид подуровня обозначается латинской буквой: s, p, d.
Число возможных подуровней равно номеру уровня, т. е.
- первый уровень состоит из одного s-подуровня;
- второй уровень состоит из двух подуровней: s и р и т. д.
На каждом подуровне может находиться строго ограниченное число электронов:
- на s-подуровне — не больше 2ē;
- на р-подуровне — не больше 6ē;
- на d-подуровне — не больше 10ē.
Подуровни одного уровня заполняются в строго определённом порядке:
Таким образом, р-подуровнь не может начать заполняться, если не заполнен s-подуровень данного энергетического уровня и т. д. Исходя из этого правила, несложно составить электронную конфигурацию атома марганца (рис. 10).
В целом электронная конфигурация атома марганца выглядит так:
Здесь и далее приняты обозначения (рис. 11).
Задание 3.10. Составьте электронные конфигурации атомов для химических элементов № 16, 26, 33, 37.
Для чего необходимо составлять электронные конфигурации атомов? Для того чтобы определять свойства этих химических элементов!
Для этого следует помнить: в химических процессах участвуют только валентные электроны.
Валентные электроны находятся на внешнем энергетическом уровне и незавершённом d-подуровне предвнешнего уровня.
Определим число валентных электронов для марганца:
или сокращённо:
Строение атома и свойства элементов
Мы получили краткую электронную формулу атома марганца, которая отражает распределение его валентных электронов. Что можно определить по этой формуле?
1. Какие свойства — металла или неметалла — преобладают у этого элемента? Ответ: марганец — металл, так как на внешнем (четвёртом) уровне 2 электрона.
2. Какой процесс характерен для металла? Ответ: всегда только отдача электронов.
3. Какие электроны и сколько их будет отдавать атом марганца? Ответы:
- два внешних электрона (они дальше всех от ядра и слабее притягиваются им);
- семь (2+5) валентных электронов (так как в этом случае на третьем уровне атома останется восемь электронов, т. е. образуется завершённый уже внешний уровень).
Все эти рассуждения и заключения можно отразить при помощи схемы (рис. 12).
Полученные условные заряды атома называются степенью окисления.
Рассматривая строение атомов кислорода и водорода и рассуждая аналогично, можно показать, что типичными степенями окисления для кислорода является –2, а для водорода +1.
Вопрос. С каким из этих химических элементов может образовывать соединения марганец, если учесть полученные выше степени окисления его?
Только с кислородом, так как его атом имеет противоположную по заряду (знаку) степень окисления. В этом случае несложно составить формулы соответствующих оксидов марганца (здесь степени окисления соответствуют валентностям этих химических элементов):
Строение атома марганца подсказывает, что большей степени окисления, чем +7, у марганца быть не может, так как в этом случае пришлось бы затрагивать устойчивый, теперь уже завершённый предвнешний уровень. Поэтому степень окисления +7 является высшей, а соответствующий оксид Мn2О7 — высшим оксидом марганца.
Для закрепления всех этих понятий рассмотрим строение атома теллура и некоторые его свойства (см. рис. 13). Этот рисунок показывает, что теллур относится к неметаллам, так как, во-первых, у него на внешнем уровне шесть электронов и, во-вторых, его символ находится в главной подгруппе выше линии В — At. Поэтому его атом может и принимать (до завершения внешнего уровня, и отдавать электроны. В результате, в отличие от металлов, неметалл теллур может проявлять низшую степень окисления (–2) и образовывать летучие водородные соединения с водородом (Н2Те). Высшая степень окисления атома теллура (+6), как и у металлов соответствует номеру группы и, находясь в этой степени окисления, теллур образует высший оксид ТеО3.
Задание 3.11. Изобразить электронные конфигурации атомов Nа, Rb, Сl, I, Si, Sn. Определить свойства этих химических элементов, формулы их простейших соединений (с кислородом и с водородом).
Сделаем выводы.
- В химических реакциях участвуют только валентные электроны, которые могут находиться только на последних двух уровнях.
- Атомы металлов могут только отдавать эти электроны (все или несколько), принимая положительные степени окисления.
- Атомы неметаллов могут принимать (недостающие до восьми) электроны, получая при этом отрицательные степени окисления, и отдавать валентные электроны (все или несколько), принимая при этом положительные степени окисления.
Возникает вопрос: как составить краткую электронную формулу (распределение валентных электронов), сразу, не составляя длинных электронных конфигураций? Для этого нужно помнить несколько простых правил.
1. Номер периода соответствует числу энергетических уровней у атомов химических элементов этого периода.
2. Номер группы, как правило, совпадает с числом валентных электронов, (исключение составляют только подгруппы меди и железа).
3. Подгруппа (главная или побочная) включает химические элементы, у которых имеется одинаковое распределение валентных электронов, причём в атомах элементов главной и побочной подгруппы электроны распределяются по-разному.
3.1. У элементов главных подгрупп все валентные электроны находятся на внешнем уровне, например:
V группа, главная → 5 валентных электронов
Поэтому для всех химических элементов главной подгруппы пятой группы (пять валентных электронов) распределение этих электронов следующее:
3.2. У элементов побочных подгрупп число внешних электронов не превышает двух, например:
5 валентных электронов ← V группа, побочная → 2 электрона на внешнем уровне*.
* За счёт «провала электрона» число внешних электронов может быть меньше. Но число валентных электронов при этом не меняется, поэтому свойства элемента будут такими же. Эти случаи рассмотрены в Самоучителе второго уровня, часть 1.
Для большинства химических элементов побочных подгрупп, у которых на внешнем энергетическом уровне два электрона, остальные (N – 2) валентные электроны будут находиться на d-подуровне предвнешнего уровня (N – номер группы), например:
Вопрос. Для элементов какой группы составлена такая запись?
Задание 3.12. Составьте краткие электронные формулы для атомов химических элементов № 35 и 42, а затем составьте распределение электронов в этих атомах по алгоритму. Убедитесь, что ваше «предсказание» сбылось.
Сравним теперь свойства химических элементов одной подгруппы, например:
Что общего в строении атомов этих элементов? На внешнем уровне каждого атома по одному электрону — это активные металлы. Металлическая активность связана со способностью отдавать электроны: чем легче отдает электроны атом, тем сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их к ядру. Чем ближе электроны к ядру, тем сильнее они притягиваются ядром атома, тем труднее их «оторвать».
Исходя из этого, сделаем вывод: какой элемент — Nа или Rb — легче отдает внешний электрон? Какой из них является более активным металлом? Очевидно, рубидий, так как его валентные электроны находятся дальше от ядра (и слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз металлические свойства усиливаются, так как возрастает радиус атома и валентные электроны слабее притягиваются к ядру.
Сравним свойства:
Оба химических элемента — неметаллы, так как до завершения внешнего уровня не хватает одного электрона, и эти атомы будут активно притягивать недостающий электрон. При этом, чем сильнее притягивает атом неметалла недостающий электрон, тем сильнее проявляются его неметаллические свойства (способность принимать электроны).
За счёт чего происходит притяжение электрона? За счёт положительного заряда ядра атома. Но в таком случае чем ближе электрон к ядру, тем сильнее их взаимное притяжение, тем активнее неметалл.
Сделаем вывод, у какого элемента сильнее выражены неметаллические свойства: у хлора или у йода? Очевидно, у хлора, так как его валентные электроны ближе к ядру.
Вывод. Активность неметаллов в подгруппах сверху вниз убывает, так как возрастает радиус атома и все труднее притянуть недостающие электроны.
Сравним свойства кремния и олова:
На внешнем уровне обоих атомов по четыре электрона. Тем не менее эти элементы в Периодической системе находятся по разные стороны от линии, соединяющей бор и астат (см. правило в уроке 2.1.). Поэтому:
- у кремния, символ которого находится выше линии В–At, сильнее проявляются неметаллические свойства;
- у олова, символ которого находится ниже линии В–At, сильнее проявляются металлические свойства;
Почему? Потому что в атоме олова четыре валентных электрона находятся так далеко от ядра, что присоединение недостающих четырех электронов затруднено, в то время как отдача электронов с пятого энергетического уровня происходит достаточно легко. Для кремния возможны оба процесса, причём первый (приём электронов) — преобладает.
Выводы:
- чем меньше электронов в атоме и чем дальше они от ядра, тем сильнее проявляются металлические свойства;
- чем больше внешних электронов в атоме, чем ближе они к ядру, тем сильнее проявляются неметаллические свойства.
Сравним строение атомов и свойства химических элементов одного периода:
Вопрос. О каком периоде и каких элементах идёт речь?
Видно, что металлические свойства убывают, так как увеличивается число внешних электронов, а неметаллические свойства — возрастают. Если речь идёт о большом периоде, где большинство элементов имеет 2 электрона на внешнем уровне (элементы побочных подгрупп), то в этом случае главной причиной убывания металлических свойств в периоде является уменьшение радиуса атома. Дело в том, что за счёт увеличения заряда ядра в периоде увеличивается сила притяжения электронов к нему и уменьшается радиус атома:
Сравните: r (Ca) = 0,197 нм и r (Zn) = 0,139 нм
Вопрос. Какой из металлов более активен?
Основываясь на этих и других выводах, сформулированных в этой главе, можно для любого химического элемента Периодической системы составить алгоритм описания свойств химического элемента по его положению в Периодической системе.
1. Составить схему строения атома, т. е. определить состав ядра, распределение электронов по энергетическим уровням и подуровням:
- определить общее число электронов в атоме (по порядковому номеру);
- определить число энергетических уровней (по номеру периода);
- определить число внешних электронов (по виду подгруппы и номеру группы);
- указать число электронов на всех энергетических уровнях, кроме предпоследнего;
- рассчитать число электронов на предпоследнем уровне.
2. Определить число валентных электронов и число внешних электронов.
3. Определить, какие свойства — металла или неметалла — сильнее проявляются у данного химического элемента (по положению в ПСХЭ).
4. Определить число отдаваемых (принимаемых) электронов.
5. Определить высшую и низшую степени окисления химического элемента.
6. Составить для этих степеней окисления химические формулы простейших соединений с кислородом и водородом.
7. Определить характер оксида (см. урок 2.1.) и составить уравнения его реакции с водой.
8. Для указанных (пункт 6) веществ составить уравнения характерных реакций (см. урок 2).
Задание 3.13. Составить по данной схеме описания атомов серы, селена, кальция и стронция и свойства этих химических элементов. Какие общие свойства имеют их оксиды? Гидроксиды?
Если вы выполнили упражнения 3.11 и 3.12, то легко заметить, что не только атомы элементов одной подгруппы, но и их соединения имеют общие свойства и похожий состав. Это отражено в Периодическом законе Менделеева: Свойства химических элементов, а также свойства простых и сложных веществ, образованных ими, находятся в периодической зависимости от ЗАРЯДА ЯДЕР ИХ АТОМОВ.
Физический смысл Периодического закона ясен: свойства химических элементов периодически повторяются потому, что периодически повторяются конфигурации валентных электронов (распределение электронов внешнего и предпоследнего уровней).
Так, у химических элементов одной и той же подгруппы одинаковое распределение валентных электронов и, значит, похожие свойства.
Выводы
Строение атома связано с положением элемента в Периодической системе. Зная строение атома, можно предсказать свойства элемента и его соединений. Эти свойства находятся в периодической зависимости от заряда ядер атомов элементов, в соответствии с Периодическим законом Менделеева.
У этого термина существуют и другие значения, см. Атом (значения).
Сравнительный размер атома гелия и его ядра
А́том (от др.-греч. ἄτομος «неделимый[1], не разрезаемый[2]») — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его химических свойств[1][3].
Атомы состоят из ядра и электронов (точнее, электронного «облака»). Ядро атома состоит из протонов и нейтронов. Количество нейтронов в ядре может быть разным: от нуля до нескольких десятков. Если число электронов совпадает с числом протонов в ядре, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом[1]. В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам[3][4].
Ядро, несущее почти всю (более чем 99,9 %) массу атома, состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Атомы классифицируются по количеству протонов и нейтронов в ядре: число протонов Z соответствует порядковому номеру атома в периодической системе Менделеева и определяет его принадлежность к некоторому химическому элементу, а число нейтронов N — определённому изотопу этого элемента. Единственный стабильный атом, не содержащий нейтронов в ядре — лёгкий водород (протий). Число Z также определяет суммарный положительный электрический заряд (Z×e) атомного ядра и число электронов в нейтральном атоме, задающее его размер[5].
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
История становления понятия[править | править код]
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами (см.: атомизм). В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что реальная частица, которой было присвоено имя атома, в действительности не является неделимой.
На международном съезде химиков в Карлсруэ (Германия) в 1860 году были приняты определения понятий молекулы и атома. Атом — наименьшая частица химического элемента, входящая в состав простых и сложных веществ.
Модели атомов[править | править код]
- Кусочки материи. Демокрит полагал, что свойства того или иного вещества определяются формой, массой, и пр. характеристиками образующих его атомов. Так, скажем, у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов[6].
- Модель атома Томсона 1904 г. (модель «Пудинг с изюмом»). Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
- Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалась ошибочной.
- Планетарная модель атома Бора-Резерфорда. В 1911 году[7] Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Необходимость введения постулатов Бора была следствием осознания того, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Квантово-механическая модель атома[править | править код]
Современная модель атома является развитием планетарной модели Бора-Резерфорда. Согласно современной модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы (дальтонах), равных 1⁄12 от массы атома стабильного изотопа углерода 12C.
Строение атома[править | править код]
Субатомные частицы[править | править код]
Хотя слово атом в первоначальном значении обозначало частицу, которая не делится на меньшие части, согласно научным представлениям он состоит из более мелких частиц, называемых субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны.
Электрон является самой лёгкой из составляющих атом частиц с массой 9,11⋅10−31 кг, отрицательным зарядом и размером, слишком малым для измерения современными методами[8]. Эксперименты по сверхточному определению магнитного момента электрона (Нобелевская премия 1989 года) показывают, что размеры электрона не превышают 10−18 м[9][10].
Протоны обладают положительным зарядом и в 1836 раз тяжелее электрона (1,6726⋅10−27 кг). Нейтроны не обладают электрическим зарядом и в 1839 раз тяжелее электрона (1,6749⋅10−27 кг)[11].
При этом масса ядра меньше суммы масс составляющих его протонов и нейтронов из-за явления дефекта массы. Нейтроны и протоны имеют сравнимый размер, около 2,5⋅10−15 м, хотя размеры этих частиц определены плохо[12].
В стандартной модели элементарных частиц как протоны, так и нейтроны состоят из элементарных частиц, называемых кварками. Наряду с лептонами, кварки являются одной из основных составляющих материи. И первые и вторые являются фермионами. Существует шесть типов кварков, каждый из которых имеет дробный электрический заряд, равный +2⁄3 или (−1⁄3) элементарного. Протоны состоят из двух u-кварков и одного d-кварка, а нейтрон — из одного u-кварка и двух d-кварков. Это различие объясняет разницу в массах и зарядах протона и нейтрона. Кварки связаны между собой сильными ядерными взаимодействиями, которые передаются глюонами[13][14].
Электроны в атоме[править | править код]
При описании электронов в атоме в рамках квантовой механики обычно рассматривают распределение вероятности в 3n-мерном пространстве для системы n электронов.
Электроны в атоме притягиваются к ядру, между электронами также действует кулоновское взаимодействие. Эти же силы удерживают электроны внутри потенциального барьера, окружающего ядро. Для того чтобы электрон смог преодолеть притяжение ядра, ему необходимо получить энергию от внешнего источника. Чем ближе электрон находится к ядру, тем больше энергии для этого необходимо.
Электронам, как и другим частицам, свойственен корпускулярно-волновой дуализм. Иногда говорят, что электрон движется по орбитали, что неверно. Состояние электронов описывается волновой функцией, квадрат модуля которой характеризует плотность вероятности нахождения частиц в данной точке пространства в данный момент времени, или, в общем случае, оператором плотности. Существует дискретный набор атомных орбиталей, которым соответствуют стационарные чистые состояния электронов в атоме.
Каждой орбитали соответствует свой уровень энергии. Электрон в атоме может перейти на уровень с большей энергией при столкновении данного атома с другим атомом, электроном, ионом, или же поглотив фотон соответствующей энергии. При переходе на более низкий уровень электрон отдаёт энергию путём излучения фотона, либо путём передачи энергии другому электрону (безызлучательный переход, удары второго рода). Как и в случае поглощения, при излучательном переходе энергия фотона равна разности энергий электрона на этих уровнях (см.: постулаты Бора). Частота испускаемого излучения ν связана с энергией фотона E соотношением E = hν, где h — постоянная Планка.
Свойства атома[править | править код]
По определению, любые два атома с одним и тем же числом протонов в их ядрах относятся к одному химическому элементу. Атомы с одним и тем же количеством протонов, но разным количеством нейтронов называют изотопами данного элемента. Например, атомы водорода всегда содержат один протон, но существуют изотопы без нейтронов (водород-1, иногда также называемый протием — наиболее распространённая форма), с одним нейтроном (дейтерий) и двумя нейтронами (тритий)[15]. Известные элементы составляют непрерывный натуральный ряд по числу протонов в ядре, начиная с атома водорода с одним протоном и заканчивая атомом оганесона, в ядре которого 118 протонов[16] Все изотопы элементов периодической системы, начиная с номера 83 (висмут), радиоактивны[17][18].
Масса[править | править код]
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, суммарное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы (а. е. м.), которая также называется дальтоном (Да). Эта единица определяется как 1⁄12 часть массы покоя нейтрального атома углерода-12, которая приблизительно равна 1,66⋅10−24 г.[19] Водород-1 — наилегчайший изотоп водорода и атом с наименьшей массой, имеет атомный вес около 1,007825 а. е. м.[20] Масса атома приблизительно равна произведению массового числа на атомную единицу массы[21] Самый тяжёлый стабильный изотоп — свинец-208[17] с массой 207,9766521 а. е. м.[22]
Так как массы даже самых тяжёлых атомов в обычных единицах (например, в граммах) очень малы, то в химии для измерения этих масс используют моли. В одном моле любого вещества по определению содержится одно и то же число атомов (примерно 6,022⋅1023). Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а. е. м., то моль атомов этого элемента будет иметь массу 1 г. Например, углерод имеет массу 12 а. е. м., поэтому 1 моль углерода весит 12 г.[19]
Размер[править | править код]
Атомы не имеют отчётливо выраженной внешней границы, поэтому их размеры определяются по расстоянию между ядрами одинаковых атомов, которые образовали химическую связь (ковалентный радиус) или по расстоянию до самой дальней из стабильных орбит электронов в электронной оболочке этого атома (радиус атома). Радиус зависит от положения атома в периодической системе, вида химической связи, числа ближайших атомов (координационного числа) и квантово-механического свойства, известного как спин[23]. В периодической системе элементов размер атома увеличивается при движении сверху вниз по столбцу и уменьшается при движении по строке слева направо[24]. Соответственно, самый маленький атом — это атом гелия, имеющий радиус 32 пм, а самый большой — атом цезия (225 пм)[25]. Эти размеры в тысячи раз меньше длины волны видимого света (400—700 нм), поэтому атомы нельзя увидеть в оптический микроскоп. Однако отдельные атомы можно наблюдать с помощью сканирующего туннельного микроскопа.
Малость атомов демонстрируют следующие примеры. Человеческий волос по толщине в миллион раз больше атома углерода[26]. Одна капля воды содержит 2 секстиллиона (2⋅1021) атомов кислорода, и в два раза больше атомов водорода[27]. Один карат алмаза с массой 0,2 г состоит из 10 секстиллионов атомов углерода[28]. Если бы яблоко можно было увеличить до размеров Земли, то атомы достигли бы исходных размеров яблока[29].
Учёные из Харьковского физико-технического института представили первые в истории науки снимки атома. Для получения снимков учёные использовали электронный микроскоп, фиксирующий излучения и поля (field-emission electron microscope, FEEM). Физики последовательно разместили десятки атомов углерода в вакуумной камере и пропустили через них электрический разряд в 425 вольт. Излучение последнего атома в цепочке на фосфорный экран позволило получить изображение облака электронов вокруг ядра[30].
Радиоактивный распад[править | править код]
Диаграмма времени полураспада (T½) в секундах для различных изотопов с Z протонами и N нейтронами.
У каждого химического элемента есть один или более изотопов с нестабильными ядрами, которые подвержены радиоактивному распаду, в результате чего атомы испускают частицы или электромагнитное излучение. Радиоактивность возникает, когда радиус ядра больше радиуса действия сильных взаимодействий (расстояний порядка 1 фм[31]).
Существуют три основные формы радиоактивного распада[32][33]:
- Альфа-распад происходит, когда ядро испускает альфа-частицу — ядро атома гелия, состоящее из двух протонов и двух нейтронов. В результате испускания этой частицы возникает элемент с меньшим на два атомным номером.
- Бета-распад происходит из-за слабых взаимодействий, и в результате нейтрон распадается на протон, электрон и антинейтрино, во втором случае на протон, позитрон и нейтрино. Электрон и позитрон называют бета-частицами. Бета-распад увеличивает или уменьшает атомный номер на единицу. К бета-распаду относят и обратный процесс — электронный захват, когда один из протонов атомного ядра захватывает орбитальный электрон и превращается в нейтрон, испуская электронное нейтрино.
- Гамма-излучение происходит из-за перехода ядра в состояние с более низкой энергией с испусканием электромагнитного излучения. Гамма-излучение может происходить вслед за испусканием альфа- или бета-частицы после радиоактивного распада.
Каждый радиоактивный изотоп характеризуется периодом полураспада, то есть временем, за которое распадается половина ядер образца. Это экспоненциальный распад, который вдвое уменьшает количество оставшихся ядер за каждый период полураспада. Например, по прошествии двух периодов полураспада в образце останется только 25 % ядер исходного изотопа[31].
Магнитный момент[править | править код]
Элементарные частицы обладают внутренним квантовомеханическим свойством, известным как спин. Оно аналогично угловому моменту объекта вращающегося вокруг собственного центра масс, хотя строго говоря, эти частицы являются точечными и нельзя говорить об их вращении. Спин измеряют в единицах приведённой планковской постоянной (

Магнитное поле, создаваемое магнитным моментом атома, определяется этими различными формами углового момента, как и в классической физике вращающиеся заряженные объекты создают магнитное поле. Однако наиболее значительный вклад происходит от спина. Благодаря свойству электрона, как и всех фермионов, подчиняться правилу запрета Паули, по которому два электрона не могут находиться в одном и том же квантовом состоянии, связанные электроны спариваются друг с другом, и один из электронов находится в состоянии со спином вверх, а другой — с противоположной проекцией спина — в состоянии со спином вниз. Таким образом магнитные моменты электронов сокращаются, уменьшая полный магнитный дипольный момент системы до нуля в некоторых атомах с чётным числом электронов[35].
В ферромагнитных элементах, таких как железо, нечётное число электронов приводит к появлению неспаренного электрона и к ненулевому полному магнитному моменту. Орбитали соседних атомов перекрываются, и наименьшее энергетическое состояние достигается, когда все спины неспаренных электронов принимают одну ориентацию, процесс известный как обменное взаимодействие. Когда магнитные моменты ферромагнитных атомов выравниваются, материал может создавать измеримое макроскопическое магнитное поле. Парамагнитные материалы состоят из атомов, магнитные моменты которых разориентированы в отсутствие магнитного поля, но магнитные моменты отдельных атомов выравниваются при приложении магнитного поля[35][36].
Ядро атома тоже может обладать ненулевым полным спином. Обычно при термодинамическом равновесии спины ядер ориентированы случайным образом. Однако для некоторых элементов (таких как ксенон-129) возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами — состояния называемого гиперполяризацией. Это состояние имеет важное прикладное значение в магнитно-резонансной томографии[37][38].
Энергетические уровни[править | править код]
Электрон в атоме находится в связанном состоянии; находясь на возбуждённом уровне, он обладает потенциальной энергией, которая пропорциональна его расстоянию от ядра. Эта энергия обычно измеряется в электронвольтах (эВ), и максимальное её значение равно энергии, которую надо передать электрону, чтобы сделать его свободным (оторвать от атома). По мере перехода электрона (в атоме) на более низкие уровни потенциальная энергия уменьшается, но превращается не в кинетическую, а в энергию излучаемых фотонов. Согласно квантовомеханической модели атома связанный электрон может занимать только дискретный набор разрешённых энергетических уровней — состояний с определённой энергией. Наинизшее из разрешённых энергетических состояний называется основным (потенциальная энергия равна нулю — электрон глубже падать уже не может), а все остальные — возбуждёнными[39].
Для перехода электрона с одного энергетического уровня на другой нужно передать ему или отнять у него энергию. Эту энергию можно сообщить атому путём удара другой частицей либо путём поглощения или, соответственно, испускания фотона, причём энергия этого фотона равна абсолютной величине разности энергий начального и конечного уровней электрона. Частота испускаемого излучения пропорциональна энергии фотона, поэтому переходы между разными энергетическими уровнями проявляются в различных областях электромагнитного спектра[40]. Каждый химический элемент имеет уникальный спектр испускания, который зависит от заряда ядра, заполнения электронных подоболочек, взаимодействия электронов, а также других факторов[41].
Пример линейчатого спектра поглощения
Когда излучение с непрерывным спектром проходит через вещество (например, газ или плазму), некоторые фотоны поглощаются атомами или ионами, вызывая электронные переходы между энергетическим состояниями, разность энергий которых равна энергии поглощённого фотона. Затем эти возбуждённые электроны спонтанно возвращаются на уровень, лежащий ниже по шкале энергии, снова испуская фотоны. Испущенные фотоны излучаются не в том направлении, в каком падал поглощённый, а произвольно в телесном угле 4 пи стерадиан. В результате в непрерывном спектре появляются участки с очень низким уровнем излучения, то есть темные линии поглощения. Таким образом, вещество ведёт себя как фильтр, превращая исходный непрерывный спектр в спектр поглощения, в котором имеются серии тёмных линий и полос. При наблюдении с тех углов, куда не направлено исходное излучение, можно заметить излучение с эмиссионным спектром, испускаемое атомами. Спектроскопические измерения энергии, амплитуды и ширины спектральных линий излучения позволяют определить вид излучающего вещества и физические условия в нём[42].
Более детальный анализ спектральных линий показал, что некоторые из них обладают тонкой структурой, то есть расщеплены на несколько близких линий. В узком смысле «тонкой структурой» спектральных линий принято называть их расщепление, происходящее из-за спин-орбитального взаимодействия между спином и вращательным движением электрона[43].
Взаимодействие магнитных моментов электрона и ядра приводит к сверхтонкому расщеплению спектральных линий, которое, как правило, меньше, чем тонкое.
Если поместить атом во внешнее магнитное поле, то также можно заметить расщепление спектральных линий на две, три и более компонент — это явление называется эффектом Зеемана. Он вызван взаимодействием внешнего магнитного поля с магнитным моментом атома, при этом в зависимости от взаимной ориентации момента атома и магнитного поля энергия данного уровня может увеличиться или уменьшиться. При переходе атома из одного расщеплённого состояния в другое будет излучаться фотон с частотой, отличной от частоты фотона при таком же переходе в отсутствие магнитного поля. Если спектральная линия при помещении атома в магнитное поле расщепляется на три линии, то такой эффект Зеемана называется нормальным (простым). Гораздо чаще в слабом магнитном поле наблюдается аномальный (сложный) эффект Зеемана, когда происходит расщепление на 2, 4 или более линий (аномальный эффект происходит из-за наличия спина у электронов). При увеличении магнитного поля вид расщепления упрощается, и аномальный эффект Зеемана переходит в нормальный (эффект Пашена — Бака)[44]. Присутствие электрического поля также может вызвать сравнимый по величине сдвиг спектральных линий, вызванный изменением энергетических уровней. Это явление известно как эффект Штарка[45].
Если электрон находится в возбуждённом состоянии, то взаимодействие с фотоном определённой энергии может вызвать вынужденное излучение дополнительного фотона с такой же энергией — для этого должен существовать более низкий уровень, на который возможен переход, и разность энергий уровней должна равняться энергии фотона. При вынужденном излучении эти два фотона будут двигаться в одном направлении и иметь одинаковую фазу. Это свойство используется в лазерах, которые могут испускать когерентный пучок света в узком диапазоне частот[46].
Валентность[править | править код]
Внешняя электронная оболочка атома, если она не полностью заполнена, называется валентной оболочкой, а электроны этой оболочки называются валентными электронами. Число валентных электронов определяет то, как атом связывается с другими атомами посредством химической связи. Путём образования химических связей атомы стремятся заполнить свои внешние валентные оболочки[47].
Чтобы показать повторяющиеся химические свойства химических элементов, их упорядочивают в виде периодической таблицы. Элементы с одинаковым числом валентных электронов формируют группу, которая изображается в таблице в виде столбца (движение по горизонтальному ряду соответствуют заполнению валентной оболочки электронами). Элементы, находящиеся в самом правом столбце таблицы, имеют полностью заполненную электронами внешнюю оболочку, поэтому они отличаются крайне низкой химической активностью и называются инертными или благородными газами[48][49].
Дисперсионное притяжение[править | править код]
Важным свойством атома является его склонность к дисперсионному притяжению. Происхождение дисперсионных сил было объяснено в 1930 году Ф. Лондоном. Межатомное взаимодействие возникает вследствие флуктуаций заряда в двух атомах, находящихся близко друг от друга. Поскольку электроны движутся, каждый атом обладает мгновенным дипольным моментом, отличным от нуля. Если бы флуктуации электронной плотности в двух атомах были бы несогласованными, то не было бы результирующего притяжения между атомами. Однако мгновенный диполь на одном атоме наводит противоположно направленный диполь в соседнем атоме. Эти диполи притягиваются друг к другу за счёт возникновения силы притяжения, которая называется дисперсионной силой, или силой Лондона. Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости атома α и обратно пропорциональна r6, где r — расстояние между двумя атомами[50].
Деформационная поляризация атома[править | править код]
Деформационная поляризация проявляется в присущей атомам способности к упругой деформации их электронных оболочек под действием электромагнитных полей. Сегодняшнее понимание явления деформационной поляризации основано на представлениях о конечной упругости электронных оболочек атомов под действием электрического поля[51]. Снятие внешнего электрического поля приводит к восстановлению электронной оболочки атома.
Деформация электронной оболочки атома приводит к смещению электронной плотности в атоме, что сопровождается образованием наведённого электрического дипольного момента μ. Дипольный момент равен произведению величины положительного заряда q на расстояние между зарядами L и направлен от отрицательного заряда к положительному μ=qL. В относительно слабых электрических полях наведённый дипольный момент пропорционален напряжённости электрического поля E. μ =αeE, где αe — электронная поляризуемость атома. Наибольшее значение электронной поляризуемости наблюдается у атомов щелочных металлов, а минимальное у атомов благородных газов.
Ионизация атома[править | править код]
При высоких значениях напряжённости приложенного электрического поля наблюдается необратимая деформация атома, сопровождающаяся отрывом электрона.
Происходит ионизация атома, атом отдаёт электрон и превращается в положительно заряженный ион — катион. Отрыв электрона от атома требует затраты энергии, называемой потенциалом ионизации или энергией ионизации.
Энергия ионизации атома сильно зависит от его электронной конфигурации. Изменение энергии отрыва первого электрона в зависимости от порядкового номера элемента приведено на рисунке.
Наименьшей энергией ионизации обладают атомы щелочных металлов, наибольшей — атомы благородных газов.
Для многоэлектронных атомов энергия ионизации I1, I2, I3… соответствует отрыву первого, второго, третьего и т. д. электронов.
Взаимодействие атома с электроном[править | править код]
| Атом | Энергия сродства к электрону, эВ[52] |
|---|---|
| F | 3,62 ± 0,09 |
| Cl | 3,82 ± 0,06 |
| Br | 3,54 ± 0,06 |
| I | 3,23 ± 0,06 |
Атомы могут, в той или иной степени, присоединять добавочный электрон и превращаться в отрицательный ион — анион.
Энергетический эффект процесса присоединения к нейтральному атому (Э) принято называть энергией сродства к электрону:
- Э + e– → Э–.
На рисунке представлена зависимость энергии сродства к электрону атомов от порядкового номера элемента. Наибольшим сродством к электрону обладают атомы галогенов (3—4 эВ).
Электроотрицательность атома[править | править код]
Электроотрицательность атома (χ) — фундаментальное свойство атома смещать к себе общие электронные пары в молекуле. Способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения зависит от энергии ионизации атома и его сродства к электрону. Согласно одному из определений (по Малликену) электроотрицательность атома (χ) может быть выражена как полусумма его энергии ионизации (i) и сродства к электрону (F):
Имеется около двадцати шкал электроотрицательности атома, в основу расчёта значений которых положены различные свойства веществ. Полученные значения разных шкал отличаются, но относительное расположение элементов в ряду электроотрицательностей примерно одинаково.
Детальный поиск взаимосвязи между шкалами электроотрицательности позволил сформулировать новый подход к выбору практической шкалы электроотрицательностей атомов[53].
Символизм[править | править код]
С момента вхождения человечества в атомную эру атом приобрел и символический смысл. Чаще всего атом изображается в виде упрощенной модели Бора-Резерфорда. Однако встречаются и более усложненные варианты изображения. Чаще всего изображение атома символизирует атомную энергетику («мирный атом»), ядерное оружие, ядерную физику, либо науку и научно-технический прогресс в целом.
См. также[править | править код]
- Физика атомов и молекул
- Молекула
- Электрон
- Протон
- Нейтрон
Примечания[править | править код]
- ↑ 1 2 3 Большой энциклопедический словарь. Физика / Гл. ред. А. М. Прохоров. — М.: Большая Российская энциклопедия, 1998. — С. 36. — 944 с. — ISBN 5-85270-306-0.
- ↑ Большой иллюстрированный словарь иностранных слов / Ред. Е. А. Гришина. — АСТ; Астрель; Русские словари. — С. 91. — 960 с. — ISBN 5-17-008793-4.
- ↑ 1 2 Ельяшевич М. А. Атом // Большая Советская Энциклопедия. 3-е изд. / гл. ред. А. М. Прохоров. — М.: Советская энциклопедия, 1970. — Т. 2. Ангола — Барзас. — С. 389—394.
- ↑ Химический энциклопедический словарь / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1983. — С. 58. — 792 с.
- ↑ Atom Архивная копия от 4 ноября 2015 на Wayback Machine // IUPAC Gold Book
- ↑ Демокрит // Школьная энциклопедия «Руссика». История Древнего мира / А. О. Чубарьян. — М.: Olma Media Group, 2003. — С. 281—282. — 815 с. — ISBN 5-948-49307-5.
- ↑ Планетарная модель атома Архивировано 15 июня 2008 года.
- ↑ Demtröder, 2002.
- ↑ Демельт Х.«Эксперименты с покоящейся изолированной субатомной частицей» Архивная копия от 23 мая 2017 на Wayback Machine // УФН, т. 160 (12), с. 129—139, 1990
- ↑ Nobel lecture, December, 8, 1989, Hans D. Dehmelt Experiments with an isolated subatomic particle at rest Архивная копия от 10 августа 2017 на Wayback Machine
- ↑ Woan, 2000.
- ↑ MacGregor, 1992.
- ↑ The Particle Adventure. Particle Data Group. Lawrence Berkeley Laboratory (2002). Дата обращения: 3 января 2009. Архивировано 21 августа 2011 года.
- ↑ James Schombert. Elementary Particles. University of Oregon (18 апреля 2006). Дата обращения: 3 января 2007. Архивировано 21 августа 2011 года.
- ↑ Howard S. Matis. The Isotopes of Hydrogen. Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab (9 августа 2000). Дата обращения: 21 декабря 2007. Архивировано 21 августа 2011 года.
- ↑ Rick Weiss. Scientists Announce Creation of Atomic Element, the Heaviest Yet. Washington Post (17 октября 2006). Дата обращения: 21 декабря 2007. Архивировано 21 августа 2011 года.
- ↑ 1 2 Sills, 2003.
- ↑ Belle Dumé. Bismuth breaks half-life record for alpha decay. Physics World (23 апреля 2003). Дата обращения: 21 декабря 2007. Архивировано 21 августа 2011 года.
- ↑ 1 2 Mills и др. (1993).
- ↑
Chung Chieh. Nuclide Stability. University of Waterloo (22 января 2001). Дата обращения: 4 января 2007. Архивировано из оригинала 30 августа 2007 года. - ↑ Atomic Weights and Isotopic Compositions for All Elements. National Institute of Standards and Technology. Дата обращения: 4 января 2007. Архивировано 21 августа 2011 года.
- ↑ G. Audi, A. H. Wapstra, C. Thibault. The Ame2003 atomic mass evaluation (II) (неопр.) // Nuclear Physics. — 2003. — Т. A729. — С. 337—676. Архивировано 16 сентября 2008 года.
- ↑ R. D. Shannon. Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides (англ.) // Acta Crystallographica, Section A : journal. — International Union of Crystallography, 1976. — Vol. 32. — P. 751. — doi:10.1107/S0567739476001551. Архивировано 30 сентября 2007 года.
- ↑ Judy Dong. Diameter of an Atom. The Physics Factbook (1998). Дата обращения: 19 ноября 2007. Архивировано 21 августа 2011 года.
- ↑ Zumdahl, 2002.
- ↑ Small Miracles: Harnessing nanotechnology. Oregon State University (2007). Дата обращения: 7 января 2007. Архивировано из оригинала 4 декабря 2007 года. — описывает толщину человеческого волоса как 105 нм и 10 углеродных атомов по толщине как 1 нм.
- ↑ «There are 2 000 000 000 000 000 000 000 (that’s 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen» // Padilla et al., 2002, p. 32
- ↑ Карат равен 200 миллиграмм. По определению, углерод-12 имеет 12 грамм на моль. Постоянная Авогадро равна 6,02⋅1023 атомов на моль.
- ↑ Feynman, 1995.
- ↑ First Detailed Photos of Atoms. Inside Science News Service (14 сентября 2009). Дата обращения: 24 июня 2014. Архивировано 24 июня 2014 года.
- ↑ 1 2 Radioactivity. Splung.com. Дата обращения: 19 декабря 2007. Архивировано 21 августа 2011 года.
- ↑ L’Annunziata (2003).
- ↑ Richard B. Firestone. Radioactive Decay Modes. Berkeley Laboratory (22 мая 2000). Дата обращения: 7 января 2007. Архивировано 21 августа 2011 года.
- ↑ J. P. Hornak. Chapter 3: Spin Physics. The Basics of NMR. Rochester Institute of Technology (2006). Дата обращения: 20 марта 2011. Архивировано из оригинала 26 мая 2007 года.
- ↑ 1 2 Paul A. Schroeder. Magnetic Properties. University of Georgia (22 февраля 2000). Дата обращения: 7 января 2007. Архивировано из оригинала 18 февраля 2001 года.
- ↑ Greg Goebel. [4.3] Magnetic Properties of the Atom. Elementary Quantum Physics. In The Public Domain website (1 сентября 2007). Дата обращения: 7 января 2007. Архивировано 21 августа 2011 года.
- ↑ Lynn Yarris. Talking Pictures (неопр.) // Berkeley Lab Research Review. Архивировано 15 июня 1997 года.
- ↑ Liang, Haacke, 1999.
- ↑ Bart J. Van Zeghbroeck. Energy levels. Shippensburg University (1998). Дата обращения: 23 декабря 2007. Архивировано 15 января 2005 года.
- ↑ Fowles, 1989.
- ↑ W. C. Martin, W. L. Wiese. Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas. National Institute of Standards and Technology (май 2007). Дата обращения: 8 января 2007. Архивировано 21 августа 2011 года.
- ↑ Atomic Emission Spectra — Origin of Spectral Lines. Avogadro Web Site. Дата обращения: 10 августа 2006. Архивировано 21 августа 2011 года.
- ↑ Richard Fitzpatrick. Fine structure. University of Texas at Austin (16 февраля 2007). Дата обращения: 14 февраля 2008. Архивировано 21 августа 2011 года.
- ↑ Michael Weiss. The Zeeman Effect. University of California-Riverside (2001). Дата обращения: 6 февраля 2008. Архивировано 21 августа 2011 года.
- ↑ Beyer, 2003.
- ↑ Thayer Watkins. Coherence in Stimulated Emission. San José State University. Дата обращения: 23 декабря 2007. Архивировано 21 августа 2011 года.
- ↑ William Reusch. Virtual Textbook of Organic Chemistry. Michigan State University (16 июля 2007). Дата обращения: 11 января 2008. Архивировано 21 августа 2011 года.
- ↑ Husted Robert и др. Periodic Table of the Elements. Los Alamos National Laboratory (11 декабря 2003). Дата обращения: 11 января 2008. Архивировано 21 августа 2011 года.
- ↑ Rudy Baum. It’s Elemental: The Periodic Table. Chemical & Engineering News (2003). Дата обращения: 11 января 2008. Архивировано 21 августа 2011 года.
- ↑ Даниэльс Ф., Олберти Р. Физическая химия / под ред. К.В.Топчиевой. — М.: Мир, 1978. — С. 453. — 646 с.
- ↑ Потапов А.А. Деформационная поляризация. Поиск оптимальных моделей. — Новосибирск: “Наука”, 2004. — 511 с.
- ↑ Справочник химика. — II-ое, перераб. и доп.. — Л.-М.: ГНТИ Химической литературы, 1962. — Т. I. — С. 328. — 1072 с.
- ↑ Филиппов Г. Г., Горбунов А. И. Новый подход к выбору практической шкалы электроотрицательностей атомов. — Российский химический журнал, 1995. — Т. 39, Вып. 2. — С. 39—42.
Литература[править | править код]
- Бете Г., Солпитер Э. Квантовая механика атомов с одним и двумя электронами. — М.: Физматгиз, 1960. — 562 с.
- Бейдер Р. Атомы в молекулах. Квантовая теория. М.: Мир, 2001. — 532 c.
- Веселов М. Г., Лабзовский Л. Н. Теория атома: Строение электронных оболочек. — М.: Наука, 1986. — 328 с. Архивная копия от 31 июля 2013 на Wayback Machine
- Зоммерфельд А. Строение атома и спектры. Том 1 — М.: ГИТТЛ, 1956.
- Зоммерфельд А. Строение атома и спектры. Том 2 — М.: ГИТТЛ, 1956.
- Шпольский Э. В. Атомная физика. Том 2. Основы квантовой механики и строение электронной оболочки атома 4-е изд. — М.: Наука, 1974.
- На английском языке
- Michael F. L’Annunziata. Handbook of Radioactivity Analysis. — 2003. — ISBN 0-12-436603-1.
- H. F. Beyer, V. P. Shevelko. Introduction to the Physics of Highly Charged Ions. — CRC Press, 2003. — ISBN 0-75-030481-2.
- Gregory R. Choppin, Jan-Olov Liljenzin, Jan Rydberg. Radiochemistry and Nuclear Chemistry. — Elsevier, 2001. — ISBN 0-75-067463-6.
- J. Dalton. A New System of Chemical Philosophy, Part 1. — London and Manchester: S. Russell, 1808.
- Wolfgang Demtröder. Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics. — 1st ed. — Springer, 2002. — ISBN 3-540-20631-0.
- Richard Feynman. Six Easy Pieces. — The Penguin Group, 1995. — ISBN 978-0-140-27666-4.
- Grant R. Fowles. Introduction to Modern Optics. — Courier Dover Publications, 1989. — ISBN 0-48-665957-7.
- Mrinalkanti Gangopadhyaya. Indian Atomism: History and Sources. — Atlantic Highlands, New Jersey: Humanities Press, 1981. — ISBN 0-391-02177-X.
- David L. Goodstein. States of Matter. — Courier Dover Publications, 2002. — ISBN 0-48-649506-X.
- Edward Robert Harrison. Masks of the Universe: Changing Ideas on the Nature of the Cosmos. — Cambridge University Press, 2003. — ISBN 0-52-177351-2.
- Tatjana Jevremovic. Nuclear Principles in Engineering. — Springer, 2005. — ISBN 0-38-723284-2.
- James Lequeux. The Interstellar Medium. — Springer, 2005. — ISBN 3-540-21326-0.
- Z.-P. Liang, E. M. Haacke. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging / J. G. Webster. — John Wiley & Sons, 1999. — P. 412—26. — ISBN 0-47-113946-7.
- Malcolm H. MacGregor. The Enigmatic Electron. — Oxford University Press, 1992. — ISBN 0-19-521833-7.
- Oliver Manuel. Origin of Elements in the Solar System: Implications of Post-1957 Observations. — Springer, 2001. — ISBN 0-30-646562-0.
- Robert M. Mazo. Brownian Motion: Fluctuations, Dynamics, and Applications. — Oxford University Press, 2002. — ISBN 0-19-851567-7.
- Ian Mills, Tomislav Cvitaš, Klaus Homann, Nikola Kallay, Kozo Kuchitsu. Quantities, Units and Symbols in Physical Chemistry. — 2nd ed. — Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications, 1993. — ISBN 0-632-03583-8.
- Richard Myers. The Basics of Chemistry. — Greenwood Press, 2003. — ISBN 0-31-331664-3.
- Michael J. Padilla, Ioannis Miaoulis, Martha Cyr. Prentice Hall Science Explorer: Chemical Building Blocks. — Upper Saddle River, New Jersey USA: Prentice-Hall, 2002. — ISBN 0-13-054091-9.
- Linus Pauling. The Nature of the Chemical Bond. — Cornell University Press, 1960. — ISBN 0-80-140333-2.
- Jeremy I. Pfeffer, Shlomo Nir. Modern Physics: An Introductory Text. — Imperial College Press, 2000. — ISBN 1-860-94250-4.
- Leonid Ivanovich Ponomarev. The Quantum Dice. — CRC Press, 1993. — ISBN 0-75-030251-8.
- J. Kenneth Shultis, Richard E. Faw. Fundamentals of Nuclear Science and Engineering. — CRC Press, 2002. — ISBN 0-82-470834-2.
- Robert Siegfried. From Elements to Atoms: A History of Chemical Composition. — DIANE, 2002. — ISBN 0-87-169924-9.
- Alan D. Sills. Earth Science the Easy Way. — Barron’s Educational Series, 2003. — ISBN 0-76-412146-4.
- Boris M. Smirnov. Physics of Atoms and Ions. — Springer, 2003. — ISBN 0-38-795550-X.
- Dick Teresi. Lost Discoveries: The Ancient Roots of Modern Science. — Simon & Schuster, 2003. — P. 213—214. — ISBN 0-74-324379-X.
- Graham Woan. The Cambridge Handbook of Physics. — Cambridge University Press, 2000. — ISBN 0-52-157507-9.
- Charles Adolphe Wurtz. The Atomic Theory. — New York: D. Appleton and company, 1881.
- Marco Zaider, Harald H. Rossi. Radiation Science for Physicians and Public Health Workers. — Springer, 2001. — ISBN 0-30-646403-9.
- Steven S. Zumdahl. Introductory Chemistry: A Foundation. — 5th ed. — Houghton Mifflin, 2002. — ISBN 0-618-34342-3.
Ссылки[править | править код]
- Атом в Физической энциклопедии
- Eden Francis. Atomic Size. Clackamas Community College (2002). Дата обращения: 9 января 2007. Архивировано 21 августа 2011 года.
- Craig C. Freudenrich. How Atoms Work. How Stuff Works. Дата обращения: 9 января 2007. Архивировано 21 августа 2011 года.
- The atom. Science aid+ (2007). — A guide to the atom for teens. Дата обращения: 9 января 2007. Архивировано 21 августа 2011 года.
- Atoms and Atomic Structure. Би-би-си (3 января 2006). Дата обращения: 11 января 2007. Архивировано 21 августа 2011 года.
- Physics 2000. University of Colorado (3 января 2006). Дата обращения: 11 января 2008. Архивировано 21 августа 2011 года.
- Почему электрон не падает на ядро? Научный журнал ARI
- Украинские ученые впервые сфотографировали атом (16 сентября 2009).
- Ученые изолировали, захватили и сфотографировали атом Рубидия 85 (1 октября 2010). Дата обращения: 1 октября 2010. Архивировано 2 февраля 2012 года.
- Строение атома
- Строение атома (учебный фильм)
- Спектры атомов. Дата обращения: 10 октября 2010. Архивировано 21 августа 2011 года.
- Структура атомов, учебный фильм. Дата обращения: 10 октября 2010. Архивировано 21 августа 2011 года.