CharChem
:
Система описания химических формул для WEB.
Химические формулы для “чайников”
Научно-популярная статья о химических формулах.
Изначально сайт был задуман, как ресурс для профессиональных химиков. Содержание Структурные формулы – это просто!
Я думаю, что знакомство с формулами лучше всего начать со структурных формул органических веществ. Перед нами структурная формула метана – самого простого органического вещества. H-C-H;H|#2|H
Что мы видим? В центре латинская буква C, а от неё четыре палочки, на концах которых четыре латинских буквы H.
Структурные формулы могут слегка менять свой внешний вид.
H-C-H; H|#2|H = Все эти картинки означают одно и то же. И считаются одинаковыми формулами.
В общем, структурные формулы не являются какими-то жесткими конструкциями.
Но в химии приняты не только структурные формулы. И здесь мы познакомимся с некоторыми из них. CH4
Палочки исчезли, а вместо четырёх букв H осталась одна, но с маленькой цифрой 4, которая указывает количество атомов.
Стоит упомянуть, что метан – это природный газ, который знаком всем, у кого есть газовая плита. Углеводороды
Прежде, чем мы начнём знакомство с многочисленными органическими соединениями, хочу напомнить –
Здесь представлены органические вещества, называемые углеводородами.
Теперь посмотрим на колонку, где представлены упрощённые структурные формулы.
Некоторые функциональные группы получают собственные названия и даже специальные обозначения. Двойные и тройные связи
Итак, за короткое время мы уже разобрались, что такое структурные формулы и выяснили, что они бывают развёрнутые и упрощённые.
Представленные здесь вещества тоже относятся к углеводородам.
Кроме того, появились дополнительные названия. Тут тоже нет ничего страшного. Циклические углеводороды
Продолжим знакомство с формулами углеводородов. Они ещё не раскрыли нам всех своих секретов.
Изомеры
До сих пор мы не особенно обращали внимания на последнюю колонку, где выведены брутто-формулы.
В химии существует такое понятие как изомеры. Классическими изомерами среди углеводородов можно назвать бутан и изобутан. Посмотрим на их формулы:
Изобутан является изомером бутана. Обратите внимание, что брутто-формулы одинаковы.
Как видно, разнообразие углеводородов не перестаёт удивлять.
А у вещества декан, имеющего формулу C10H22, существует 75 изомеров.
Обратите внимание, что научное название зависит от числа звеньев в прямой цепочке, Бензол и скелетные формулы
Думаю, что пора познакомиться ещё с одним весьма примечательным представителем углеводородов.
Чем же этот бензол так примечателен? Дело в том, что это шестиугольное колечко входит в состав огромного
Конечно, скелетные формулы не так просты, как развёрнутые, но зато их гораздо легче записывать. Давайте посмотрим, как выглядят формулы других веществ, производных от бензола.
Как видите, появился ещё и смешанный вариант. Опять какой-то новый вид формул? На этот раз уже нет. А вот скелетная формула углеводорода, который называется коронен. Причём, другие варианты здесь уже использовать нет смысла. |/`/|“/|`|“|/`/“||/\/\|||`/|`//“/`\`|/`/“||/
Впечатляет? Но это далеко не самая сложная структура для органического вещества.
Скелетные формулы существуют не только для циклических молекул.
Трехмерные изображения
Иногда плоского изображения становится недостаточно.
В качестве примера посмотрим на формулы уже известных нам углеводородов:
Конечно, здесь потребуется включать воображение, чтобы представить трёхмерную структуру. Формулы с окружностью
Думаю, что стоит упомянуть ещё одну интересную конструкцию, которая нередко встречается при изображении циклических структур. /\|`//“|| <-> /=`//`-`\ <-> //||`/`\`| <-> /|`/“|_o <-> H|</H>|<H>`/<|H>`<`/H>`|<`H>/_o
Само собой, все они означают одно и то же. Но первые три отличаются только поворотом вокруг собственного центра.
Формулы бензола, где используется чередование одинарных и двойных связей называются формулами Кекуле в честь немецкого учёного,
На самом деле, среди химиков нет единого мнения по поводу того, насколько правильно использование формул с кружком. Вот пара примеров записи уже для уже знакомых нам веществ:
Знакомство с кислородом. Спирты
До сих пор мы знакомились со структурными формулами углеводородов, которые состоят только из углерода и водорода.
Кислород – очень распространённый элемент на нашей планете.
Не правда ли, что в этом есть что-то знакомое? Метан – метанол, этан – этанол, пропан – пропанол.
Все спирты можно описать в виде обобщённой формулы {R}-OH,
Конечно же стоит упомянуть, что этанол – это тот самый спирт, который входит в состав алкогольных напитков.
Ещё здесь из четырёх спиртов есть два изомера: 1-пропанол и 2-пропанол.
CH3-CH2-CH2-OH = $slope(45)CH3CH2CH2OH = CH3|CH2|CH2|OH = HO/CH2/CH2/CH3 = Поэтому первый номер – тот, который ближе к гидроксильной группе.
Все спирты, с которыми мы уже успели познакомиться, имеют в своём составе одну гидроксильную группу.
Ну и чтобы завершить знакомство со спиртами, приведу ещё формулу другого известного вещества – холестерина.
|`/`\`|<`|w>“/|<`/w$color(red)HO$color()>/`|0/`|/<`|w>|_q_q_q<-dH>:a_q|0<|dH>`/<`|wH>`|dH; Гидроксильную группу в нём я обозначил красным цветом. Карбоновые кислоты
Любой винодел знает, что вино должно храниться без доступа воздуха. Иначе оно скиснет.
Отличительной особенностью органических кислот является наличие карбоксильной группы (COOH),
Все, кто пробовал уксус, знают что он весьма кислый. Причиной этого является наличие в нём уксусной кислоты.
Карбоновые кислоты могут иметь несколько карбоксильных групп. В пищевых продуктах содержится немало других органических кислот. Вот только некоторые из них:
Название этих кислот соответствует тем пищевым продуктам, в которых они содержатся. Радикалы
Радикалы – это ещё одно понятие, которое оказало влияние на химические формулы.
Выше по тексту уже несколько раз упоминались обобщённые формулы: спирты – {R}-OH и
Если выражаться более определённо, то одновалентным радикалом называется часть молекулы, лишённая одного атома водорода.
Радикалы в химии получили собственные названия.
Думаю, что здесь всё понятно. Хочу только обратить внимание на колонку, где приводятся примеры спиртов.
Существует ещё такое явление, как свободные радикалы. Знакомство с азотом. Амины
Предлагаю познакомиться с ещё одним элементом, который входит в состав многих органических соединений. Это азот. Посмотрим, какие вещества получаются, если к знакомым нам углеводородам присоединить азот:
Как Вы уже наверное догадались из названий, все эти вещества объединяются под общим названием амины.
В общем, никаких особых новшеств здесь нет. Рациональные формулы
Не следует делать вывод о том, что неорганическая химия проще, чем органическая.
Так вот, ничего этого я рассказывать не буду. Тема моей статьи – химические формулы.
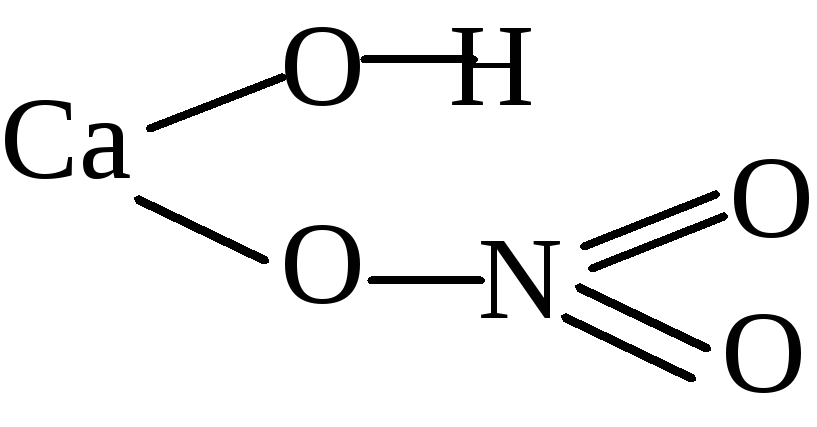
Для начала, познакомимся с ещё одним элементом – кальцием. Это тоже весьма распространённый элемент.
При первом взгляде можно заметить, что рациональная формула является чем то средним между структурной и брутто-формулой.
Кальций в чистом виде – это мягкий белый металл. В природе он не встречается. 2Ca + O2 -> 2CaO
Цифра 2 перед формулой вещества означает, что в реакции участвуют 2 молекулы. CaO + H2O -> Ca(OH2)
Получается гидроксид кальция. Если присмотреться к его структурной формуле (в предыдущей таблице), то видно,
Но и гидроксид кальция не встречается в природе из-за наличия в воздухе углекислого газа. CO2 + H2O <=> H2CO3 Знак <=> говорит о том, что реакция может проходить в обе стороны при одинаковых условиях.
Таким образом, гидроксид кальция, растворённый в воде, вступает в реакцию с угольной кислотой Ca(OH)2 + H2CO3 -> CaCO3″|v” + 2H2O
Стрелка вниз означает, что в результате реакции вещество выпадает в осадок. CaCO3 + CO2 + H2O <=> Ca(HCO3)2
Этот процесс влияет на жесткость воды.
Из карбоната кальция в значительной степени состоят мел, известняк, мрамор, туф и многие другие минералы.
Этот небольшой рассказ о круговороте кальция в природе должен пояснить, для чего нужны рациональные формулы.
Кроме того, отдельные элементы – Ca, H, O(в оксидах) – тоже являются самостоятельными группами. Ионы
Думаю, что пора знакомиться с ионами. Это слово наверняка всем знакомо.
В общем, природа химических связей обычно заключается в том, что одни элементы отдают электроны, а другие их получают. H2O <=> H^+ + OH^-
Здесь мы видим, что в результате электролитической диссоциации вода распадается на положительно заряженный H2CO3 = H^+ + HCO3^- <=> 2H^+ + CO3^2- Карбонат-ион имеет заряд 2-. Это означает, что к нему присоединились два электрона.
Отрицательно заряженные ионы называются анионы. Обычно к ним относятся кислотные остатки.
И вот здесь наверное можно полностью понять смысл рациональных формул. В них сначала записывается катион, а за ним – анион.
Вы наверное уже догадываетесь, что ионы можно описывать не только рациональными формулами. O^-|O`|/OH
Здесь заряд указан непосредственно возле атома кислорода, который получил лишний электрон, и поэтому лишился одной чёрточки. NH3 + H2O <=> NH4^+ + OH^- То же самое, но с использованием структурных формул: H|N<`/H>H + H-O-H <=> H|N^+<_(A75,w+)H><_(A15,d+)H>`/H + O`^-# -H
В правой части мы видим два иона.
2H|N^+<`/H><_(A75,w+)H>_(A15,d+)H + O^-C|O`|/O^- <=>
Но в таком виде уравнение реакции дано в демонстрационных целях. 2NH4^+ + CO3^2- <=> (NH4)2CO3 Система Хилла
Итак, можно считать, что мы уже изучили структурные и рациональные формулы.
В принципе, рациональная формула угольной кислоты вполне может считаться истинной формулой,
Вместо заключения мне хотелось бы рассказать о системе CharChem.
Зачем вообще нужна какая-то система для вывода формул?
Рациональные и брутто-формулы вполне можно изобразить при помощи текста. H H
| |
H-C-C-O-H
| |
H H
Выглядит конечно не очень красиво, но тоже осуществимо.
Настоящая проблема возникает при попытке изобразить бензольные кольца и при использовании скелетных формул.
Система CharChem позволяет хранить все формулы прямо в HTML-документе в текстовом виде. По-моему, это очень удобно.
Таким образом, для подготовки этой статьи я пользовался только текстовым редактором. Вот несколько примеров, раскрывающих секрет подготовки текста статьи:
Описания из левого столбца автоматически превращаются в формулы во втором столбце. Здесь есть гораздо более подробная документация по использованию системы CharChem. На этом разрешите закончить статью и пожелать удачи в изучении химии. Краткий толковый словарь использованных в статье терминов
|
Эмпирические
формулы дают информацию о качественном
и количественном составе соединений.
Взаимное расположение атомов в молекуле
вещества отражают структурно-графические
формулы, однако они не показывают
пространственное расположение атомов.
При
составлении структурно-графических
формул можно руководствоваться
следующими правилами:
1.
Элементы соединяются в соответствии с
их валентностью.
2.
Черточка в формуле обозначает единичную
химическую связь, количество черточек
соответствует валентности, например:
K2O
записывается так: K‑O
‑K
.
3.
Состав кислот и оснований следует
начинать изображать с центрального
атома,
|
например H4SiO4 |
|
4.
Если в молекуле кислоты содержится
больше атомов кислорода, чем водорода,
то «избыточные» атомы кислорода соединены
с центральным атомом двойной связью,
|
например: |
|
5.
При написании графических формул солей
исходят из графических формул кислот,
заменяя атомы водорода на атомы металла,
учитывая его валентность, например:
|
Na3PO4 |
|
Fe2(SO4)3 |
|
|
KHCO3 |
|
||
|
CaOHNO3 |
|
Структурно-графические
формулы некоторых кислот приведены в
табл. 5.
2.4. Общие химические свойства основных классов неорганических веществ
Оксиды
‑
вещества, состоящие из атомов двух
элементов, один из которых – кислород
в степени окисления (–2). По
химическим свойствам их подразделяют
на индифферентные, или несолеобразующие
(CO,
NO),
и солеобразующие, которые бывают
основными, кислотными и амфотерными.
Химические
свойства основных оксидов
1.
Взаимодействуют с кислотами с образованием
соли и воды, например:
MgO
+ 2HCl
= MgCl2
+ H2O.
2.
Взаимодействие с кислотными оксидами
с образованием солей:
CaO
+ CO2
= CaCO3.
3.
Оксиды щелочных и щелочноземельных
металлов взаимодействуют с водой с
образованием растворимых в воде
оснований – щелочей:
K2O
+ H2O
= 2KOH.
Химические
свойства кислотных оксидов
1.
Общим свойством всех кислотных оксидов
является их способность взаимодействовать
с основаниями с образованием соли и
воды:
СО2
+ 2NaOH
= Na2CO3
+ Н2О.
2.
Кислотные оксиды взаимодействуют с
основными оксидами с образованием
солей.
3.
Большинство кислотных оксидов
взаимодействует с водой с образованием
кислот:
SО3
+ Н2О
= H2SO4.
Очень
немногие кислотные оксиды не взаимодействуют
с водой. Наиболее известный из них оксид
кремния (SiO2).
Химические
свойства амфотерных оксидов
1.
Амфотерные оксиды взаимодействуют с
кислотами с образованием солей и воды.
ZnO
+ 2HNO3
= Zn(NO3)2
+ 2Н2О.
В
этих реакциях амфотерные оксиды играют
роль основных.
2.
Амфотерные оксиды взаимодействуют с
щелочами с образованием солей и воды.
ZnO
+ 2КОН
K2ZnO2
+ Н2О,
ZnO
+ 2КОН + H2O
K2[Zn(OH)4].
В
этих реакциях амфотерные оксиды играют
роль кислотных.
3.
Амфотерные оксиды при нагревании
взаимодействуют с кислотными оксидами
с образованием солей:
ZnO
+ CO2
= ZnCO3.
4.
Амфотерные оксиды при нагревании
взаимодействуют с основными оксидами
с образованием солей:
ZnO
+ Na2O
= Na2ZnO2.
Получение
оксидов
Оксиды
могут быть получены различными способами:
1.
Взаимодействием простых веществ с
кислородом:
2Mg
+ О2
= 2MgO;
2.
Разложением некоторых оксокислот:
H2SO3
=
SO2
+ Н2О.
3.
Разложением нерастворимых оснований:
Сu(OH)2CuO
+ H2O.
4.
Разложением некоторых солей:
СаСО3
СаО + СО2.
Основания
‑
сложные
вещества, при диссоциации которых в
воде образуются гидроксид-ионы и никаких
других анионов.
По
растворимости в воде основания делятся
на две группы: нерастворимые [Fe(OH)3,
Си(ОН)2
и др.] и растворимые в воде [КОН, NaOH,
Са(ОН)2,
Ва(ОН)2
], или щелочи.
Химические
свойства оснований
Общие
свойства оснований объясняются наличием
в растворах анионов ОН–,
которые образуются в результате
электролитической диссоциации молекул
оснований:
NaOHNa+
+ OH–.
1.
Водные растворы щелочей изменяют окраску
индикаторов.
Таблица
6 ‑ Изменение
цвета индикаторов в растворах
щелочей
и кислот
|
Индикатор |
Цвет |
Цвет |
Цвет |
|
Лакмус |
Фиолетовый |
Синий |
Красный |
|
Фенолфталеин |
Бесцветный |
Малиновый |
Бесцветный |
|
Метилоранж |
Оранжевый |
Желтый |
Красный |
2.
Основания взаимодействуют с кислотами
с образованием соли и воды (реакция
нейтрализации). Например:
КОН
+ НС1= КС1 + Н2О;
Fe(OH)2
+2HNO3
= Fe(NO3)2
+ 2Н2О.
3.
Щелочи взаимодействуют с кислотными
оксидами с образованием соли и воды:
Са(ОН)2
+ СО2
= СаСО2
+ Н2О.
4.
Растворы щелочей взаимодействуют с
растворами солей, если в результате
образуется нерастворимое основание
или нерастворимая соль. Например:
2NaOH
+ CuSO4
= Cu(OH)2↓
+ Na2SO4;
Ва(ОН)2
+ Na2SO4
= 2NaOH
+ BaSO4↓.
5.
Нерастворимые основания при нагревании
разлагаются на основный оксид и воду.
2Fе(ОН)3
Fе2О3
+ ЗН2О.
6.
Растворы щелочей взаимодействуют с
металлами, которые образуют амфотерные
оксиды и гидроксиды (Zn,
Al
и др.).
2AI
+ 2КОН + 6Н2О
= 2K[A1(OH)4]
+ 3H2↑.
Получение
оснований
-
Получение
растворимых
оснований:
а)
взаимодействием щелочных и щелочноземельных
металлов с водой:
2Na
+ 2Н2О
= 2NaOH
+ Н2↑;
б)
взаимодействием оксидов щелочных и
щелочноземельных металлов с
водой:
Na2O
+ Н2О
= 2NaOH.
2.
Получение нерастворимых
оснований
действием щелочей на растворимые соли
металлов:
2NaOH
+
FeSO4
= Fe(OH)2↓
+ Na2SO4.
Кислоты
‑ сложные вещества, при диссоциации
которых в воде, образуются ионы водорода
(гидроксония) и никаких других катионов.
Химические
свойства
Общие
свойства кислот в водных растворах
обусловлены присутствием ионов Н+
(вернее H3O+),
которые образуются в результате
электролитической диссоциации молекул
кислот:
1.
Кислоты одинаково изменяют цвет
индикаторов (табл. 7).
2.
Кислоты взаимодействуют с основаниями.
Например:
Н3РО4
+ 3NaOH=Na3PO4+ЗН2О;
Н3РО4
+ 2NaOH
= Na2HPO4
+ 2Н2О;
Н3РО4
+ NaOH
= NaH2PO4
+ Н2О;
2НС1
+ Сu(ОН)2
= СuС12
+ 2Н2О;
НС1
+ Сu(ОН)2
= СuОНСl
+ Н2О.
3.
Кислоты взаимодействуют с основными
оксидам:
2НСl
+ СаО = СаС12
+ Н2О;
H2SO4
+Fe2O3=Fe2(SO4)3+
ЗН2О.
4.
Кислоты взаимодействуют с амфотерными
оксидами:
2HNO3
+ ZnO
= Zn(NO3)2
+ Н2О.
5.
Кислоты взаимодействуют с некоторыми
средними солями с образованием новой
соли и новой кислоты, реакции возможны
в том случае, если в результате образуется
нерастворимая соль или более слабая
(или более летучая) кислота, чем исходная.
Например:
2НС1+Na2CO3=2NaCl+H2CO3;
NaCl
+ H2SO4
= HCl + Na2SO4.
6.
Кислоты взаимодействуют с металлами.
Характер продуктов этих реакций зависит
от природы и концентрации кислоты и от
активности металла. Например, разбавленная
серная кислота, хлороводородная кислота
и другие кислоты‑неокислители
взаимодействуют с металлами, которые
находятся в электрохимическом ряду
напряжения левее водорода. В результате
реакции образуются соль и газообразный
водород:
H2SO4
(разб))
+ Zn
= ZnSO4
+ Н2↑;
НС1
+ Mg
= MgО
+ H2↑.
Кислоты-окислители
(концентрированная серная кислота,
азотная кислота HNO3
любой концентрации) взаимодействуют и
с металлами, стоящими в ряду напряжения
после водорода с образованием соли и
продукта восстановления кислоты.
Например:
2H2SO4
(конц)
+ Zn = ZnSO4
+SO2↑+
2H2O;
Получение
кислот
1.
Бескислородные кислоты получают путем
синтеза из простых веществ и последующим
растворением продукта в воде.
S
+ Н2
= Н2S.
2.
Оксокислоты получают взаимодействием
кислотных оксидов с водой.
SO3
+ Н2О
= H2SО4.
3.
Большинство кислот можно получить
взаимодействием солей с кислотами.
Na2SiО3
+ H2SO4
= H2SiО3
+ Na2SO4.
Амфотерные
гидроксиды
1.
В нейтральной среде (чистая вода)
амфотерные гидроксиды практически не
растворяются и не диссоциируют на
ионы.
Они растворяются в кислотах и щелочах.
Диссоциацию амфотерных гидроксидов в
кислой и щелочной средах можно выразить
следующими уравнениями:
Zn
+ OH–
Zn(OH)
H+
+ ZnO
А13+
+ ЗОН–
Al(OH)3
H+
+ AlO+
H2O
2.
Амфотерные гидроксиды взаимодействуют
как с кислотами, так и со щелочами,
образуя соль и воду.
Взаимодействие
амфотерных гидроксидов с кислотам:
Zn(OH)2
+ 2НCl
+ ZnCl2
+ 2Н2О;
Sn(OH)2+
H2SO4
= SnSO4
+ 2Н2О.
Взаимодействие
амфотерных гидроксидов со щелочами:
Zn(OH)2
+ 2NaOH
Na2ZnO2
+ 2H2O;
А1(ОН)3
+ NaOH
NаАlO2
+ 2Н2О;
Zn(OH)2
+ 2NaOH
Na2[Zn(OH)4];
Pb(OH)2
+ 2NaOH
Na2[Pb(OH)4].
Соли
–
продукты замещения атомов водорода в
молекуле кислоты на атомы металла или
замещения гидроксид-иона в молекуле
основания кислотными остатками.
Общие химические
свойства солей
1. Соли в водных
растворах диссоциируют на ионы:
а)
средние соли диссоциируют на катионы
металлов и анионы кислотных остатков:
NaCN
=Na++СN–
;
Ва(СН3СОО)2
= Ва2+
+ 2(СН3СОО)–
.
6)
кислые
соли диссоциируют на катионы металла
и сложные
анионы:
KHSО3
= К+
+ HSO32-;
NaH2PO4
=
Na+
+ Н2РО4–.
в)
основные соли диссоциируют на сложные
катионы и анионы кислотных остатков:
АlОН(СН3СОО)2
=
АlОН2+
+ 2СН3СОО–.
2.
Соли взаимодействуют с металлами с
образованием новой соли и нового металла.
Данный металл может вытеснять из
растворов солей только те металлы,
которые находятся правее его в
электрохимическом ряду напряжения:
CuSO4
+
Fe
= FeSO4
+ Сu.
3.
Растворимые соли взаимодействуют со
щелочами с образованием новой соли и
нового основания. Реакция возможна,
если образующееся основание или соль
выпадают в осадок. Например:
FeCl3+3КОН=Fe(OH)3↓+3КС1;
К2СО3+Ba(OH)2=ВаCO3↓+
2КОН.
4. Соли взаимодействуют
с кислотами с образованием новой более
слабой кислоты или новой нерастворимой
соли:
Na2CO3
+ 2HC1 = 2NaCl + CO2↑
+ H2O.
При
взаимодействии соли с кислотой, образующей
данную соль, получается кислая соль
(это возможно в том случае, если соль
образована многоосновной кислотой).
Например:
Na2S
+ H2S
= 2NaHS;
CaCO3
+ CO2+
H2O
= Ca(HCО3)2
.
5.
Соли могут взаимодействовать между
собой с образованием новых солей, если
одна из солей выпадает в осадок:
AgNO3
+ KC1
= AgCl↓
+ KNO3.
6. Многие соли
разлагаются при нагревании:
MgCО3
MgO
+
CО2↑;
2NaNO3
2NaNO2
+ O2↑.
7.
Основные соли взаимодействуют с кислотами
с образованием средних солей и воды:
Fe(OH)2NO3+HNO3=FeOH(NO3)2+H2O;
FeOH(NO3)2+HNO3=Fe(NO3)3
+ H2O.
8.
Кислые соли взаимодействуют с щелочами
с образованием средних солей и воды:
NaHSO4
+ NaOH
= Na2SO3
+ H2O;
КН2РО4
+ КОН = К2НРО4
+ Н2О.
Получение солей
Все
способы получения солей основаны на
химических свойствах важнейших классов
неорганических соединений. Десять
классических способов получения солей
представлены в табл. 8. Кроме общих
способов получения солей, возможны и
некоторые частные способы:
1.
Взаимодействие металлов, оксиды и
гидроксиды которых являются амфотерными,
с щелочами.
2. Сплавление солей
с некоторыми кислотными оксидами.
K2CO3
+ SiO2
K2SiO3
+ CO2↑.
3. Взаимодействие
щелочей с галогенами:
2КОН
+Сl2
KCl
+KClO
+ H2O;
4. Взаимодействие
галогенидов с галогенами:
2КВг
+ Cl2
= 2КС1 +Вг2
Таблица
8 ‑ Основные
способы получения солей
|
Неметалл |
Кислотный |
Кислота |
Соль |
|
|
Металл |
Соль |
– |
Соль + … |
Соль +металл |
|
Основный |
– |
Соль |
Соль |
– |
|
Основание |
– |
Соль + вода |
Соль + вода |
Соль |
|
Соль |
– |
– |
Соль |
Соль + соль |
При
графическом изображении формул веществ указывается последовательность расположения
атомов в молекуле с помощью, так называемых валентных штрихов (термин
«валентный штрих» предложил в 1858 г. А. Купер для обозначения химических сил
сцепления атомов), иначе называемых валентной чертой (каждая валентная черта,
или валентный штрих, эквивалентны одной паре электронов в ковалентных
соединениях или одному электрону, участвующему в образовании ионной связи).
Часто неправильно принимают графическое изображение формул за структурные
формулы, приемлемые только для соединений с ковалентной связью и показывающие
взаимное расположение атомов в молекуле.
Так, формула Nа—СL не является структурной, так как NаСI — ионное соединение, в его
кристаллической решетке отсутствуют молекулы (молекулы NаСL существуют только в газовой фазе).
В узлах кристаллической решетки NаСI
находятся ионы, причем каждый Nа+
окружен шестью хлорид-ионами. Это графическое изображение формулы вещества,
показывающее, что ионы натрия не связаны между собой, а с хлорид-ионами. Не
соединяются между собой и хлорид-ионы, они соединены с ионами натрия.
Покажем
это на примерах. Мысленно предварительно «разбиваем» лист бумаги на несколько
столбцов и выполняем действия согласно алгоритмам по графическому изображению
формул оксидов, оснований, кислот, солей в следующем порядке.
Графическое
изображение формул оксидов (например, Аl2O3)
III II
1. Определяем
валентность атомов элементов в Аl2O3
2.
Записываем химические знаки атомов металлов на первое место (первый столбец).
Если атомов металлов больше одного, то записываем и в один столбец и обозначаем
валентность (число связей между атомами) валентными штрихами
З.
Второе место (столбец), тоже в один столбец, занимают химические знаки атомов
кислорода, причем к каждому атому кислорода должно подходить по два валентных
штриха, так как кислород двухвалентен
lll ll l
Графическое изображение формул оснований (например Fе(ОН)3)
1.
Определяем валентность атомов элементов Fе(ОН)3
2.
На первом месте (первый столбец) пишем химические знаки атомов металла,
обозначаем их валентность Fе
З.
Второе место (столбец) занимают химические знаки атомов кислорода, которые
присоединяются одной связью к атому металла, вторая связь пока «свободна»
4.
Третье место (столбец) занимают химические знаки атомов водорода,
присоединяющихся на «свободную»
валентность атомов кислорода
Графическое
изображение формул кислот (например, Н2SO4)
l Vl ll
1. Определяем
валентность атомов элементов Н2SO4.
2.
На первом месте (первый столбец) пишем химические знаки атомов водорода в один
столбец с обозначением валентности
Н—
Н—
З.
Второе место (столбец) занимают атомы кислорода, присоединяясь одной валентной
связью к атому водорода, при этом вторая валентность каждого атома кислорода
пока «свободна»
Н—
О —
Н—
О —
4.
Третье место (столбец) занимают химические знаки атомов кислотообразователя с
обозначением валентности
5.
На «свободные» валентности атома кислотообразователя присоединяются атомы
кислорода согласно правилу валентности
Графическое
изображение формул солей
Средние
соли
(например, Fe2SO4)3) В средних солях все
атомы водорода кислоты замещены на атомы металла, поэтому при графическом
изображении их формул первое место (первый столбец) занимают химические знаки
атомов металла с обозначением валентности, а далее — как в кислотах, то есть
второе место (столбец) занимают химические знаки атомов кислорода, третье место
(столбец) — химические знаки атомов кислотообразователя, их три и они присоединяются
к шести атомам кислорода. На «свободные» валентности кислотообразователя присоединяются
атомы кислорода согласно правилу валентности
Кислые
соли (например, Ва(Н2PO4)2) Кислые соли можно рассматривать
как продукты частичного замещения атомов водорода в кислоте атомами металла,
поэтому при составлении графических формул кислых солей на первое место (первый
столбец) записывают химические знаки атомов металла и водорода с обозначением
валентности
Н—
Н—
Ва
=
Н—
Н—
Второе
место (столбец) занимают химические знаки атомов кислорода
Третье
место (столбец) — химические знаки атомов кислотообразователя, на «свободные»
валентности кислотообразователя присоединяются атомы кислорода согласно
правилу валентности
Основные
соли
(например, А1ОНSO4) Основные соли определяем, чем как
продукт частичного замещения группы ОН основания на кислотный остаток. При
составлении графических формул основных солей первое место (столбец) занимают
химические знаки атомов металлов с обозначением валентности, второе (столбец) —
химические знаки атомов металлов кислорода, третье — химические знаки атомов
водорода и кислотообразователя с обозначением соответствующей валентности. На
«свободные» валентности атома
кислотообразователя присоединяются атомы кислорода согласно правилу валентности
По
графическому изображению формул веществ можно судить об их свойствах,
определяют истинную степень окисления, например, Na+1–О-1 –О-1– Na+1
или в органических соединениях
Структурная формула Фосфата кальция
Ca3(PO4)2 Ca+23(P+5O-24)2
Инфоурок
›
Химия
›Другие методич. материалы›Алгоритм составления формул основных классов неорганических соединений
Алгоритм составления формул основных классов неорганических соединений
Скачать материал
без ожидания
Скачать материал
без ожидания


- Сейчас обучается 69 человек из 32 регионов


- Сейчас обучается 44 человека из 21 региона




Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 252 021 материал в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Материал подходит для УМК
Другие материалы
- 04.11.2022
- 75
- 3

- 04.11.2022
- 86
- 0
- 04.11.2022
- 66
- 0
- 04.11.2022
- 76
- 0

- 04.11.2022
- 96
- 0




Вам будут интересны эти курсы:
-
Курс повышения квалификации «Химия окружающей среды»
-
Курс профессиональной переподготовки «Химия: теория и методика преподавания в образовательной организации»
-
Курс повышения квалификации «Методика написания учебной и научно-исследовательской работы в школе (доклад, реферат, эссе, статья) в процессе реализации метапредметных задач ФГОС ОО»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Особенности подготовки к сдаче ОГЭ по химии в условиях реализации ФГОС ООО»
-
Курс повышения квалификации «Правовое регулирование рекламной и PR-деятельности»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс профессиональной переподготовки «Организация маркетинга в туризме»
-
Курс повышения квалификации «Финансы предприятия: актуальные аспекты в оценке стоимости бизнеса»
-
Курс профессиональной переподготовки «Управление ресурсами информационных технологий»
-
Курс повышения квалификации «Психодинамический подход в консультировании»
-
Курс повышения квалификации «Современные образовательные технологии в преподавании химии с учетом ФГОС»
-
Курс профессиональной переподготовки «Организация деятельности специалиста оценщика-эксперта по оценке имущества»
-
Курс профессиональной переподготовки «Техническое сопровождение технологических процессов переработки нефти и газа»
-
Курс профессиональной переподготовки «Организация системы учета и мониторинга обращения с отходами производства и потребления»
-
Скачать материал (медленно)
Настоящий материал опубликован пользователем Федотова Елена Геннадьевна. Инфоурок является
информационным посредником и предоставляет пользователям возможность размещать на сайте
методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них
сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайтЕсли Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с
сайта, Вы можете оставить жалобу на материал.Удалить материал
-
- На сайте: 7 лет и 10 месяцев
- Подписчики: 0
- Всего просмотров: 18914
-
Всего материалов:
11
Как написать структурную формулу
Структурная формула – это графическое изображение химического строения молекулы вещества, в котором показывается порядок связи атомов, их геометрическое расположение. Кроме того, она наглядно показывает валентность атомов входящих в ее состав.
Вам понадобится
- – ручка;
- – бумага;
- – периодическая система элементов.
Инструкция
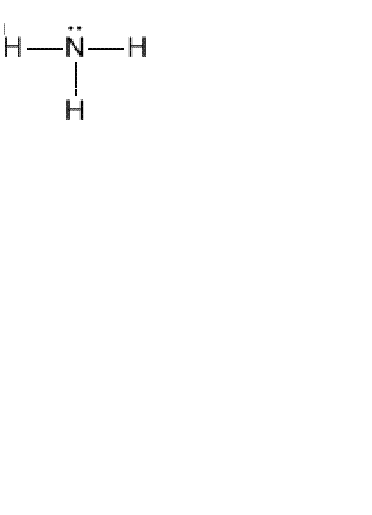
Для правильного написания структурной формулы того или иного химического вещества вы должны хорошо знать и представлять, что такое способность атомов образовывать определенное количество электронных пар с другими атомами. Ведь именно валентность поможет вам нарисовать химические связи. Например, дана молекулярная формула аммиака NH3. Вы должны написать структурную формулу. Учитывайте то, что водород всегда одновалентен, поэтому его атомы не могут быть связаны между собой, следовательно, они будут соединены с азотом.
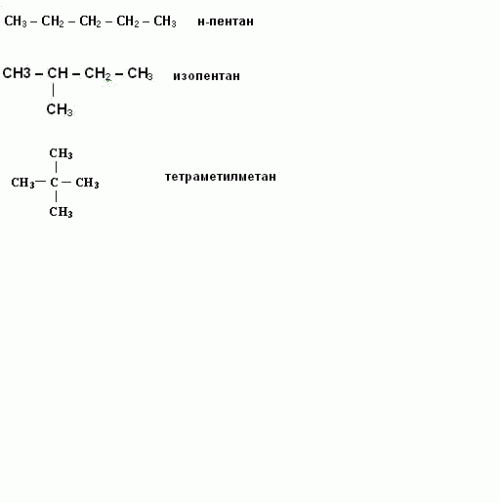
Чтобы правильно написать структурные формулы органических соединений, повторите основные положения теории А.М. Бутлерова, согласно которой существуют изомеры – вещества с одинаковым элементарным составом, но с разными химическими свойствами. Например, изобутан и бутан. Молекулярная формула у них одинаковая: C4H10, а структурные – отличаются.
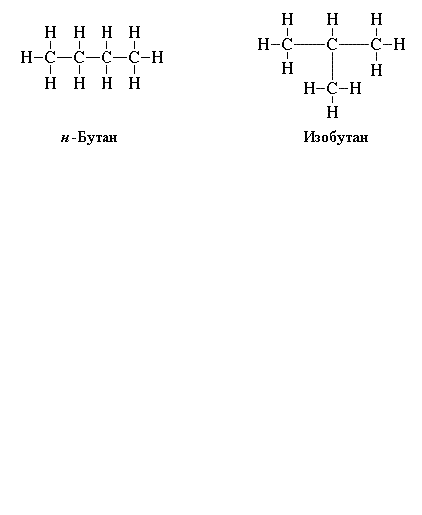
В линейной формуле каждый атом записывается отдельно, поэтому такое изображение занимает много места. Однако при составлении структурной формулы, вы можете указать общее число атомов водорода при каждом атоме углерода. А между соседними углеродами нарисуйте химические связи в виде линий.

Написание изомеров начните с углеводорода нормального строения, то есть с неразветвленной цепью углеродных атомов. Затем сократите на один атом углерода, который присоедините к другому, внутреннему углероду. Исчерпав все варианты написания изомеров с данной длиной цепи, сократите ее еще на один углеродный атом. И опять присоедините его к внутреннему углеродному атому цепи. Например, структурные формулы н-пентана, изопентана, тетраметилметана. Таким образом, углеводород с молекулярной формулой C5H12 имеет три изомера.
Полезный совет
Для определения валентности атомов при составлении структурных формул используйте периодическую систему. Показать точно расстояние атомов в молекуле поможет трехмерная структурная формула.
Источники:
- структурная формула веществ
- Составление формул комплексных соединений
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.