Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 июня 2020 года; проверки требуют 11 правок.
| Сульфат алюминия | |
|---|---|
 ![{displaystyle mathrm { ! {Biggr ]}_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/574adab1409cb81da6c38bb738ad111e61bbb2d9)  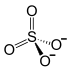 ![{displaystyle mathrm { ! {Biggr ]}_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd32744e9f4314d390f5ee107a8bd812d0cc2da0) |
|
 |
|
| Общие | |
| Традиционные названия | сернокислый алюминий |
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность |
2,710 г/см3 (безв.) 1,690 г/см3 (18-водн.) |
| Термические свойства | |
| Температура | |
| • плавления | 700 °C[1] |
| • кипения | 1600 °C[2] |
| • разложения | 580 °C |
| Классификация | |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES |
O=S1(=O)O[Al]2OS(=O)(=O)O[Al](O1)OS(=O)(=O)O2 |
| InChI |
InChI=1S/2Al.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6 DIZPMCHEQGEION-UHFFFAOYSA-H |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Безопасность | |
| Токсичность | малотоксично |
| NFPA 704 |
0 1 0 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфа́т алюми́ния — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Физические свойства[править | править код]
Бесцветные кристаллы, пластинки или порошок. Имеет орторомбическую решетку. Плотность — 2,710 г/см3, удельная теплоёмкость при постоянном давлении — 259,6 Дж/(моль К). Плохо растворим в спиртах, хорошо растворим в воде, гигроскопичен. Устойчив при обычной температуре[3][4].
Образует кристаллогидрат с формулой Al2(SO4)3·18H2O, выглядящий как бесцветные кристаллы, плавящиеся при 86,5 °C (с разложением) и с плотностью 1,690 г/см3. При длительном хранении 18-водный кристаллогидрат может частично выветриваться до содержания 14—14,5 молекул воды. 18-водный кристаллогидрат теряет воду при нагревании, образуя формы[3]:
- 150 °C — Al2(SO4)3·14 H2O,
- 160 °C — Al2(SO4)3·10 H2O,
- 250 °C — Al2(SO4)3·3 H2O,
- 420 °C — полностью безводную.
Химические свойства[править | править код]
- Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид[3]:
- Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины[4][5].
- Гидролизуется горячей водой:
- При сплавлении со щелочами образует алюминаты:
- В холодном концентрированном растворе аммиака образует осадок гидроксида, а в горячем – метагидроксида алюминия[6]:
Получение[править | править код]
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
Применение[править | править код]
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520[7].
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей[4].
Примечания[править | править код]
- ↑ Aluminum sulfate, Aluminum sulfate (англ.)
- ↑ Aluminum sulfate, Aluminum sulfate
- ↑ 1 2 3 Волохов, 1988.
- ↑ 1 2 3 Гурлев, 1988, с. 285.
- ↑ Джеймс, 1980, с. 83.
- ↑ Лидин, 2000, с. 85.
- ↑ E-520 (Е-520) Сульфат алюминия. Дата обращения: 30 марта 2010. Архивировано 15 сентября 2011 года.
Литература[править | править код]
- Волохов Ю. А. Алюминия сульфат : статья // Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М. : Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 121. — 623 с.
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — 335 с. — ISBN 5-335-00125-4.
- Джеймс Т. Теория фотографического процесса = The theory of the photographic process / пер. 4-го американского изд. под ред. Картужанского А. Л.. — 2-е русское изд. — Л.: «Химия». Ленинградское отделение., 1980. — 672 с.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
| Сульфат алюминия | |
|---|---|
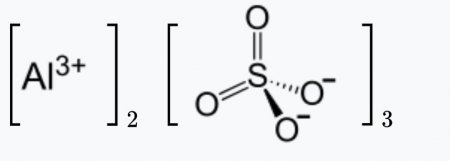 |
|
| Традиционные названия | сернокислый алюминий |
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность |
2,710 г/см3 (безв.) 1,690 г/см3 (18-водн.) |
| Температура | |
| • плавления | 700 °C |
| • кипения | 1600 °C |
| • разложения | 580 °C |
| ГОСТ | ГОСТ 3758-75 |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES |
O=S1(=O)O[Al]2OS(=O)(=O)O[Al](O1)OS(=O)(=O)O2 |
| InChI |
1S/2Al.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6 DIZPMCHEQGEION-UHFFFAOYSA-H |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Токсичность | малотоксично |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфат алюминия — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Физические свойства
Бесцветные кристаллы, пластинки или порошок. Имеет орторомбическую решетку. Плотность — 2,710 г/см3, удельная теплоёмкость при постоянном давлении — 259,6 Дж/(моль К). Плохо растворим в спиртах, хорошо растворим в воде, гигроскопичен. Устойчив при обычной температуре.
Образует кристаллогидрат с формулой Al2(SO4)3·18H2O, выглядящий как бесцветные кристаллы, плавящиеся при 86,5 °C (с разложением) и с плотностью 1,690 г/см3. При длительном хранении 18-водный кристаллогидрат может частично выветриваться до содержания 14—14,5 молекул воды. 18-водный кристаллогидрат теряет воду при нагревании, образуя формы:
- 150 °C — Al2(SO4)3·14 H2O,
- 160 °C — Al2(SO4)3·10 H2O,
- 250 °C — Al2(SO4)3·3 H2O,
- 420 °C — полностью безводную.
Химические свойства
Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид:
- Al2(SO4)3 →580∘C Al2O3 + 3 SO3
Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины.
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
- 2 Al(OH)3 + 3 H2SO4 ⟶ Al2(SO4)3 + 6 H2O
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
- 2 Al + 3 H2SO4 ⟶ Al2(SO4)3 + 3 H2
Применение
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520.
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей.
Содержание
- Физические свойства
- Химические свойства
- Получение
- Применение
Сульфат алюминия — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
| Сульфат алюминия | |
|---|---|
| Общие | |
| Традиционные названия | сернокислый алюминий |
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность |
2,710 г/см3 (безв.) 1,690 г/см3 (18-водн.) |
| Термические свойства | |
| Температура | |
| • плавления | 700 °C |
| • кипения | 1600 °C |
| • разложения | 580 °C |
| Классификация | |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES |
O=S1(=O)O[Al]2OS(=O)(=O)O[Al](O1)OS(=O)(=O)O2 |
| InChI |
1S/2Al.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6 DIZPMCHEQGEION-UHFFFAOYSA-H |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Безопасность | |
| Токсичность | малотоксично |
| NFPA 704 |
Физические свойства
Бесцветные кристаллы, пластинки или порошок. Имеет орторомбическую решетку. Плотность — 2,710 г/см3, удельная теплоёмкость при постоянном давлении — 259,6 Дж/(моль К). Плохо растворим в спиртах, хорошо растворим в воде, гигроскопичен. Устойчив при обычной температуре.
Образует кристаллогидрат с формулой Al2(SO4)3·18H2O, выглядящий как бесцветные кристаллы, плавящиеся при 86,5 °C (с разложением) и с плотностью 1,690 г/см3. При длительном хранении 18-водный кристаллогидрат может частично выветриваться до содержания 14—14,5 молекул воды. 18-водный кристаллогидрат теряет воду при нагревании, образуя формы:
- 150 °C — Al2(SO4)3·14 H2O,
- 160 °C — Al2(SO4)3·10 H2O,
- 250 °C — Al2(SO4)3·3 H2O,
- 420 °C — полностью безводную.
Химические свойства
Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид:
Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины.
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
Применение
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E-520.
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей.
From Wikipedia, the free encyclopedia

|
|
| Names | |
|---|---|
| IUPAC name
Aluminium sulfate |
|
| Other names
Aluminum sulfate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.110 |
| EC Number |
|
| E number | E520 (acidity regulators, …) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Al2(SO4)3 |
| Molar mass | 342.15 g/mol (anhydrous) 666.44 g/mol (octadecahydrate) |
| Appearance | white crystalline solid hygroscopic |
| Density | 2.672 g/cm3 (anhydrous) 1.62 g/cm3 (octadecahydrate) |
| Melting point | 770 °C (1,420 °F; 1,040 K) (decomposes, anhydrous) 86.5 °C (octadecahydrate) |
|
Solubility in water |
31.2 g/100 mL (0 °C) 36.4 g/100 mL (20 °C) 89.0 g/100 mL (100 °C) |
| Solubility | slightly soluble in alcohol, dilute mineral acids |
| Acidity (pKa) | 3.3–3.6 |
|
Magnetic susceptibility (χ) |
−93.0×10−6 cm3/mol |
|
Refractive index (nD) |
1.47[1] |
| Structure | |
|
Crystal structure |
monoclinic (hydrate) |
| Thermochemistry | |
|
Std enthalpy of |
-3440 kJ/mol |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
none[2] |
|
REL (Recommended) |
2 mg/m3[2] |
|
IDLH (Immediate danger) |
N.D.[2] |
| Related compounds | |
|
Other cations |
Gallium sulfate Magnesium sulfate |
|
Related compounds |
See Alum |
| Supplementary data page | |
| Aluminium sulfate (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Aluminium sulfate is a salt with the formula Al2(SO4)3. It is soluble in water and is mainly used as a coagulating agent (promoting particle collision by neutralizing charge) in the purification of drinking water[3][4] and wastewater treatment plants, and also in paper manufacturing.
The anhydrous form occurs naturally as a rare mineral millosevichite, found for example in volcanic environments and on burning coal-mining waste dumps. Aluminium sulfate is rarely, if ever, encountered as the anhydrous salt. It forms a number of different hydrates, of which the hexadecahydrate Al2(SO4)3·16H2O and octadecahydrate Al2(SO4)3·18H2O are the most common. The heptadecahydrate, whose formula can be written as [Al(H2O)6]2(SO4)3·5H2O, occurs naturally as the mineral alunogen.
Aluminium sulfate is sometimes called alum or papermaker’s alum in certain industries. However, the name “alum” is more commonly and properly used for any double sulfate salt with the generic formula XAl(SO
4)
2·12H
2O, where X is a monovalent cation such as potassium or ammonium.[5]
Production[edit]
In the laboratory[edit]
Aluminium sulfate may be made by adding aluminium hydroxide, Al(OH)3, to sulfuric acid, H2SO4:
> + 3 H2SO4 → Al2(SO4)3 + 6 H2O
or by heating aluminium metal in a sulfuric acid solution:
- 2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2↑
From alum schists[edit]
The alum schists employed in the manufacture of aluminium sulfate are mixtures of iron pyrite, aluminium silicate and various bituminous substances, and are found in upper Bavaria, Bohemia, Belgium, and Scotland. These are either roasted or exposed to the weathering action of the air. In the roasting process, sulfuric acid is formed and acts on the clay to form aluminium sulfate, a similar condition of affairs being produced during weathering. The mass is now systematically extracted with water, and a solution of aluminium sulfate of specific gravity 1.16 is prepared. This solution is allowed to stand for some time (in order that any calcium sulfate and basic iron(III) sulfate may separate), and is then evaporated until iron(II) sulfate crystallizes on cooling; it is then drawn off and evaporated until it attains a specific gravity of 1.40. It is now allowed to stand for some time, and decanted from any sediment.[6]
From clays or bauxite[edit]
In the preparation of aluminium sulfate from clays or from bauxite, the material is gently calcined, then mixed with sulfuric acid and water and heated gradually to boiling; if concentrated acid is used no external heat is generally required as the formation of aluminium sulfate is exothermic. It is allowed to stand for some time, and the clear solution is drawn off.
From cryolite[edit]
When cryolite is used as the ore, it is mixed with calcium carbonate and heated. By this means, sodium aluminate is formed; it is then extracted with water and precipitated either by sodium bicarbonate or by passing a current of carbon dioxide through the solution. The precipitate is then dissolved in sulfuric acid.[6]
Uses[edit]
Sediment core sampled from a Minnesota lake. Aluminium sulfate flocs are depicted as white clumps near the sediment surface.
Aluminium sulfate is sometimes used in the human food industry as a firming agent, where it takes on E number E520, and in animal feed as a bactericide. In the United States, the FDA lists it as “generally recognized as safe” with no limit on concentration.[7] Aluminium sulfate may be used as a deodorant, an astringent, or as a styptic for superficial shaving wounds.[citation needed] Aluminium sulfate is used as a mordant in dyeing and printing textiles.
It is a common vaccine adjuvant and works “by facilitating the slow release of antigen from the vaccine depot formed at the site of inoculation.”[citation needed]
Aluminium sulfate is used in water purification and for chemical phosphorus removal from wastewater. It causes suspended impurities to coagulate into larger particles and then settle to the bottom of the container (or be filtered out) more easily. This process is called coagulation or flocculation. Research suggests that in Australia, aluminium sulfate used in this way in drinking water treatment is the primary source of hydrogen sulfide gas in sanitary sewer systems.[8] An improper and excess application incident in 1988 polluted the water supply of Camelford in Cornwall.
Aluminium sulfate has been used as a method of eutrophication remediation for shallow lakes. It works by reducing the phosphorus load in the lakes.[9][10]
When dissolved in a large amount of neutral or slightly alkaline water, aluminium sulfate produces a gelatinous precipitate of aluminium hydroxide, Al(OH)3. In dyeing and printing cloth, the gelatinous precipitate helps the dye adhere to the clothing fibers by rendering the pigment insoluble.
Aluminium sulfate is sometimes used to reduce the pH of garden soil, as it hydrolyzes to form the aluminium hydroxide precipitate and a dilute sulfuric acid solution. An example of what changing the pH level of soil can do to plants is visible when looking at Hydrangea macrophylla. The gardener can add aluminium sulfate to the soil to reduce the pH which in turn will result in the flowers of the Hydrangea turning a different color (blue). The aluminium is what makes the flowers blue; at a higher pH, the aluminium is not available to the plant.[11]
In the construction industry, it is used as waterproofing agent and accelerator in concrete. Another use is a foaming agent in fire fighting foam.
It can also be very effective as a molluscicide,[12] killing spanish slugs.
Mordants aluminium triacetate and aluminium sulfacetate can be prepared from aluminium sulfate, the product formed being determined by the amount of lead(II) acetate used:[13]
- Al
2(SO
4)
3 + 3 Pb(CH
3CO
2)
2 → 2 Al(CH
3CO
2)
3 + 3 PbSO
4
- Al
2(SO
4)
3 + 2 Pb(CH
3CO
2)
2 → Al
2SO
4(CH
3CO
2)
4 + 2 PbSO
4
Chemical reactions[edit]
The compound decomposes to γ-alumina and sulfur trioxide when heated between 580 and 900 °C. It combines with water forming hydrated salts of various compositions.
Aluminium sulfate reacts with sodium bicarbonate to which foam stabilizer has been added, producing carbon dioxide for fire-extinguishing foams:
- Al2(SO4)3 + 6 NaHCO3 → 3 Na2SO4 + 2 Al(OH)3 + 6 CO2
The carbon dioxide is trapped by the foam stabilizer and creates a thick foam which will float on top of hydrocarbon fuels and seal off access to atmospheric oxygen, smothering the fire. Chemical foam was unsuitable for use on polar solvents such as alcohol, as the fuel would mix with and break down the foam blanket. The carbon dioxide generated also served to propel the foam out of the container, be it a portable fire extinguisher or fixed installation using hoselines. Chemical foam is considered obsolete in the United States and has been replaced by synthetic mechanical foams, such as AFFF which have a longer shelf life, are more effective, and more versatile, although some countries such as Japan and India continue to use it.[citation needed]
References[edit]
Footnotes[edit]
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. “#0024”. National Institute for Occupational Safety and Health (NIOSH).
- ^ Global Health and Education Foundation (2007). “Conventional Coagulation-Flocculation-Sedimentation”. Safe Drinking Water is Essential. National Academy of Sciences. Archived from the original on 2007-10-07. Retrieved 2007-12-01.
- ^ Kvech S, Edwards M (2002). “Solubility controls on aluminum in drinking water at relatively low and high pH”. Water Research. 36 (17): 4356–4368. doi:10.1016/S0043-1354(02)00137-9. PMID 12420940.
- ^ Austin, George T. (1984). Shreve’s Chemical process industries (5th ed.). New York: McGraw-Hill. p. 357. ISBN 9780070571471. Archived from the original on 2014-01-03.
- ^ a b Chisholm 1911, p. 767.
- ^ 21 CFR 182.1125, 2020-04-01, retrieved 2021-02-22
- ^ Ilje Pikaar; Keshab R. Sharma; Shihu Hu; Wolfgang Gernjak; Jürg Keller; Zhiguo Yuan (2014). “Reducing sewer corrosion through integrated urban water management”. Science. 345 (6198): 812–814. Bibcode:2014Sci…345..812P. doi:10.1126/science.1251418. PMID 25124439. S2CID 19126381.
- ^ Kennedy, Robert H.; Cook, G. Dennis (June 1982). “Control of Lake Phosphorus with Aluminum Sulfate: Dose Determination and Application Techniques”. Journal of the American Water Resources Association. 18 (3): 389–395. Bibcode:1982JAWRA..18..389K. doi:10.1111/j.1752-1688.1982.tb00005.x. ISSN 1093-474X.
- ^ Martyn, Huser, Brian J. Egemose, Sara Harper, Harvey Hupfer, Michael Jensen, Henning Pilgrim, Keith M. Reitzel, Kasper Rydin, Emil Futter (2016). Longevity and effectiveness of aluminum addition to reduce sediment phosphorus release and restore lake water quality. Uppsala universitet, Limnologi. OCLC 1233676585.
- ^ Kari Houle (2013-06-18). “Blue or Pink – Which Color is Your Hydrangea”. University of Illinois Extension. Retrieved 2018-09-03.
- ^ Council, British Crop Protection; Society, British Ecological; Biologists, Association of Applied (1994). Field margins: integrating agriculture and conservation : proceedings of a symposium organised by the British Crop Protection Council in association with the British Ecological Society and the Association of Applied Biologists and held at the University of Warwick, Coventry on 18–20 April 1994. British Crop Protection Council. ISBN 9780948404757.
- ^ Georgievics, Von (2013). The Chemical Technology of Textile Fibres – Their Origin, Structure, Preparation, Washing, Bleaching, Dyeing, Printing and Dressing. Read Books. ISBN 9781447486121. Archived from the original on 2017-12-05.
Notations[edit]
- Chisholm, Hugh, ed. (1911). “Aluminium” . Encyclopædia Britannica. Vol. 1 (11th ed.). Cambridge University Press. p. 767.
- Pauling, Linus (1970). General Chemistry. W.H. Freeman: San Francisco. ISBN 978-0-486-65622-9.
External links[edit]
- International Chemical Safety Card 1191
- NIOSH Pocket Guide to Chemical Hazards
- WHO Food Additive Series No. 12
- Aluminum and health
- Government of Canada Fact Sheets and Frequently Asked Questions: Aluminum Salts
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Сульфат алюминия
Брутто-формула:
Al2O12S3
CAS# 10043-01-3
Категории:
Неорганические соли
PubChem CID: 24850
Названия
Русский:
- Сульфат алюминия
English:
- Aluminium sulfate
- Aluminium sulphate
- Aluminum alum
- Aluminum sulfate (2:3)
- Aluminum sulphate
- Alunogenite
- Cake alum
- Dialuminum sulfate
- Dialuminum trisulfate
- E520
- Filter alum
- Papermaker’s alum
- Pearl Alum
- Pickle Alum
- aluminum salt (3:2)
- dialuminum;trisulfate(IUPAC)
Варианты формулы:
Al2(SO4)3
Al(+3)2(S(+6)O(-2)4)3
$slope(45)O^-`/S`O`/O/O^-/0Al^3+/0O`^-S`/O/c/O`/O^-/0Al^3+/0O`^-S/O`/O“/O`^-
Вещества, имеющие отношение…
Анион:
Сульфаты
Химический состав
Реакции, в которых участвует Сульфат алюминия
-
2Al + 3H2SO4 “T”-> Al2(SO4)3 + 3H2″|^”
-
8Al + 15H2SO4 “T”-> 4Al2(SO4)3 + 3H2S”|^” + 12H2O
-
2Al(OH)3 + 3H2SO4 -> Al2(SO4)3 + 6H2O
-
2Al2(SO4)3 “770-860^oC”–> 2Al2O3 + 6SO2″|^” + 3O2″|^”
-
Al2(SO4)3 + 6NaHCO3 -> 3Na2SO4 + 2Al(OH)3 + 6CO2
И ещё 11 реакций…













