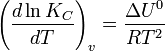Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Якоб Хендрик Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.
Уравнение, которое описывает это правило, следующее:
где 




Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60—120 кДж/моль в температурном диапазоне 10—400 °C. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например, белки в биологических системах.
Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле
Правило Вант-Гоффа
Материал
из Википедии — свободной энциклопедии
Правило
Вант-Гоффа — эмпирическое правило,
позволяющее в первом приближении оценить
влияние температуры на скорость
химической реакции в небольшом
температурном интервале (обычно от 0 °C
до 100 °C). Я. Х. Вант-Гофф на
основании множества экспериментов
сформулировал следующее правило:
-
При
повышении температуры на каждые 10
градусов константа скорости гомогенной
элементарной реакции увеличивается
в два — четыре раза.
Уравнение,
которое описывает это правило следующее:
где —
скорость реакции при температуре ,
—
скорость реакции при температуре ,
—
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
Следует
помнить, что правило Вант-Гоффа применимо
только для реакций с энергией активации
60-120 кДж/моль в температурном диапазоне
10-400oC.
Правилу Вант-Гоффа также не подчиняются
реакции, в которых принимают участие
громоздкие молекулы, например белки в
биологических системах. Температурную
зависимость скорости реакции более
корректно описывает уравнение
Аррениуса.
Из
уравнения Вант-Гоффа температурный
коэффициент вычисляется по формуле:
Закон
действующих масс
Зако́н
де́йствующих масс устанавливает
соотношение между массами реагирующих
веществ в химических реакциях
при равновесии,
а также зависимость скорости химической
реакции от концентрации исходных
веществ.
Закон
действующих масс в химической кинетике
Закон
действующих масс в кинетической форме
(основное уравнение кинетики) гласит,
что скорость элементарной химической
реакции пропорциональна
произведению концентрацийреагентов
в степенях, равных стехиометрическим
коэффициентам в уравнении реакции[1].
Это положение сформулировано в 1867 году
норвежскими учёными К.
Гульдбергом и П.
Вааге.
Для элементарной химической реакции:
закон
действующих масс может быть записан в
виде кинетического
уравнения вида:
где — скорость
химической реакции, — константа
скорости реакции.
Для
сложных реакций в общем виде это
соотношение не выполняется. Тем не
менее, многие сложные реакции условно
можно рассматривать как ряд последовательных
элементарных стадий с неустойчивыми
промежуточными продуктами, формально
эквивалентный переходу из начального
состояния в конечное в «один шаг». Такие
реакции называют формально
простыми[2].
Для формально простых реакций кинетическое
уравнение может быть получено в виде:
(для
трех исходных веществ, аналогично
приведённому выше уравнению).
Здесь ,
,
— порядок
реакции по
веществам ,
,
соответственно,
а сумма —
общий (или суммарный) порядок
реакции. ,
,
могут
быть не равны стехиометрическим
коэффициентам и не обязательно
целочисленные. при
определённых условиях может быть равно
и нулю.
Закон действующих масс в химической термодинамике
В химической
термодинамике закон
действующих масс связывает между собой
равновесные активности исходных веществ
и продуктов реакции, согласно соотношению:
где
ai — активность веществ.
Вместо активности могут быть
использованы концентрация (для
реакции в идеальном растворе), парциальные
давления (реакция
в смеси идеальных газов), фугитивность
(реакция в смеси реальных газов);
νi — стехиометрический
коэффициент (для
исходных веществ принимается отрицательным,
для продуктов — положительным);
Ka —
константа химического
равновесия.
Индекс «a» здесь означает использование
величины активности в
формуле.
На
практике в расчётах, не требующих особой
точности, значения активности обычно
заменяются на соответствующие значения
концентраций (для реакций в растворах)
либо парциальных давлений (для реакций
между газами). Константу равновесия при
этом обозначают Kc или Kp соответственно.
Впервые закон действующих масс был
выведен из кинетических представлений
Гульдбергом и Вааге, а термодинамический
вывод его дан Вант-Гоффом в
1885 году[3].
Пример:
для стандартной реакции
константа
химического равновесия определяется
по формуле
Химическое
равновесие
Текущая
версия страницы пока не
проверялась опытными
участниками и может значительно
отличаться от версии,
проверенной 14 июня 2010; проверки требуют 38
правок.
Химическое
равновесие — состояние химической системы,
в котором обратимо протекает
одна или несколько химических
реакций,
причём скорости в
каждой паре прямая-обратная реакция
равны между собой. Для системы, находящейся
в химическом
равновесии, концентрации реагентов, температура и
другие параметры системы не изменяются
со временем.[1]
А2 +
В2 ⇄
2AB
В
состоянии равновесия скорости прямой
и обратной реакции становятся равными.
Смещение
химического равновесия
Основная
статья: Принцип
Ле Шателье — Брауна
Положение
химического равновесия зависит от
следующих параметров
реакции: температуры, давления и концентрации.
Влияние, которое оказывают эти факторы
на химическую реакцию, подчиняются
закономерности, которая была высказана
в общем виде в 1885 году французским
ученым Ле-Шателье.
Факторы
влияющие на химическое равновесие:
1)
температура
При
увеличении температуры химическое
равновесие смещается в сторону
эндотермической (поглощение) реакции,
а при понижении в сторону экзотермической
(выделение) реакции.
CaCO3=CaO+CO2
-Q t↑ →, t↓ ←
N2+3H2↔2NH3
+Q t↑ ←, t↓ →
2)
давление
При
увеличении давления химическое равновесие
смещается в сторону меньшего объёма
веществ, а при понижении в сторону
большего объёма. Этот принцип действует
только на газы, т.е. если в реакции
участвуют твердые вещества, то они в
расчет не берутся.
CaCO3=CaO+CO2
P↑ ←, P↓ →
1моль=1моль+1моль
3)
концентрация исходных веществ и продуктов
реакции
При
увеличении концентрации одного из
исходных веществ химическое равновесие
смещается в сторону продуктов реакции,
а при увеличении концентрации продуктов
реакции-в сторону исходных веществ.
S2+2O2=2SO2
[S],[O]↑ →, [SO2]↑ ←
Катализаторы
не влияют на смещение химического
равновесия!
Принцип
Ле Шателье — Брауна
Принцип
Ле Шателье — Брауна (1884 г.) —
если на систему, находящуюся в устойчивом
равновесии, воздействовать извне,
изменяя какое-либо из условий равновесия
(температура,давление, концентрация),
то в системе усиливаются процессы,
направленные на компенсацию внешнего
воздействия.
Анри
Ле Шателье (Франция)
сформулировал этот термодинамический
принцип подвижного равновесия, позже
обобщённый Карлом
Брауном [1].
[править]Влияние
температуры
Влияние
температуры зависит от знака теплового
эффекта реакции. При повышении температуры
химическое равновесие смещается в
направлении эндотермической реакции,
при понижении температуры — в
направлении экзотермической реакции.
В общем же случае при изменении температуры
химическое равновесие смещается в
сторону процесса, знак изменения энтропии
в котором совпадает со знаком изменения
температуры. Зависимость константы
равновесия от температуры в конденсированных
системах описывается уравнением изобары
Вант-Гоффа:
в
системах с газовой фазой — уравнением
изохоры Вант-Гоффа
В
небольшом диапазоне температур в
конденсированных системах связь
константы равновесия с температурой
выражается следующим уравнением:
Например,
в реакции синтеза аммиака
N2 +
3H2 ⇄
2NH3 +
Q
тепловой
эффект в стандартных условиях
составляет +92 кДж/моль, реакция
экзотермическая, поэтому повышение
температуры приводит к смещению
равновесия в сторону исходных веществ
и уменьшению выхода продукта.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру. Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается.
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10оС.
Правило Вант-Гоффа звучит так: повышение температуры на 10оС приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ. Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например, для реакции образования аммиака:
N2 + 3H2 ↔ 2NH3
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления. При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается.
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
CaCO3 + SiO2 ↔ CaSiO3 + CO2↑
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором.
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
N2 + 3H2 ↔ 2NH3
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например, для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности. Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например, при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например, хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например, оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
485
Создан на
11 января, 2022 От Admin
Скорость химических реакций
Тренажер задания 18 ЕГЭ по химии
1 / 10
Из предложенного списка химических реакций выберите те, скорость которых увеличивается при использовании катализатора.
1) C + O2 = CO2
2) CO + 2H2 = CH3OH
3) Zn + 2HCl = ZnCl2 + H2
4) 2Na + S = Na2S
5) N2 + 3H2 = 2NH3
2 / 10
Из предложенного перечня выберите два внешних воздействия, которые оказывают влияние на скорость реакции магния с серной кислотой.
1) понижение температуры
2) повышение давления в системе
3) добавление сульфата магния
4) увеличение концентрации водорода
5) измельчение магния
Запишите в поле ответа номера выбранных внешних воздействий.
3 / 10
Из предложенного перечня выберите два вещества, на скорость реакции между которыми оказывает влияние повышение давления.
1) N2 (г)
2) MgO (тв.)
3) H2SO4 (р-р)
4) Ba(NO3)2 (р-р)
5) H2 (г)
4 / 10
Из предложенного перечня выберите два фактора, которые приводят к увеличению скорости химической реакции между оксидом меди(II) и соляной кислотой.
1) добавление воды
2) повышение давления в системе
3) измельчение оксида меди(II)
4) увеличение концентрации НСl
5) понижение температуры
5 / 10
Из предложенного перечня выберите все реакции; для которых увеличение давления не приводит к увеличению скорости реакции.
1) Cl2 + H2 = 2HCl
2) 4P(белый) + 5O2 = 2P2O5
3) Fe(порошок) + S(порошок) = FeS
4) Zn + 2HCl(р-р) = ZnCl2 + H2
5) C + 2H2 = CH4
Запишите номера выбранных ответов.
6 / 10
Из предложенного перечня выберите все реакции, которые при тех же условиях протекают с большей скоростью, чем взаимодействие натрия с этанолом.
1) взаимодействие лития с пропанолом-1
2) взаимодействие калия с этанолом
3) взаимодействие натрия с бутанолом-1
4) взаимодействие лития с этанолом
5) взаимодействие натрия с водой
7 / 10
Из предложенного перечня выберите два фактора, которые приводят к увеличению скорости химической реакции цинка с раствором серной кислоты.
1) увеличение концентрации водорода
2) увеличение концентрации кислоты
3) использование ингибитора
4) увеличение степени измельчения цинка
5) понижение температуры
Запишите в поле ответа номера выбранных факторов.
8 / 10
Из предложенного перечня выберите все факторы, которые приводят к увеличению скорости химической реакции меди с хлором.
1) использование ингибитора
2) измельчение меди
3) уменьшение концентрации хлора
4) повышение температуры
5) повышение давления в системе
9 / 10
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости химической реакции, уравнение которой
Zn(тв.) + 2НCl(р-р) = ZnCl2(р-р) + H2(г)
1) увеличение давления
2) увеличение концентрации ионов цинка
3) уменьшение температуры
4) увеличение концентрации кислоты
5) измельчение цинка
Запишите в поле ответа номера выбранных внешних воздействий.
10 / 10
Из предложенного перечня выберите все внешние воздействия, которые уменьшают скорость химической реакции между цинком и раствором сульфата меди(II).
1) нагревание реакционной смеси
2) добавление воды
3) охлаждение реакционной смеси
4) использование индикатора
5) уменьшение давления
Запишите номера выбранных ответов.
Ваша оценка
The average score is 39%
Скорость химической реакции – основное понятие химической кинетики, выражающее отношения количества
прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции:
моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в
другое в единице объема.
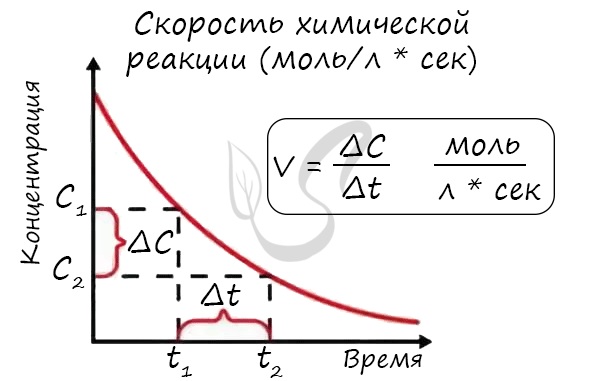
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость
реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции – 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд.
Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.

Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения
реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное
железо – железная стружка.

Химическая активность также играет важную роль. Например, отвечая на вопрос “какой из металлов Fe или Ca быстрее прореагирует с серой?” мы отдадим
предпочтение кальцию, так как в ряду активности металлов он стоит левее железа, а значит кальций активнее железа.

Иного подхода требуют реакции металлов с водой, где нужно учитывать радиус атома. Например, отвечая на вопрос “какой из металлов Li или K быстрее прореагирует с водой?” мы отдадим предпочтение калию, так как калий имеет больший радиус атома. Калий будет быстрее взаимодействовать с водой, чем литий.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас
я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота
относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации “прямо пропорционально” скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при
уменьшении – понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема
возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.

Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции
aA + bB → cC определяют по уравнению:
υ = k × СaA × СbB
Физический смысл константы скорости – k – в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих
веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени – a и b.
Записанное выше следствие закона действующих масс нужно не только “зазубрить”, но и понять. Поэтому мы решим пару задач, где потребуется
написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции,
если объемы системы уменьшить в три раза?

По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции
образования аммиака, если уменьшить концентрацию водорода в два раза?

В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: “Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как
экзотермической, так и эндотермической. Исключений нет!”
Очень часто в заданиях следующей темы – химическом равновесии, вас будут пытаться запутать и ввести в заблуждение, но вы не поддавайтесь
и помните про постулат!
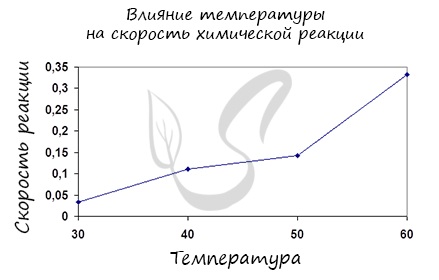
Итак, влияние температуры на скорость реакции “прямо пропорционально”: чем выше температура, тем выше скорость реакции – чем ниже
температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая “пропорция”.
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так:
“При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза”

В формуле, написанной выше, используются следующие обозначение:
- υ1 – скорость реакции при температуре t1
- υ2 – скорость реакции при температуре t2
- γ – температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку.
Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
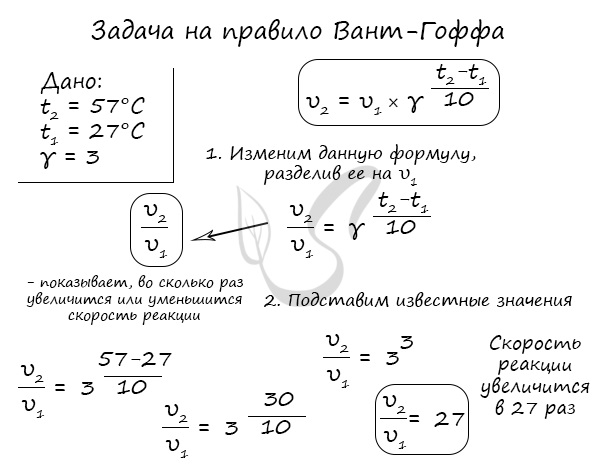
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: “Рассчитайте, чему равен температурный коэффициент
скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз”.

Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) – вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов – белковых молекул, ферментов. Без катализаторов
подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора
– каталитическими.

Ингибитор (лат. inhibere – задерживать) – вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества
являются ингибиторами.
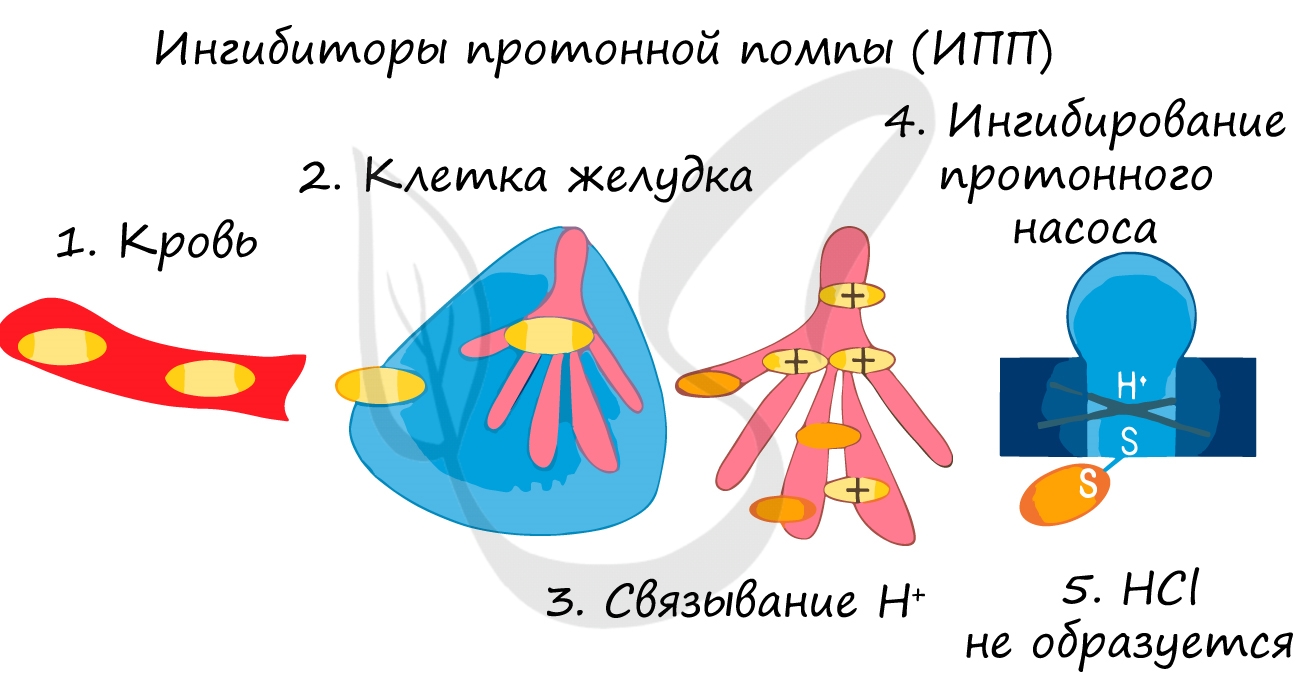
Так при лечении гастрита – воспаления желудка (греч. gaster – желудок) или язв часто назначаются ингибиторы протонной помпы – химические вещества,
которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка,
воспаление стихает.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Расчеты по уравнению вант гоффа
Из качественных соображений понятно, что скорость реакций должна увеличиваться с ростом температуры, т.к. при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения – правило Вант-Гоффа и уравнение Аррениуса.
Правило Вант-Гоффа заключается в том, что при нагревании на 10 о С скорость большинства химических реакций увеличивается в 2 4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом:
, (4.1)
где – температурный коэффициент скорости ( = 24). Правило Вант-Гоффа является весьма грубым и применимо только в очень ограниченном интервале температур.
Гораздо более точным является уравнение Аррениуса, описывающее температурную зависимость константы скорости:
, (4.2)
где R – универсальная газовая постоянная; A – предэкспоненциальный множитель, который не зависит от температуры, а определяется только видом реакции; EA – энергия активации, которую можно охарактеризовать как некоторую пороговую энергию: грубо говоря, если энергия сталкивающихся частиц меньше EA, то при столкновении реакция не произойдет, если энергия превышает EA, реакция произойдет. Энергия активации не зависит от температуры.
Графически зависимость k(T) выглядит следующим образом:
При низких температурах химические реакции почти не протекают: k(T) 0. При очень высоких температурах константа скорости стремится к предельному значению: k(T) A. Это соответствует тому, что все молекулы являются химически активными и каждое столкновение приводит к реакции.
Энергию активации можно определить, измерив константу скорости при двух температурах. Из уравнения (4.2) следует:
. (4.3)
Более точно энергию активации определяют по значениям константы скорости при нескольких температурах. Для этого уравнение Аррениуса (4.2) записывают в логарифмической форме
и записывают экспериментальные данные в координатах ln k – 1/T. Тангенс угла наклона полученной прямой равен –EA / R.
Для некоторых реакций предэкспоненциальный множитель слабо зависит от температуры. В этом случае определяют так называемую опытную энергию активации:
. (4.4)
Если предэкспоненциальный множитель – постоянный, то опытная энергия активации равна аррениусовской энергии активации: Eоп = EA.
Пример 4-1. Пользуясь уравнением Аррениуса, оцените, при каких температурах и энергиях активации справедливо правило Вант-Гоффа.
Решение. Представим правило Вант-Гоффа (4.1) как степенную зависимость константы скорости:
,
где B – постоянная величина. Сравним это выражение с уравнением Аррениуса (4.2), приняв для температурного коэффициента скорости значение
.
Возьмем натуральный логарифм обеих частей этого приближенного равенства:
.
Продифференцировав полученное соотношение по температуре, найдем искомую связь связь между энергией активации и температурой:
.
Если энергия активации и температура примерно удовлетворяют этому соотношению, то правилом Вант-Гоффа для оценки влияния температуры на скорость реакции пользоваться можно.
Пример 4-2. Реакция первого порядка при температуре 70 о С завершается на 40% за 60 мин. При какой температуре реакция завершится на 80% за 120 мин, если энергия активации равна 60 кДж/моль?
Решение. Для реакции первого порядка константа скорости выражается через степень превращения следующим образом:
,
где a = x/a – степень превращения. Запишем это уравнение при двух температурах с учетом уравнения Аррениуса:
,
где EA = 60 кДж/моль, T1 = 343 K, t1 = 60 мин, a 1 = 0.4, t2 = 120 мин, a 2 = 0.8. Поделим одно уравнение на другое и прологарифмируем:
Подставляя в это выражение приведенные выше величины, находим T2 = 333 К = 60 о С.
Пример 4-3. Скорость бактериального гидролиза мышц рыб удваивается при переходе от температуры -1.1 о С к температуре +2.2 о С. Оцените энергию активации этой реакции.
Решение. Увеличение скорости гидролиза в 2 раза обусловлено увеличением константы скорости: k2 = 2k1. Энергию активации по отношению констант скорости при двух температурах можно определить из уравнения (4.3) с T1 = t1 + 273.15 = 272.05 K, T2 = t2 + 273.15 = 275.35 K:
130800 Дж/моль = 130.8 кДж/моль.
4-1. При помощи правила Вант-Гоффа вычислите, при какой температуре реакция закончится через 15 мин, если при 20 о С на это требуется 2 ч. Температурный коэффициент скорости равен 3.(ответ)
4-2. Время полураспада вещества при 323 К равно 100 мин, а при 353 К – 15 мин. Определите температурный коэффициент скорости.(ответ)
4-3. Какой должна быть энергия активации, чтобы скорость реакции увеличивалась в 3 раза при возрастании температуры на 10 0 С а) при 300 К; б) при 1000 К?(ответ)
4-4. Реакция первого порядка имеет энергию активации 25 ккал/моль и предэкспоненциальный множитель 5 . 10 13 сек -1 . При какой температуре время полураспада для данной реакции составит: а) 1 мин; б) 30 дней?(ответ)
4-5. В каком из двух случаев константа скорости реакции увеличивается в большее число раз: при нагревании от 0 о С до 10 о С или при нагревании от 10 о С до 20 о С? Ответ обоснуйте с помощью уравнения Аррениуса.(ответ)
4-6. Энергия активации некоторой реакции в 1.5 раза больше, чем энергия активации другой реакции. При нагревании от T1 до T2 константа скорости второй реакции увеличилась в a раз. Во сколько раз увеличилась константа скорости первой реакции при нагревании от T1 до T2?(ответ)
4-7. Константа скорости сложной реакции выражается через константы скорости элементарных стадий следующим образом:
Выразите энергию активации и предэкспоненциальный множитель сложной реакции через соответствующие величины, относящиеся к элементарным стадиям.(ответ)
4-8. В необратимой реакции 1-го порядка за 20 мин при 125 о С степень превращения исходного вещества составила 60%, а при 145 o C такая же степень превращения была достигнута за 5.5 мин. Найдите константы скорости и энергию активации данной реакции .(ответ)
4-9. Реакция 1-го порядка при температуре 25 о С завершается на 30% за 30 мин. При какой температуре реакция завершится на 60% за 40 мин, если энергия активации равна 30 кДж/моль?(ответ)
4-10. Реакция 1-го порядка при температуре 25 о С завершается на 70% за 15 мин. При какой температуре реакция завершится на 50% за 15 мин, если энергия активации равна 50 кДж/моль?(ответ)
4-11. Константа скорости реакции первого порядка равна 4.02 . 10 -4 с -1 при 393 К и 1.98 . 10 -3 с -1 при 413 К. Рассчитайте предэкспоненциальный множитель для этой реакции.(ответ)
4-12. Для реакции H2 + I2 2HI константа скорости при температуре 683 К равна 0,0659 л/(моль. мин), а при температуре 716 К – 0,375 л/(моль. мин). Найдите энергию активации этой реакции и константу скорости при температуре 700 К.(ответ)
4-13. Для реакции 2N2O 2N2 + O2 константа скорости при температуре 986 К равна 6,72 л/(моль. мин), а при температуре 1165 К – 977,0 л/(моль. мин). Найдите энергию активации этой реакции и константу скорости при температуре 1053,0 К.(ответ)
4-14. Трихлорацетат-ион в ионизирующих растворителях, содержащих H + , разлагается по уравнению
H + + CCl3COO – CO2 + CHCl3
Стадией, определяющей скорость реакции, является мономолекулярный разрыв связи C- C в трихлорацетат-ионе. Реакция протекает по первому порядку, и константы скорости имеют следующие значения: k = 3.11 . 10 -4 с -1 при 90 о С, k = 7.62 . 10 -5 с -1 при 80 о С. Рассчитайте а) энергию активации, б) константу скорости при 60 о С.(ответ)
4-15. Для реакции CH3COOC2H5 + NaOH ѕ CH3COONa + C2H5OH константа скорости при температуре 282,6 К равна 2,307 л/(моль. мин), а при температуре 318,1 К – 21,65 л/(моль. мин). Найдите энергию активации этой реакции и константу скорости при температуре 343 К.(ответ)
4-16. Для реакции C12H22O11 + H2O C6H12O6 + C6H12O6 константа скорости при температуре 298,2 К равна 0,765 л/(моль. мин), а при температуре 328,2 К – 35,5 л/(моль. мин). Найдите энергию активации этой реакции и константу скорости при температуре 313,2 К.(ответ)
4-17. Вещество разлагается двумя параллельными путями с константами скорости k1 и k2. Какова разность энергий активации этих двух реакций, если при 10 o C k1/k2 = 10, а при 40 o C k1/k2 = 0.1?(ответ)
4-18. В двух реакциях одинакового порядка разница энергий активации составляет E2 – E1 = 40 кДж/моль. При температуре 293 К отношение констант скорости равно k1/k2 = 2. При какой температуре константы скорости сравняются?(ответ)
4-19. Разложение ацетондикарбоновой кислоты в водном растворе – реакция первого порядка. Измерены константы скорости этой реакции при разных температурах:
T, о С
k. 10 5 , с -1
Рассчитайте энергию активации и предэкспоненциальный множитель. Чему равен период полураспада при 25 о С? (ответ)
Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Скорость химической реакции
Скорость химической реакции – основное понятие химической кинетики, выражающее отношения количества прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции – 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд. Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.
Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное железо – железная стружка.
Химическая активность также играет важную роль. Например, отвечая на вопрос “какой из металлов Fe или Ca быстрее прореагирует с серой?” мы отдадим предпочтение кальцию, так как в ряду активности металлов он стоит левее железа, а значит кальций активнее железа.
Иного подхода требуют реакции металлов с водой, где нужно учитывать радиус атома. Например, отвечая на вопрос “какой из металлов Li или K быстрее прореагирует с водой?” мы отдадим предпочтение калию, так как калий имеет больший радиус атома. Калий будет быстрее взаимодействовать с водой, чем литий.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации “прямо пропорционально” скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при уменьшении – понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.
Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
Физический смысл константы скорости – k – в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени – a и b.
Записанное выше следствие закона действующих масс нужно не только “зазубрить”, но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?
По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?
В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: “Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет!”
Очень часто в заданиях следующей темы – химическом равновесии, вас будут пытаться запутать и ввести в заблуждение, но вы не поддавайтесь и помните про постулат!
Итак, влияние температуры на скорость реакции “прямо пропорционально”: чем выше температура, тем выше скорость реакции – чем ниже температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая “пропорция”.
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: “При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза”
В формуле, написанной выше, используются следующие обозначение:
- υ1 – скорость реакции при температуре t1
- υ2 – скорость реакции при температуре t2
- γ – температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: “Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз”.
Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) – вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов – белковых молекул, ферментов. Без катализаторов подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора – каталитическими.
Ингибитор (лат. inhibere – задерживать) – вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
Так при лечении гастрита – воспаления желудка (греч. gaster – желудок) или язв часто назначаются ингибиторы протонной помпы – химические вещества, которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка, воспаление стихает.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Скорость химической реакции
Задачи с использованием закона Вант-Гоффа
Пример 1
Как изменится скорость гомогенной реакции при повышении температуры от 67 0 до 97 0 при температурном коэффициенте, равном четырём?
Решение
Запишем формулу закона Вант-Гоффа:
.
Подставим известные данные: =4 30/10 =4 3 = 64, где t2-конечная температура (97 0 ), а t1-начальная температура (67 0 ). Следовательно при повышении температуры от 67 0 до 97 0 скорость гомогенной реакции увеличится в 64 раза.
Пример 2
Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 150 0 до 120 0 скорость реакции уменьшилась в 27 раз.
Решение
Запишем формулу закона Вант-Гоффа
и выразим из неё :
. Подставим данные = =3,
где t2=120, t1=150 (температура понижается ), а отношение конечной скорости к начальной, т. к. при уменьшении температуры скорость уменьшается.
______
СОВЕТ: помните, что значение не должно выходить за пределы 2-4
1.2.3 Задачи с использованием закона объёмных отношений
Формулировка закона: если в реакцию вступают газообразные вещества и такие же вещества образуются в результате реакции, то их обёмы относятся друг к другу как небольшие целые числа, равные стехиометрическим коэффициентам в уравнении реакции перед формулами этих веществ. Например, для гомогенной реакции aA + bB = cC + dDформула будет выглядеть следующим образом:
.
Этот закон относится к основным законам химии и может быть использован в химической кинетике применительно к концентрации.
Пример 1
Реакция идет по уравнению 2Н2(г)+O2(г)=2Н2O(г). Концентрации исходных веществ до начала реакции были [Н2]=0,06 моль/л, [O2]=0,02 моль/л. вычислите концентрации этих веществ в момент, когда [Н2O]=0,01 моль/л.
Решение
В этой реакции Н2(г) и O2(г) относятся к исходным веществам, концентрация которых с течением времени уменьшается по мере того, как эти вещества расходуются, а Н2O(г) – к продуктам реакции, концентрация которых с течением времени увеличивается по мере того, как эти вещества образуются. Из закона объёмных отношений следует, что один объём О2 взаимодействует с двумя объёмами Н2и при этом образуется два объёма Н2O, т. е. если получается 0,01 моль/л Н2O, то расходуется столько же Н2 и в два раза меньше О2. В виде формулы это можно записать следующим образом:
: отсюда x=0,01 моль/л,
где обр-образованное и изр-израсходованное;
: отсюда x=0,005 моль/л.
Таким образом концентрации этих веществ в момент, когда [Н2O]=0,01 моль/л будет равна: [H2]=[H2]нач-[H2]изр=0,06-0,01=0,05моль/л и [O2]=[O2]нач-[O2]изр=0,02-0,005=0,015 моль/л (где нач- начальная концентрация веществ).
Пример 2
До начала реакции концентрации исходных веществ в гомогенной системе K+2L=3M+Fбыли равны: [K]=0,5 моль/л, [L]=0,12 моль/л. Найдите концентрации всех веществ на тот момент времени, когда концентрация Lуменьшилась в три раза.
Решение
При уменьшении концентрации Lв три раза, на данный момент времени она будет равна [L] = [L]нач / 3 = 0,12 / 3 =0,4 моль/л. Следовательно, в ходе реакции израсходовалось некоторое количество вещества L:[L]изр = [L]нач-[L] = 0,12 – 0,4 = 0,8 моль/л. В случае определения концентрации вещества К следует помнить, что вещество Lне расходуется само по себе, а вступает в реакцию с К в соотношении 2 к 1,т. е. , отсюда х = 0,4 моль/л.
Значит, на данный момент времени концентрация вещества Кбудет равна [К] = [К]нач – [К]изр = 0,5 – 0,4.= 0,1 моль/л. Также по закону объёмных отношений можно найти и концентрации образованных веществ MиF:
, отсюда х = 0,12 моль/л.
Концентрацию вещества F можно найти таким же образом по концентрации K или L, а можно и полученной концентрации М:
, отсюда х = 0,4 моль/л
Поскольку не были даны исходные концентрации этих веществ, то мы можем считать, что начальная концентрация продуктов реакции равна нулю. Следовательно, на тот момент времени, когда концентрация Lуменьшилась в три раза, концентрации других веществ будут равны: [К] = 0,1 моль/л;[M] = 0,12 моль/л; [F] =0,4 моль/л.
______
СОВЕТ: в формулу закона необходимо подставлять не начальные или конечные концентрации для исходных веществ, а именно израсходованные, прореагировавшие.
2 Химическое равновесие
В химических реакциях исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов реакции могут создаваться условия для протекания обратимой реакции в противоположном направлении. Например, если смешать пары иода с водородом при температуре 200°С, то произойдет реакция:
Однако известно, что йодистый водород уже при нагревании до 180 °С начинает разлагаться на иод и водород:
.
Понятно, что в этих условиях не произойдет ни полного разложения НI, так как продукты реакции способны вновь реагировать между собой, ни полного образования йодистого водорода.
Основные понятия и законы
Обратимаяхимическая реакция – это реакция, в ходе которой происходят превращения как в прямом, так и в обратном направлениях, Первым, кто четко сформулировал представление об обратимости химических реакций, был К.Бертолле (1799). Участвуя в Египетской экспедиции Бонапарта, он обратил внимание на образование карбоната натрия в соляных озерах и пришел к заключению, что карбонат натрия образуется в результате взаимодействия между насыщенным раствором хлорида натрия и растворенным карбонатом кальция. Этот процесс обратен проводимой в лаборатории реакции между карбонатом натрия и растворенным хлоридом кальция с образованием карбоната кальция.
При написании уравнений обратимых реакций вместо знака равенства ставят две противоположно направленные стрелки. Уравнение рассмотренной выше обратимой реакции запишется следующим образом:
Реакцию, протекающую слева направо, называют прямой (константа скорости прямой реакции k1), справа налево — обратной (константа скорости обратной реакции k2).
В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ, расходуемых на образование продуктов реакции. И наоборот, обратная реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной — увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакций становятся равными.
Рисунок 4 – График изменения скоростей прямой и обратной реакций во времени 1
V V1– скорость прямой реакции
V2– скорость обратной реакции
Рисунок 5 – График изменения скоростей прямой и обратной реакций во времени 2
Химическое равновесие – состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются. Положение равновесия можно определить, зная скорости прямой и обратной реакций. Уравнение обратимой реакции имеет вид
согласно закону действующих масс, скорости прямой реакции u1 и обратной u2 соответственно запишутся следующим образом:
В равновесии скорости прямой и обратной реакций равны:
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций. Преобразуем эту формулу и получим:
.
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции, т. е. численное значение константы равновесия характеризует тенденцию к осуществлению реакции или, другими словами, характеризует выход данной реакции. Так, при К >> 1 выход реакции велик (равновесие смещено в сторону прямой реакции ), так как при этом
[spoiler title=”источники:”]
http://studarium.ru/article/155
http://lektsii.org/5-34914.html
[/spoiler]