ФЕДЕРАЛЬНОЕ АГЕНТСТВО
ПО ОБРАЗОВАНИЮ
СЕВЕРСКИЙ ТЕХНОЛОГИЧЕСКИЙ
ИНСТИТУТ
Федерального
государственного бюджетного
образовательного учреждения
высшего профессионального
образования
«Национальный
исследовательский ядерный университет
«МИФИ»
Кафедра ХиТМСЭ
Лабораторная работа
№1
Теплота растворения соли
Практическое руководство
к выполнению лабораторной работы
Проверил :
Т.В. Смолкина___________
Выполнил :
Малышев К.А____________
Северск 2012
1 Теоретические основы работы и описание установки
Цель работы: ознакомление
с термохимическими измерениями,
экспериментальное определение теплоты
растворения исследуемой соли.
Любая химическая
реакция и любое физико-химическое
превращение (например, плавление,
конденсация, растворение, кристаллизация)
сопровождается выделением или поглощением
теплоты ‑ тепловым
эффектом. Если
теплота выделяется – процесс называется
экзотермическим,
тепловой эффект имеет знак «минус».
Если теплота поглощается – процесс
называется эндотермическим,
тепловой эффект имеет знак «плюс».
Количество теплоты, выделившейся или
поглотившейся при растворении 1 г
вещества, обозначают ΔHраств
и называют удельной
теплотой растворения, Дж/г.
Количество теплоты, выделившееся или
поглотившееся при растворении заданной
массы вещества m, обозначают Qраств
и называют теплотой
растворения, Дж:
![]()
(1)
При растворении веществ
теплота может как выделяться (например,
при растворении NaOH),
так и поглощаться (например, при
растворении CaCl2).
Это происходит потому, что при растворении
твердых веществ протекают два процесса
(рисунок 1).
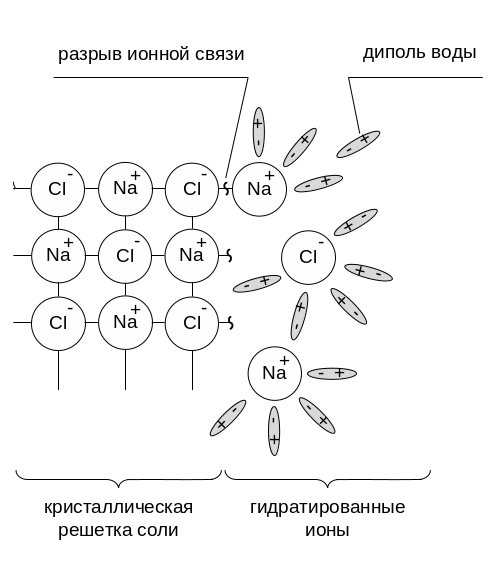
Рисунок 1 – Схема
процесса растворения соли
Первый процесс ‑
гидратация ионов: к ионам соли под
действием поля электростатических сил
притягиваются молекулы воды, представляющие
собой диполи, и ориентируются по отношению
к иону противоположно заряженным
полюсом. Этот процесс сопровождается
высвобождением энергии, которая
выделяется в окружающую среду в виде
теплоты:
![]()
0.
Второй процесс ‑ разрушение
кристаллической решетки и отрыв от нее
ионов. Для протекания этого процесса
требуется затратить некоторое количество
энергии, которое система поглощает из
окружающей среды: теплота разрушения
кристаллической решетки
![]()
0.
Таким образом, тепловой эффект растворения
соли представляет собой сумму тепловых
эффектов вышеописанных процессов:
![]()
,
его знак зависит от природы растворяемого
вещества.
Величину теплового
эффекта измеряют с помощью специального
прибора – калориметра,
представленного на рисунке 1.
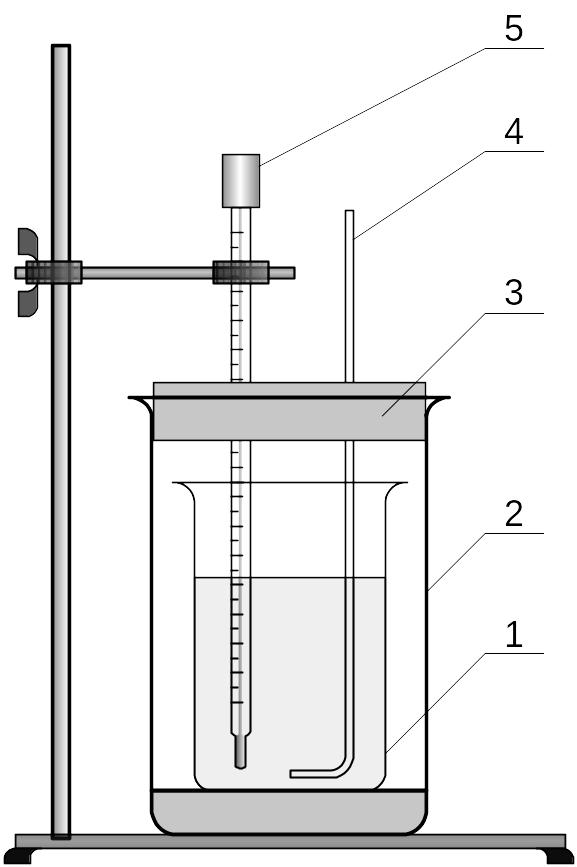
Рисунок 2 – Калориметр
для определения теплового эффекта
растворения
Калориметр состоит из
сосуда 1, в котором проводят процесс
растворения, и защитной оболочки 2,
уменьшающей тепловое взаимодействие
сосуда и раствора с окружающей средой.
Для определения тепловых эффектов при
температуре от – 20 ° до + 50 °
применяют калориметр с воздушной
изотермической оболочкой. В крышке
калориметра 3 имеются отверстия, в
которые вставляют стеклянную мешалку
4 и термометр Бекмана 5, позволяющий
измерить изменения температуры (но не
температуру) с точностью до 0,01°С.
Теплота, выделяющаяся
при растворении соли, передается
составным частям калориметрической
системы: полученному раствору, стакану,
мешалке, термометру, крышке калориметра
и т.д. Если при растворении соли теплота
поглощается, то она отнимается у составных
частей калориметрической системы. При
этом температура калориметрической
системы (tкон)
меняется. На основании этого можно
записать уравнение теплового баланса,
согласно которому общее количество
теплоты в изолированной системе (к
которой приближается калориметр)
остается постоянным:
Qраств
= (m1с1
+m2с2
+m3с3
+ …)(tкон
–tнач
), (2)
где Qраств
– теплота процесса
растворения соли, Дж;
m1
– масса раствора, г;
с1
– теплоёмкость раствора, Дж/г;
m2
– масса сосуда, г;
с2
– теплоёмкость сосуда, Дж/г;
m3–
масса мешалки, г;
с3
– теплоёмкость мешалки, Дж/г и т.д.;
(tкон
– tнач)
– изменение температуры, град.
Так как все измерения
проводятся в одном и том же калориметре,
величины m2,
m3
и т.д., а также с2,
с3
и т.д. остаются постоянными во всех
опытах. Обозначим выражение
(m2с2
+ m3с3
+ …)
= K. (3)
Величина K называется
теплоёмкостью калориметрической системы
или постоянной
калориметра. Она
указывает количество теплоты, которое
необходимо сообщить участвующим в
теплообмене частям калориметра, чтобы
повысить их температуру на один градус.
Для определения K
проводится
дополнительный опыт, в котором определяют
изменение температуры при растворении
какой-либо соли, тепловой эффект
растворения которой заранее известен.
Обычно в качестве такой соли используют
KCl.
Для дополнительного опыта уравнение
(2) с учетом уравнения (1) запишется так:
![]()
, (4)
где
![]()
– количество теплоты, выделившейся или
поглотившейся в ходе растворения
KCl
массой mKCl,
Дж;
mKCl
– масса растворенного KCl,
г;
![]()
– теплота растворения
KCl.
= 252,7 Дж/г;
m1 = (mH2O + mKCl)
– масса раствора, г;
с1
– теплоемкость раствора. Для всех
растворов, получаемых в данной работе,
с1 = 4,1 Дж/(г∙К);
K
– постоянная калориметра, Дж/К;
ΔtKCl
– изменение температуры в процессе
растворения KCl,
град (определяется по графику).
Из уравнения (4) находят
K:
![]()
(5)
Для экспериментального
определения теплоты растворения
исследуемой соли растворяют определенное
количество соли в определенном количестве
воды и фиксируют изменение температуры,
сопровождающее растворение соли.
Действительное изменение температуры
определяют графическим методом. Теплоту
растворения исследуемой соли
![]()
рассчитывают по уравнению:
![]()
,
(5)
где Δtсоли
– изменение температуры в процессе
растворения исследуемой соли, град
(определяется по графику);
mсоли
– масса растворенной соли, г.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
ТЕРМОХИМИЯ. ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ РАСТВОРЕНИЕ СОЛЕЙ В ВОДЕ
- Авторы
- Файлы работы
- Сертификаты
Архипкин Д.А. 1
1Государственный социально-гуманитарный университет
Комментарии
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке “Файлы работы” в формате PDF
Экспериментальная часть
Измерение интегральной теплоты растворения соли в воде.
Задача:
Измерить интегральную теплоту растворения солей (Na2CO3∙10H2O, ZnSO4∙7H2O, Na2CO3,
ZnSO4)
в воде.
Посуда
и оборудование:
1-
калориметрический стакан;
2
– изотермическая оболочка;
3
– подставка;
4
– крышка;
5
– магнитная мешалка;
6
– термометр;
7
– лапка;
8
– штатив;
9
– пипетка для соли
Реактивы:
1- Na2CO3∙10H2O;
2- Na2CO3;
3- ZnSO4∙7H2O;
4-
ZnSO4
Интегральная теплота
растворения соли – количество теплоты, выделяющейся или поглощаемой при
растворении 1 моля соли в такой массе растворителя, чтобы получился раствор
определенной концентрации.
1. Наполняют калориметрический стакан
взвешенным количеством дистиллированной воды.
2. Взвешивают в пробирке такую навеску
тщательно измельченной соли (mсоли), чтобы концентрация раствора после
растворения навески составила 1 моль соли в 400 молях воды для Na2CO3∙10H2O и Na2CO3
и 1 моль соли в 500 молях воды для ZnSO4∙7H2O и ZnSO4
. Пробирку с солью выдерживают в стакане с водой около 15 минут, чтобы соль
приобрела температуру воды.
3. Включают мешалку, погружают термометр в
воду, налитую в калориметрический стакан. После установления постоянной
температуры проводят 10 измерений через каждые 30 с. При одиннадцатом измерении
быстро высыпают соль в воду через предварительно взвешенную воронку (по
разности масс воронки после опыта и до опыта можно рассчитать массу соли,
оставшейся при внесении соли в калориметр, и учесть ее при вычислении точной
массы соли, растворенной в калориметрической жидкости).
4. Наблюдают за изменением температуры, вызванным
процессом растворения. После установления постоянной температуры проводят еще
10 измерений через каждые 30 с.
5. Строят график в координатах температура
– время, проводят касательные в точках перегиба и определяют изменение
температуры (∆Т), вызванное растворением соли. Интегральную теплоту растворения
вычисляют по формуле :
∆Н = Ск*∆Т *М/ mсоли (1)
Относительную
ошибку измерения рассчитывают по формуле :
ε=|∆Нпр – ∆Нтеор|/∆Нтеор.
(2)
Табличные
данные для интегральных теплот растворения солей, образующих кристаллогидраты,
приведены в таблице 2 для температуры 25 °C.
[4].
Таблица
2. Литературные данные по интегральной теплоте растворения
|
Вещество |
Число |
-ΔHm, |
|
Na2CO3 |
400 |
23,43 |
|
Na2CO3·10H2O |
400 |
-69,04 |
|
ZnSO4 |
500 |
77,28 |
|
ZnSO4·7H2O |
500 |
-18,87 |
3.2. Экспериментальные данные и их
обработка
Расчет
постоянной калориметрической установки Ск
Тепловой
эффект с допускаемой погрешностью в несколько процентов, Ск можно
вычислить суммированием теплоемкостей калориметрической жидкости и всех
соприкасающихся с ней частей калориметра:
m(H2O)=150,00
г
Сp(H2O)=4,1796 Дж/(г*К)
mстакана=111,26
г
Cp(стакана)=0,791
Дж/(г*К)
m(мешалки)=2,03
г
Cp(меш)=0,48
Дж/(г*К)
Так
как стекло и ртуть обладают близкими объемными удельными теплоемкостями 1,966 и
1,883 Дж/(см3 • К), то теплоемкость термометра вычисляют умножением
погружаемого в калориметрическую жидкость объема термометра на среднюю объемную
теплоемкость 1,925 Дж/(см3 • К). Погружаемый объем измеряют в мерном цилиндре.
Относительная погрешность определения теплоемкости термометра составляет
несколько процентов, но вклад ее в Ск незначителен.
Vтерм=
1 см3
Cp(терм)=
1,925 Дж/(г*К)
Ск=723,62
Дж/К
3.3. Определение теплоты
растворения Na2CO3.
Исходные
навески: m(Na2CO3)=
2,12 г
; m(H2O)= 144г.
Таблица
3.3. Зависимость температуры от времени.
|
t(мин) |
0 |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
3,5 |
4,0 |
4,5 |
|
T(⁰C) |
25,1 |
25,1 |
25,1 |
25,1 |
25,1 |
25,1 |
25,1 |
25,1 |
25,1 |
25,1 |
Изменение
температуры воды
|
t(мин) |
5,0 |
5,5 |
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
9,5 |
|
T(⁰C) |
25,8 |
25,8 |
25,8 |
25,8 |
25,8 |
25,8 |
25,8 |
25,7 |
25,7 |
25,7 |
Изменение
температуры после добавления соли (Na2CO3)
∆T=25,8-25,1= 0,7 ⁰С По формуле 1 найдем интегральную теплоту
растворения: ∆Н = Ск*∆Т *М/ mсоли
-∆H(Na2CO3)=
25,33 кДж/моль
По
формуле 2 найдем относительную погрешность: ε=|∆Нпр – ∆Нтеор|/∆Нтеор
Теоретические
значения из работы [4].
-∆H(Na2CO3)теор=
23,43 кДж/моль
ɛ=
8,11%
Рис.3.
Графическое определение изменения температуры в ходе калориметрического опыта
при измерении экзотермического эффекта.
3.4.
Определение теплоты растворения Na2CO3∙10H2O.
m(Na2CO3∙10H2O)=
3,9 г; m(H2O)= 144г.
Таблица
3.4. Зависимость температуры от времени.
|
t(мин) |
0 |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
3,5 |
4,0 |
4,5 |
|
T(⁰C) |
25,5 |
25,5 |
25,5 |
25,5 |
25,5 |
25,5 |
25,5 |
25,5 |
25,5 |
25,5 |
Изменение
температуры воды
|
t(мин) |
5,0 |
5,5 |
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
9,5 |
|
T(⁰C) |
25,0 |
24,3 |
24,3 |
24,3 |
24,3 |
24,3 |
24,3 |
24,3 |
24,3 |
24,3 |
Изменение
температуры после добавления соли (Na2CO3∙10H2O)
∆T=-25,5+24,3=-1,2 ⁰С По формуле 1 найдем интегральную теплоту
растворения: ∆Н = Ск*∆Т *М/ mсоли
-∆H(Na2CO3∙10H2O)= -63,68 кДж/моль
По
формуле 2 найдем относительную погрешность: ε=|∆Нпр – ∆Нтеор|/∆Нтеор
Теоретические
значения из работы [4].
-∆H(Na2CO3∙10H2O)теор= -69,04 кДж/моль
ɛ=
7,76%.
Рис.
4. Графическое определение изменения температуры в ходе калориметрического
опыта при измерении эндотермического эффекта.
3.5.
Определение теплоты растворения ZnSO4.
m(ZnSO4)= 2,12 г; m(H2O)= 112,5 г.
Таблица
3.5. Зависимость температуры от времени.
|
t(мин) |
0 |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
3,5 |
4,0 |
4,5 |
|
T(⁰C) |
25,1 |
25,1 |
25,1 |
25,1 |
25,1 |
25,1 |
25,1 |
25,1 |
25,1 |
25,1 |
Изменение
температуры воды
|
t(мин) |
5,0 |
5,5 |
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
9,5 |
|
T(⁰C) |
25,9 |
26,5 |
26,6 |
26,5 |
26,5 |
26,4 |
26,4 |
26,4 |
26,4 |
26,4 |
Изменение
температуры после добавления соли (ZnSO4)
∆T=26,4-25,1=1,3 ⁰С По формуле 1 найдем интегральную теплоту
растворения: ∆Н = Ск*∆Т *М/ mсоли
-∆H(ZnSO4)=
71,65 кДж/моль
По
формуле 2 найдем относительную погрешность: ε=|∆Нпр – ∆Нтеор|/∆Нтеор
Теоретические
значения из работы [4].
-∆H(ZnSO4)теор=
77,28 кДж/моль
ɛ=7,29
%.
Рис.5.
Графическое определение изменения температуры в ходе калориметрического опыта
при измерении экзотермического эффекта.
3.6.
Определение теплоты растворения ZnSO4·7H2O.
m(ZnSO4·7H2O)=
3,59 г; m(H2O)= 112,5 г
Таблица
3.6. Зависимость температуры от времени.
|
t(мин) |
0 |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
3,5 |
4,0 |
4,5 |
|
T(⁰C) |
25,2 |
25,2 |
25,2 |
25,2 |
25,2 |
25,2 |
25,2 |
25,2 |
25,2 |
25,2 |
Изменение
температуры воды
|
t(мин) |
5,0 |
5,5 |
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
9,5 |
|
T(⁰C) |
25,0 |
25,0 |
24,9 |
24,9 |
24,9 |
24,9 |
24,9 |
24,9 |
25,0 |
25,0 |
Изменение
температуры после добавления соли (ZnSO4·7H2O)
∆T= -25,2+24,9= -0,3⁰С По формуле 1 найдем интегральную теплоту
растворения: ∆Н = Ск*∆Т *М/ mсоли
-∆H(ZnSO4·7H2O)=
-17,39 кДж/моль
По
формуле 2 найдем относительную погрешность: ε=|∆Нпр – ∆Нтеор|/∆Нтеор
Теоретические
значения из работы [4].
-∆H(ZnSO4·7H2O)теор=
-18,87 кДж/моль
ɛ=
7,84 %.
Рис.
6. Графическое определение изменения температуры в ходе калориметрического
опыта при измерении эндотермического эффекта.
Просмотров работы: 1455
Код для цитирования:
Предложите, как улучшить StudyLib
(Для жалоб на нарушения авторских прав, используйте
другую форму
)
Ваш е-мэйл
Заполните, если хотите получить ответ
Оцените наш проект
1
2
3
4
5
