Под
термодинамической
вероятностью
понимается число
микросостояний
(микрораспределений, например,
распределений молекул по пространству
или энергии) которыми может определяться
рассматриваемое макрораспределение.
|
|
Пример. |
|
Рис. 15.5 |
3-я и 4-я – в первой
и т.д. ( рис. 15.5).
Число
распределений можно подсчитать следующим
образом:
-
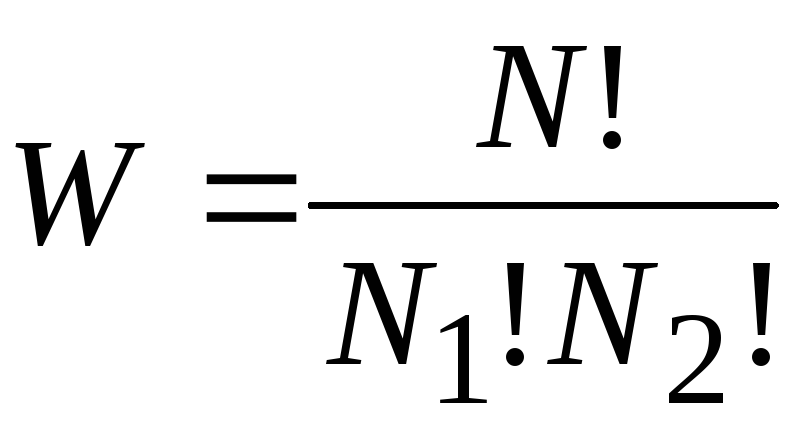 ,
,
где
![]() общее число молекул,
общее число молекул,![]() число молекул в 1 – ой части сосуда,
число молекул в 1 – ой части сосуда,![]() во второй. Термодинамическая вероятность
во второй. Термодинамическая вероятность
в рассматриваемом примере.
![]()
Аналогично
для распределения
![]() :
:
![]() .
.
Для
![]() .
.
Заметим,
что наибольшая
термодинамическая вероятность у
равномерного распределения,
оно может осуществляться наибольшим
числом способов.
Связь
энтропии с вероятностью
была установлена Больцманом,
постулировавшим, что энтропия
пропорциональна логарифму вероятности
состояния
|
|
(энтропия определяется
с точностью до константы
const),
где
![]() константа Больцмана,
константа Больцмана,![]() термодинамическая вероятность.
термодинамическая вероятность.
Второе
начало термодинамики и его статистическое
толкование
-
Формулировка
Больцмана:
Все
процессы в природе протекают в
направлении, приводящим к увеличению
вероятности состояния.
-
Формулировка
Клаузиуса:
Невозможны
такие процессы, единственным конечным
результатом которых был бы переход
тепла от тела менее нагретого, к телу
более нагретому.
С
точки зрения формулировки Больцмана
переход от холодного тела к нагретому
принципиально возможен,
но маловероятен.
Пример.
Пользуясь формулой Больцмана, вычислим
по изменению энтропии 2-х тел, находящихся
при температурах 301 К и 300 К соответственно,
отношение вероятности пребывания тел
в этих состояниях , если от одного тела
к другому передаётся количество теплоты
в
![]() .
.
Обозначим вероятность пребывания при
температуре 300 К![]() ,
,
301 К![]() .
.
![]() ,
,
![]() ,
,
отсюда
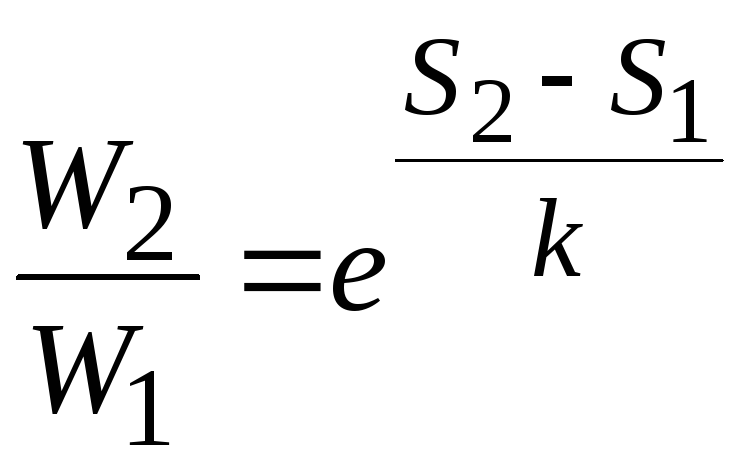 .
.
Ввиду
малости передаваемой энергии разность
![]() можно оценить используя соотношение:
можно оценить используя соотношение:![]() .
.
![]() ,
,
тогда
![]()
Это
означает, что на каждый
![]() случаев переходов
случаев переходов![]() от тела с температурой 301 К к телу с
от тела с температурой 301 К к телу с
температурой 300 К может произойти один
случай перехода того же количества
теплоты от тела с температурой 300 К к
телу с температурой 301 К. (Заметим, что
для совсем малого количества теплоты![]() вероятности
вероятности
становится сравнимыми и для таких
случаев второе начало применить уже
нельзя.).
Вообще
же, говоря если в системе имеется
многовариантность путей, процессов,
то, рассчитав
энтропию конечных состояний, можно
теоретически определить вероятность
того или иного пути, процесса,
не производя их реально и в этом важное
практическое применение формулы,
связывающей термодинамическую вероятность
с энтропией.
Вопросы для
самоконтроля
-
Чем
отличается обратимый процесс от
необратимого? От обратного? -
Охарактеризуйте
равновесное состояние. Можно ли
реализовать равновесный процесс? -
Что такое цикл?
-
При
каких условиях должна работать идеальная
машина Карно? -
Из каких процессов
состоит цикл Карно? -
Почему
в выражении для работы за цикл идеальной
машины Карно не входит работа, совершенная
при адиабатных процессах? -
Чему
равен КПД идеальной машины Карно? Что
характеризуют температуры
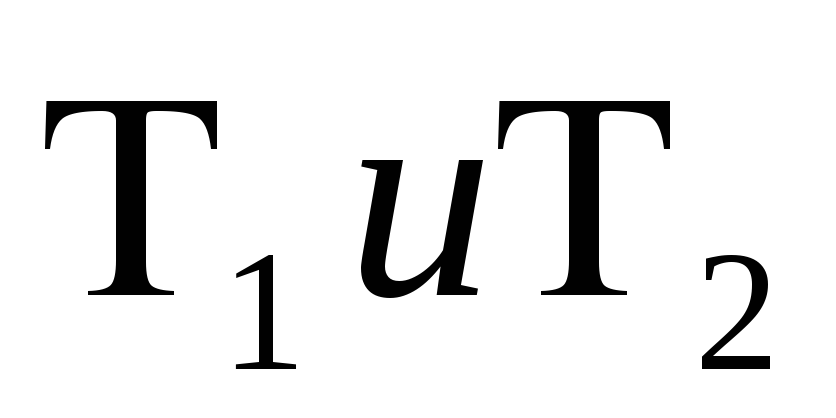 в формуле для идеальной машины Карно?
в формуле для идеальной машины Карно? -
Как работают
холодильная машины и тепловой насос? -
Что такое энтропия?
-
Чему
равно приращение энтропии
 при протекании обратимого процесса?
при протекании обратимого процесса? -
Как
изменяется энтропия при протекании
необратимого процесса в адиабатически
изолированной системе? -
Что такое
термодинамическая вероятность? -
Как связана
энтропия с термодинамической вероятностью? -
Сформулируйте
2-ое начало термодинамики.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Сергей Феликсович Савельев
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Определение 1
Вероятность термодинамическая — количество методов, благодаря которым возможно реализовать любое состояние макроскопической физической системы.
Рисунок 1. Энтропия и вероятность. Автор24 — интернет-биржа студенческих работ
В термодинамике положение концепции характеризуется конкретными значениями плотности, температуры, давлением и другими измеряемыми величинами. Перечисленные параметры определяют дальнейшее состояние системы в целом, но при одной и той же плотности, элементарные частицы могут располагаться в различных местах её объёма и иметь совершенно разные значения импульса или энергии.
Определение 2
Каждое состояние термодинамической системы с определенным разделением её частиц по вероятным квантовым или классическим положениям называют в физике микросостоянием.
Вероятность термодинамическая приравнивается количеству микросостояний, которые реализуют существующее макросостояние. Такой процесс не является вероятностью в математическом аспекте, следовательно, используется в статистической физике для определения свойств концепции, находящейся в термодинамическом, постоянном равновесии.
Для точного расчёта вероятности в термодинамике существенно, считаются ли одинаковые элементы системы неразличимыми или различными. Поэтому квантовая и классическая механика приводят к абсолютно разным выражениям для термодинамической вероятности.
Особенности вероятности в термодинамике
Рисунок 2. Термодинамическая вероятность. Автор24 — интернет-биржа студенческих работ
«Вероятность в термодинамике» 👇
Замечание 1
Основное достоинство термодинамики заключается в том, что она помогает рассмотреть общие свойства концепции при равновесии и общие закономерности определения плотности, получить важные сведения о самом веществе, не зная в полной мере его начальную внутреннюю структуру.
Ее законы и методы применимы к любому материальному телу, к любым системам, которые включают магнитные и электрические поля, поэтому они стали основами в таких сферах:
- газовых и конденсированных сред;
- химии и техники;
- необходимыми в физике Вселенной и геофизике;
- биологии и управлений физическими процессами.
Исследователь Больцман считал атомистическую теорию вполне обоснованной. Бесконечное или огромное количество частиц делает невозможным механический эффект, нуждается в статистическом описании. Математическим инструментом современной статистики является исчисление и определение вероятностей. Больцман доказал, что поскольку базой термодинамических процессов выступают кинетические обратимые процессы, то необратимость в измеряемой термодинамикой энтропии, не может быть на практике абсолютной. Поэтому и энтропия должна быть непосредственно связана с возможностью осуществления данного микросостояния.
Понятие вероятности, неявно применяемого Максвеллом, Больцман использовал для преодоления трудностей, имеющих отношение к пониманию второго начала термодинамики и теории «тепловой смерти Вселенной». Вершиной научной работы Больцмана стало установление взаимосвязи между термодинамической вероятностью и энтропией. Планк представил эту связь через введение константы $k = R / N$, которая носит название постоянной Больцмана.
Таким образом, необратимый физический процесс есть плавный переход из менее вероятного положения в более вероятное, а логарифм изменения начального состояния с точностью до стабильного множителя полностью совпадает с перемещением энтропии. Этот эффект Больцман использовал для идеального газа.
Чем выше уровень беспорядка в скоростях и координатах частиц системы, тем больше возможность того, что концепция будет в состоянии хаоса. Формула Больцмана может рассматриваться как основное определение энтропии.
Расчет вероятности в системах
Рисунок 3. Расчет вероятности. Автор24 — интернет-биржа студенческих работ
В случае, если система очень большая, а исходное положение ее не слишком близко к состоянию равновесия, то переходы веществ в менее вероятные состояния будут практически невозможны, что на практике они не имеют совершенно никакого значении. Тогда закон увеличения энтропии оправдывается экспериментально с абсолютной достоверностью.
Рассчитаем точную вероятность таких физических процессов. Пусть в определенном сосуде находится всего одна молекула. Тогда, в случае отсутствия внешних силовых полей, элементарная частица с равной вероятностью может оказаться либо в часть 1, либо в часть 2. Вероятности такого попадании одинаковые и записываются так:
После того, как в сосуд попадает вторая молекулу, их попадания будут всегда независимыми состояниями, так как элементы идеального газа не взаимодействуют между собой. В случае, если в течение длительного времени фотографировать распределение атомов в сосуде через равные промежуточные положения, то на каждые 1000 кадров придется в среднем примерно один кадр, на котором будут зафиксированы все молекулы только в части сосуда 1. Аналогичное явление можно наблюдать в части 2.
По гипотезе сложения вероятностей, получится в среднем 2 кадра на каждую тысячу с элементарными частицами, сосредоточенными в любой части системы. Все это не только принципиально вполне возможно, но и фактически доступно обычному наблюдению. Практически нет никаких шансов зафиксировать соответствующую флуктуацию. При равном количеству Авогадро показателю температуры для соответствующей вероятности получается настолько малая величина, что с такого рода возможностями и соответствующими им условиям можно совершенно не считаться.
Различие термодинамической и математической систем
На сегодняшний день ученые разделяют две основные вероятности в термодинамике:
- математическую;
- термодинамическую.
Термодинамической вероятностью называется определенной число микросостояний, посредством которых можно провести необходимое макросостояние концепции. Чтобы найти термодинамическую вероятность ее начального состояния, следует подсчитать количество комбинаций, которые помогут осуществить любое пространственное распределение элементарных частиц.
Замечание 2
Этот параметр определяется числом перестановок из наличного движения частиц.
Математическая вероятность состояния равна отношению термодинамической возможности к общей величине возможных микросостояний. Математическая вероятность всегда меньше одной единицы, между тем как вероятность в термодинамике выражается большими числами. Вероятность в математике не аддитивна и непосредственно связана не с термическими особенностями системы, а с механическими, например, с движением молекул в среде и их скоростью.
Одному и тому макросостоянию может соответствовать множество второстепенных микросостояний. По Л. Больцману, чем большим числом таких положений может реализоваться конкретное макросостояние, тем оно на практике более вероятно. Термодинамической вероятностью состоянию концепции называется число микросостояний, реализующих в итоге макросостояние.
При пользовании указанных способов необходимо иметь в виду, что основанные на ней выводы считаются наиболее вероятными только в термодинамическом вопросе, и указывают только на возможность или невозможность того или иного физического процесса. В реальных условиях не исключены незначительные отклонения от сделанных выводов, и протекающие явления могут при отдельных обстоятельствах быть иными, чем те, которые действовали исходя из общих термодинамических соображений.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
- Особенности вероятности в термодинамике
- Расчет вероятности в системах
- Отличие термодинамической и математической систем
Определение 1
Термодинамическая вероятность является числом методик, с помощью которых может быть осуществлена реализация состояния макроскопической физической структуры.

Рисунок 1. Энтропия и вероятность.
В термодинамике макроскопическое состояние физической структуры квалифицируется определенными величинами плотности, давления, температурными показателями и прочими измеримыми макроскопическими величинами. Вышеуказанные показатели устанавливают последующее состояние структуры целиком, однако при одной и той же плотности, элементы могут находиться в разных местах ее объема и обладать совсем различными величинами импульса либо энергии.
Определение 2
Любое состояние термодинамической структуры с некоторым разделением ее элементов по вероятным квантовым либо традиционным положениям именуют в физике микроскопическим состоянием.
Термодинамическая вероятность равняется числу микроскопических состояний, реализующие действующее макроскопическое состояние. Данное явление не считается вероятностью в математическом понимании, поэтому применяется в статистической физике для установления характеристик системы, которая находится в термодинамическом, стабильном равновесии.
Для правильного расчета вероятности в термодинамике значимо, являются ли одинаковые компоненты структуры неразличимыми либо различимыми. По данной причине квантовая и традиционная механика порождает к полностью различным выражениям для термодинамической вероятности.
Особенности вероятности в термодинамике

Рисунок 2. Термодинамическая вероятность.
Замечание 1
Ключевым преимуществом термодинамики является то, что она осуществляет помощь в рассмотрении всеобщих свойств системы при равновесии. А также рассматривает всеобщие закономерности определения плотности, получает важнейшую информацию об объекте, не зная полностью его изначальный состав изнутри.
Законы и методики термодинамики используемы ко всем физическим объектам, к любым системам, включающим электрические и магнитные поля. По данной причине эти законы и методики стали базовым основанием, и важными в следующих областях:
- Газовых и конденсированных сред.
- Химии и техники.
- Физике Вселенной и геофизике.
- Биологии и управлений физическими процессами.
Австрийский физик-теоретик, основатель статистической механики и молекулярно-кинетической теории, Людвиг Больцман рассматривал атомистическую теорию полностью доказанной и подтвержденной. Бесконечно большое количество элементов делает немыслимым механический эффект, и требует статистического описания.
Математическим инструментарием нынешней статистики считается расчет и установление вероятностей. Людвиг Больцман подтвердил, что так как основой термодинамических явлений являются кинетические обратимые процессы, то невозвратимость в определяемой термодинамикой энтропии, не имеет возможности быть практически абсолютной.

Не нашли то, что искали?
Попробуйте обратиться за помощью к преподавателям
По данной причине, и энтропия обязана быть напрямую взаимосвязана с вероятностью реализации этого микроскопического состояния. Понятие вероятности, косвенно используемого шотландским физиком, математиком и механиком Джеймсом Клерком Максвеллом, Людвиг Больцман применял для форсирования затруднений, которые имели отношение к восприятию второго начала термодинамики и теории «тепловой смерти Вселенной». Пиком научных трудов Людвига Больцмана было становление взаимной связи меж термодинамической вероятностью и энтропией.
Немецкий физик-теоретик, основоположник квантовой физики Макс Карл Эрнст Людвиг Планк определил данную взаимосвязь введение постоянной ( k=frac{R}{N}), которая именуется постоянной Больцмана. Следовательно, необратимый физический процесс является плавным преобразованием из менее вероятного положения в более вероятное. В свою очередь, логарифм преобразования первоначального состояния с точностью до стабильного множителя в полной мере согласовывается с передвижением энтропии.
Данный эффект Людвиг Больцман применил для идеального газа. Чем больше степень хаотичности в скоростях и координатах, тем выше вероятность того, что система находится в хаотическом состоянии. Уравнение Больцмана возможно рассматривать, как базовую формулировку энтропии.
Расчет вероятности в системах

Рисунок 3. Расчет вероятности.
В ситуации, когда система довольно большая, а начальное ее расположение является не очень близким к равновесному состоянию, тогда преобразования веществ в менее возможные состояния на практике станут недопустимы, и не имеют абсолютно никакой ценности. Таким образом закон увеличения энтропии подтверждается экспериментальным путем с полной достоверностью. Произведем расчет точной вероятности данных физических явлений.
Допустим, что в некоторой емкости располагается всего лишь одна молекула. Таким образом, в ситуации, когда отсутствуют силовые поля извне, молекулу с одинаковой вероятностью возможно обнаружить или в части 1, или в части 2. Вероятности данного обнаружения одного порядка и описываются следующим образом: после попадания в емкость второй молекулы, присутствие обеих молекул в емкости постоянно будет не взаимосвязанными состояниями, поскольку частицы идеального газа не действуют взаимно друг с другом.
В ситуации, когда в продолжительном промежутке фиксировать распределение атомов в емкости через равномерные интервальные расположения, тогда, на каждые тысячу фиксаций окажется усреднено около одной фиксации, на которой фиксируются все молекулы исключительно в части емкости 1. Примерно такой же процесс возможно зафиксировать в части емкости 2. По идее суммирования вероятностей, выйдет усреднено две фиксации на каждую тысячу раз с элементами, которые сосредоточены в любой части структуры.
Данное не лишь в полной мере возможно, а также практически общедоступно обыкновенному наблюдению. Фактически не существует возможности фиксации соответственной флуктуации. Для соответственной вероятности выходит такое маленькое значение, что данного рода вероятностями и соответственными им условиями возможно вовсе пренебречь.
Отличие термодинамической и математической систем
Сегодня в научном мире в термодинамике осуществляется деление на 2 ключевые вида вероятности:
- Термодинамическую вероятность.
- Математическую вероятность.
Термодинамической вероятностью именуется некоторое количество микроскопических состояний, благодаря которым возможно произвести требуемое макроскопическое состояние системы. Для нахождения термодинамической вероятности ее изначального состояния, необходимо вычислить число комбинаций, помогающих осуществлению любого пространственного размещения элементов.
Замечание 2
Данный показатель устанавливается количеством перестановок из наличного перемещения элементов.
Математическая вероятность состояния приравнивается отношению термодинамической возможности к всеобщему значению вероятных микроскопических состояний. Математическая вероятность постоянно менее единицы, меж тем как вероятность в термодинамике отражается большими числами. Вероятность в математике не аддитивна и напрямую взаимосвязана не с термической спецификой структуры, а с механической, к примеру, с перемещением молекулярной массы в среде, а также со скоростью элементов.

Сложно разобраться самому?
Попробуйте обратиться за помощью к преподавателям
Одному и тому же макроскопическому состоянию возможно соответствие большого количества несущественных микроскопических состояний. Согласно высказыванию Людвига Больцмана, чем большим количеством данных состояний может осуществляться определенное макроскопическое состояние, тем оно практически наиболее возможно. Термодинамической вероятностью положения системы именуется количество микроскопических состояний, которые в результате реализуют макроскопическое состояние.
При использовании вышеуказанных методов требуется учесть, что базирующиеся на ней результаты являются более возможными исключительно в термодинамических проблемах, и устанавливают исключительно вероятность либо невероятность одного, либо другого физического явления. В реальности возможны несущественные отступления от произведенных выводов. А также проистекающие процессы могут при определенных условиях быть другими, нежели те, которые существовали, опираясь на всеобщие термодинамические позиции.




