From Wikipedia, the free encyclopedia
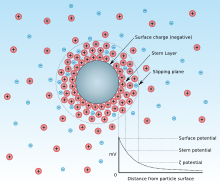
Electrical double layer (EDL) around a negatively charged particle in suspension in water.
The point of zero charge (pzc) is generally described as the pH at which the net charge of total particle surface (i.e. absorbent’s surface) is equal to zero, which concept has been introduced in the studies dealt with colloidal flocculation to explain pH affecting the phenomenon.[1]
A related concept in electrochemistry is the electrode potential at the point of zero charge. Generally, the pzc in electrochemistry is the value of the negative decimal logarithm of the activity of the potential-determining ion in the bulk fluid.[2] The pzc is of fundamental importance in surface science. For example, in the field of environmental science, it determines how easily a substrate is able to adsorb potentially harmful ions. It also has countless applications in technology of colloids, e.g., flotation of minerals. Therefore, the pzc value has been examined in many application of adsorption to the environmental science.[3][4] The pzc value is typically obtained by titrations and several titration method has been developed.[5][6] Related values associated with the soil characteristics exist along with the pzc value, including zero point of charge (zpc), point of zero net charge (pznc), etc.[7]
Term definition of point of zero charge[edit]
The point of zero charge is the pH for which the net surface charge of adsorbent is equal to zero. This concept has been introduced by an increase of interest in the pH of the solution during adsorption.[1] The reason why pH has attracted much attention is that the adsorption of some substances is very dependent on pH. The pzc value is determined by the characteristics of an adsorbent. For example, the surface charge of adsorbent is described by the ion that lies on the surface of the particle (adsorbent) structure like image. At the lower pH, hydrogen ions (protons, H+) would be adsorbed more than other cations (adsorbate) so that the other cations would be less adsorbed in the case of the negatively charged particle. On the other hand, if the surface is positively charged and pH is increased, anions will be less adsorbed as hydroxide ions are increased. From the view of the adsorbent, if the pH is below the pzc value, the surface charge of adsorbent would be positive so that the anions can be adsorbed. Conversely, if the pH is above the pzc value, the surface charge would be negative so that the cations can be adsorbed.
For example, the charge on the surface of silver iodide crystals may be determined by the concentration of iodide ions in the solution above the crystals. Then, the pzc value of the AgI surface will be described by the concentration of I− in the solution (or negative decimal logarithm of this concentration, pI−).
Relation of pzc to isoelectric point[edit]
The pzc is the same as the isoelectric point (iep) if there is no adsorption of other ions than the potential determining H+/OH− at the surface.[8] This is often the case for pure (“pristine surface”) oxides in water. In the presence of specific adsorption, pzc and isoelectric point generally have different values.
Method of experimental determination[edit]
The pzc is typically obtained by acid-base titrations of colloidal dispersions while monitoring the electrophoretic mobility of the particles and the pH of the suspension. Several titrations are required to distinguish pzc from iep, using different electrolytes (including varying the electrolyte ionic strength). Once satisfactory graphs are obtained (acid/base amount—pH, and pH—zeta potential), the pzc is established as the common intersection point (cip) of the lines. Therefore, pzc is also sometimes referred to as cip.
[edit]
Besides pzc, iep, and cip, there are also numerous other terms used in the literature, usually expressed as initialisms, with identical or (confusingly) near-identical meaning: zero point of charge (zpc), point of zero net charge (pznc), point of zero net proton charge (pznpc), pristine point of zero charge (ppzc), point of zero salt effect (pzse), zero point of titration (zpt) of colloidal dispersion, and isoelectric point of the solid (ieps)[9] and point of zero surface tension (pzst[10] or pzs[11]).
Application in electrochemistry[edit]
In electrochemistry, the electrode-electrolyte interface is generally charged. If the electrode is polarizable, then its surface charge depends on the electrode potential.
IUPAC defines[2] the potential at the point of zero charge as the potential of an electrode (against a defined reference electrode) at which one of the charges defined is zero.
The potential of zero charge is used for determination of the absolute electrode potential in a given electrolyte.
IUPAC also defines the potential difference with respect to the potential of zero charge as:
- Epzc = E − Eσ=0
where:
- Epzc is the electrode potential difference with respect to the point of zero charge, Eσ=0
- E is the potential of the same electrode against a defined reference electrode in volts
- Eσ=0 is the potential of the same electrode when the surface charge is zero, in the absence of specific adsorption other than that of the solvent, against the reference electrode as used above, in volts
The structure of electrolyte at the electrode surface can also depend on the surface charge, with a change around the pzc potential. For example, on a platinum electrode, water molecules have been reported to be weakly hydrogen-bonded with “oxygen-up” orientation on negatively charged surfaces, and strongly hydrogen-bonded with nearly flat orientation at positively charged surfaces.[12]
At pzc, the colloidal system exhibits zero zeta potential (that is, the particles remain stationary in an electric field), minimum stability (exhibits maximum coagulation or flocculation rate), maximum solubility of the solid phase, maximum viscosity of the dispersion, and other peculiarities.
Application in environmental geochemistry[edit]
In the field of environmental science, adsorption is involved in many parts of technologies that can eliminate pollutants and governs the concentration of chemicals in soils and/or atmosphere. When studying pollutant degradation or the geochemical process, the pzc value related to adsorption has been examined. For example, natural and organic substrates including wood ash, sawdust, etc. are to be used as an adsorbent by eliminating harmful heavy metals like arsenic, cobalt, mercury ion and so forth in contaminated neutral drainage (CND), which is a passive reactor that could possible metal adsorption with low-cost materials. Therefore, the pzc values of the organic substrates were evaluated to optimize the selection of materials in CND.[3] Another example is that the emission of nitrous acid, which controls the atmosphere’s oxidative capacity. Different soil pH leads to the different surface charges of minerals so the emission of nitrous acid would be varied, further impacting on the biological cycle involved in the nitrous acid species.[4]
Further reading[edit]
- Kosmulski M. (2009). Surface Charging and Points of Zero Charge. CRC Press; 1st edition (Hardcover). ISBN 978-1-4200-5188-9
References[edit]
- ^ a b Sposito, Garrison (1998). “On Points of Zero Charge”. Environmental Science & Technology. 32 (19): 2815–2819. Bibcode:1998EnST…32.2815S. doi:10.1021/es9802347. ISSN 0013-936X.
- ^ a b IUPAC Gold Book
- ^ a b Bakatula, Elisee Nsimba; Richard, Dominique; Neculita, Carmen Mihaela; Zagury, Gerald J. (2018). “Determination of point of zero charge of natural organic materials”. Environmental Science and Pollution Research. 25 (8): 7823–7833. doi:10.1007/s11356-017-1115-7. ISSN 1614-7499. PMID 29294236. S2CID 3946219.
- ^ a b Donaldson, Melissa A.; Bish, David L.; Raff, Jonathan D. (2014). “Soil surface acidity plays a determining role in the atmospheric-terrestrial exchange of nitrous acid”. Proceedings of the National Academy of Sciences. 111 (52): 18472–18477. Bibcode:2014PNAS..11118472D. doi:10.1073/pnas.1418545112. ISSN 0027-8424. PMC 4284574. PMID 25512517.
- ^ Nasiruddin Khan, M.; Sarwar, Anila (2007). “Determination of points of zero charge of natural and treated adsorbents”. Surface Review and Letters. 14 (3): 461–469. Bibcode:2007SRL….14..461N. doi:10.1142/S0218625X07009517. ISSN 0218-625X.
- ^ Bakatula, Elisee Nsimba; Richard, Dominique; Neculita, Carmen Mihaela; Zagury, Gerald J. (2018). “Determination of point of zero charge of natural organic materials”. Environmental Science and Pollution Research. 25 (8): 7823–7833. doi:10.1007/s11356-017-1115-7. ISSN 0944-1344. PMID 29294236. S2CID 3946219.
- ^ Kosmulski, Marek (2001). “Chemical Properties of Material Surfaces”. Surfactant Science. 20011074. doi:10.1201/9780585418049. ISBN 978-0-8247-0560-2. ISSN 2155-6512.
- ^ Sposito, Garrison (1998). “On Points of Zero Charge”. Environmental Science & Technology. 32 (19): 2815–2819. Bibcode:1998EnST…32.2815S. doi:10.1021/es9802347. ISSN 0013-936X.
- ^ Marek Kosmulski, “Chemical Properties of Material Surfaces”, Marcel Dekker Inc., 2001.
- ^ Jean-Pierre Jolivet, “Metal Oxide Chemistry and Synthesis”, John Wiley & Sons, 2000.
- ^ R. J. Stol & P. L. de Bruyn; “Thermodynamic stabilization of colloids”; Journal of Colloid and Interface Science; 1980; 75 (1): pp. 185–198.
- ^ Osawa, Masatoshi; Tsushima, Minoru; Mogami, Hirokazu; Samjeské, Gabor; Yamakata, Akira (2008). “Structure of Water at the Electrified Platinum−Water Interface: A Study by Surface-Enhanced Infrared Absorption Spectroscopy”. J. Phys. Chem. C. 112 (11): 4248–4256. doi:10.1021/jp710386g.
Значение pH, при котором поверхность коллоидного твердого вещества не несет чистого электрического заряда  Двойной электрический слой (EDL) вокруг отрицательно заряженной частицы в суспензии в воде.
Двойной электрический слой (EDL) вокруг отрицательно заряженной частицы в суспензии в воде.
Точка нулевого заряда (pzc) обычно описывается как pH, при котором суммарный заряд всей поверхности частицы (т.е. поверхности абсорбента) равен ноль, эта концепция была введена в исследованиях, посвященных коллоидной флокуляции, чтобы объяснить влияние pH на это явление.
Родственное понятие в электрохимии – электрод потенциал в точке нулевого заряда. Обычно pzc в электрохимии представляет собой значение отрицательного десятичного логарифма активности определяющего потенциал иона в объеме жидкости. Pzc имеет фундаментальное значение в науке о поверхности. Например, в области науки об окружающей среде он определяет, насколько легко субстрат может адсорбировать потенциально вредные ионы. Он также находит бесчисленное количество применений в технологии коллоидов, например, флотация минералов. Таким образом, значение pzc было изучено во многих случаях применения адсорбции в науке об окружающей среде. Значение pzc обычно получают с помощью титрования, и было разработано несколько методов титрования. Связанные значения, связанные с характеристиками почвы, существуют вместе со значением pzc, включая нулевую точку заряда (zpc), точку нулевого чистого заряда (pznc) и т. Д.
Содержание
- 1 Термин определение точки нулевого заряда
- 2 Связь pzc с изоэлектрической точкой
- 3 Метод экспериментального определения
- 4 Связанные сокращения
- 5 Применение в электрохимии
- 6 Применение в геохимии окружающей среды
- 7 Дополнительная литература
- 8 Ссылки
Определение термина точки нулевого заряда
Точка нулевого заряда – это pH, при котором чистый поверхностный заряд адсорбента равен нулю. Эта концепция была введена в связи с увеличением интереса к pH раствора во время адсорбции. Причина, по которой pH привлекает большое внимание, заключается в том, что адсорбция некоторых веществ очень зависит от pH. Величина pzc определяется характеристиками адсорбента. Например, поверхностный заряд адсорбента описывается ионом, который лежит на поверхности частицы (адсорбента) структуры, подобной изображению. При более низком pH ионы водорода (протоны, H) будут адсорбироваться больше, чем другие катионы (адсорбат), так что другие катионы будут меньше адсорбироваться в случае отрицательно заряженной частицы. С другой стороны, если поверхность заряжена положительно и pH увеличивается, анионы будут меньше адсорбироваться, поскольку ионы гидроксида увеличиваются. С точки зрения адсорбента, если pH ниже значения pzc, поверхностный заряд адсорбента будет положительным, так что анионы могут адсорбироваться. И наоборот, если pH выше значения pzc, поверхностный заряд будет отрицательным, так что катионы могут адсорбироваться.
Например, заряд на поверхности кристаллов йодида серебра можно определить по концентрации ионов йодида в растворе над кристаллами. Тогда значение pzc поверхности AgI будет описываться концентрацией I в растворе (или отрицательным десятичным логарифмом этой концентрации, pI).
Отношение pzc к изоэлектрической точке
pzc такое же, как и изоэлектрическая точка (iep), если нет адсорбции других ионов. чем потенциал, определяющий H / OH на поверхности. Это часто имеет место в случае чистых («безупречная поверхность») оксидов в воде. При наличии специфической адсорбции pzc и изоэлектрическая точка обычно имеют разные значения.
Метод экспериментального определения
pzc обычно получают путем кислотно-основного титрования коллоидных дисперсий при мониторинге электрофоретической подвижности частиц и pH суспензии. Чтобы отличить pzc от iep, требуется несколько титрований с использованием различных электролитов (включая изменение ионной силы электролита). Как только получены удовлетворительные графики (количество кислоты / основания – pH и pH – дзета-потенциал), pzc устанавливается как общая точка пересечения (cip) линий. Поэтому pzc также иногда называют cip.
Связанные сокращения
Помимо pzc, iep и cip, в литературе также используется множество других терминов, обычно выражаемых как инициалы с идентичными или (сбивает с толку) почти идентичное значение: нулевая точка заряда (zpc), точка нулевого чистого заряда (pznc), точка нулевого чистого заряда протонов (pznpc), изначальная точка нулевого заряда (ppzc), точка нулевого солевого эффекта (pzse), нулевая точка титрования (zpt) коллоидной дисперсии и изоэлектрическая точка твердого тела (ieps) и точка нулевого поверхностного натяжения (pzst или pzs).
Применение в электрохимии
В электрохимии поверхность раздела электрод -электролит обычно заряжается. Если электрод является поляризуемым, то его поверхностный заряд зависит от потенциала электрода ..
IUPAC определяет потенциал в точке нулевого заряда как потенциал электрода (относительно определенного электрода сравнения), при котором один из определенных зарядов равен нулю.
Потенциал нулевого заряда используется для определения абсолютного потенциала электрода в данном электролите..
IUPAC также определяет разность потенциалов относительно потенциала нулевого заряда. как:
- Epzc = E – E σ = 0
где:
- Epzc – разность потенциалов электродов относительно точки нулевого заряда, E σ = 0
- E – потенциал того же электрода относительно определенного электрода сравнения в вольтах
- Eσ = 0 – потенциал того же электрода, когда поверхностный заряд равен нулю, в отсутствие специфической адсорбции другой чем у растворителя, относительно электрода сравнения, использованного выше, в вольтах.
Структура электролита на поверхности электрода также может зависеть от заряда поверхности с изменением вокруг потенциала pzc. Например, сообщалось, что на платиновом электроде молекулы воды имеют слабую водородную связь с ориентацией «кислород вверх» на отрицательно заряженных поверхностях и сильную водородную связь с почти плоской ориентацией на положительно заряженных поверхностях.
При pzc коллоидная система демонстрирует нулевой дзета-потенциал (то есть частицы остаются неподвижными в электрическом поле ), минимальную стабильность (демонстрирует максимальную коагуляцию или скорость флокуляции ), максимальная растворимость твердой фазы, максимальная вязкость дисперсии и другие особенности.
Применение в геохимии окружающей среды
В области науки об окружающей среде адсорбция используется во многих частях технологий, которые могут устранять загрязнители и управлять концентрацией химических веществ в почве и / или атмосфере. При изучении разложения загрязняющих веществ или геохимических процессов изучалась величина pzc, связанная с адсорбцией. Например, природные и органические субстраты, включая древесную золу, опилки и т. Д., Должны использоваться в качестве адсорбента, удаляя вредные тяжелые металлы, такие как мышьяк, кобальт, ионы ртути и т. Д., В загрязненном нейтральном дренаже (CND), который является пассивным реактором. это может привести к адсорбции металлов дешевыми материалами. Поэтому значения pzc органических субстратов были оценены для оптимизации выбора материалов в CND. Другой пример – выброс азотистой кислоты, которая регулирует окислительную способность атмосферы. Различный pH почвы приводит к разным поверхностным зарядам минералов, поэтому выбросы азотистой кислоты будут разными, что еще больше повлияет на биологический цикл, связанный с азотистой кислотой.
Дополнительная литература
- Kosmulski M. (2009)). Поверхностная зарядка и точки нулевого заряда. CRC Press; 1-е издание (в твердом переплете). ISBN 978-1-4200-5188-9
Ссылки
-
Изоэлектрическая точка и точка нулевого заряда
Изоэлектрическая
точка (ИЭТ)- Характеристика
состояния пов-сти частиц дисперсной
фазы,
при к-ром электрокинетич. потенциал (x)
равен нулю. В ИЭТ не наблюдаются электрокинетические
явления. В дисперсных
системах электрич.
заряд пов-сти частиц обусловлен либо
частичной диссоциацией поверхностных
ионогенных групп, либо адсорбцией из
р-ра потенциалопределяющих ионов.
Вблизи заряженной пов-сти образуется двойной
электрический слой,
в одной части к-рого (внутр. обкладка) у
межфазной пов-сти располагаются
потенциалопределяющие ионы,
а в другой, внешней, – противоионы. В
зависимости от концентрации потенциалопределяющих ионов и
специфически адсорбирующихся противоионов
значение электрокинетич. потенциала x может
меняться от положительного до
отрицательного, равняясь нулю в ИЭТ.
Для определения ИЭТ дисперсных
систем строят
график зависимости x от концентрации р-ра;
точка пересечения кривой x (lg
c) с осью абсцисс соответствует ИЭТ.
Коллоидные
системы в
ИЭТ неустойчивы и легко коагулируют. В
отсутствие специфич. адсорбции противоионов
ИЭТ совпадает с потенциалом
нулевого заряда пов-сти. По
величине ИЭТ можно судить о степени
чистоты пов-сти, а также рассчитать
величины адсорбц. потенциалов.
(←Электрокапиллярная
кривая)Точка нулевого заряда (ТНЗ) —
электрохимическая характеристика
поверхности вещества, например AgI, в
определенной среде, например в растворе
электролита. Она указывает условие, при
котором поверхность вещества в данной
среде незаряжена.
Величина
удельного (на единицу площади поверхности
вещества) заряда поверхности, которая
также называется поверхностной плотностью
заряда, зависит от многих факторов.
Среди них важнейшими являются концентрация
потенциалопределяющих (ПО) ионов и
величина внешней разности потенциалов,
подведенной к веществу и той среде, в
которой оно находится. В последнем
случае вещество исполняет роль одного
из электродов электрохимической ячейки.
Соответственно этому нулевую величину
заряда поверхности можно обеспечить,
изменяя концентрацию подходящего
электролита, и тогда ТНЗ — это концентрация
ПО иона, при которой поверхность не
заряжена. Нулевую величину заряда можно
также обеспечить, подавая на электрод,
изготовленный из исследуемого вещества,
электрический потенциал, противоположный
по знаку собственному потенциалу
вещества в данной среде. В этом случае
ТНЗ — это величина внешней разности
потенциалов, подведенной к веществу и
среде, которую более однозначно можно
назвать потенциалом нулевого заряда
(ПНЗ). Одно и то же вещество может иметь
бесчисленное множество потенциалов
нулевого заряда, поскольку ПНЗ является
также и функцией состава среды. По этой
причине ПНЗ не представляет интереса
как электрохимическая характеристика
вещества. В большей мере он характеризует
адсорбционную способность (потенциал)
ПО ионов к поверхности данного вещества.
Перечень веществ, на которых можно
измерять ПНЗ, практически ограничен
одной ртутью, и поэтому этим методом
можно изучать адсорбционную способность
тех или иных ионов только на поверхности
ртути. Такие данные представляют
ограниченный интерес и далее не
рассматриваются. В отличие от этого
концентрационная ТНЗ является
характеристикой вещества по отношению
к любым ионам. Однако фундаментальный
интерес представляет значение точки
нулевого заряда по отношению к ионам,
которые образуют изучаемое вещество, например
к ионам Ag+ и
I–, если речь идет о ТНЗ иодида серебра
AgI.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Заключение
Анализ биохимических результатов сыворотки крови экспериментальных животных с внутрисуставным переломом бедра показал, что при перрораль-ном введении препарата, обладающего инсулинопо-добными свойствами, активация процессов остеоге-неза идет несколько быстрее, чем при внутриартику-лярном введении. Данное обстоятельство подтверждается тем, что при внутриартикулярном и приперо-ральном введении препарата происходит повышение щелочной фосфатазы, при пероральном введении снижается активность кислой фосфатазы, в отличие от внутриартикулярного введения.
Список литературы
1. Анкин Л.Н., Анкин H.J1. Практика остеосинтеза и эндопро-
тезирование. – Киев, 1996. – 304 с.
2. Буачидзе О.Ш., Оноприенко Г.А., Волошин В.П. и др.
Отдаленные результаты эндопротезирования тазобедренного сустава // VI съезд травматологов и ортопедов России. – Н.Новгород, 1997. – С. 529-533.
3. Зиненко Т.Н. Глюкозамин в физиологической регенерации
суставного хряща / VII Республиканская школа: Биология опорно-двигательного аппарата. Харьков, 810 июня 1994г. // Ортопед, травматол. -1994. – № 4. -С. 76.
4. Мажуга П.М., Черкасов В.В. Оценка функционального
состояния хондроцитов суставного хряща по данным электронной микроскопии, авторадиографии и люми-нисценции // Цитология и генетика. – 1971. – № 5. -С. 452-458.
5. Пашук А.Ю., Мезенцева P.M. Комплексное лечение артро-
зов крупных суставов с применением мукартина и артепарона // Труды института ортопедии и травматологии. – Рига, 1991. – Вып. 21. – С. 57-62.
6. Разработка нового противоартрозного средства на
основе Дглюкозамина /В.А. Колепанцев, И.И. Самокиш,-Ю.К Василенко и др. // Тезисы докл. II Российского национального конгресса «Человек и лекарство». – М.: РЦ «Фармединфо», 1995. – С. 120.
7. Романчиков Ю.М. Факторы роста. Вторичные мессенд-
жеры и онкогены // Успехи совр. биологии. – 1991. -Т.111,- № 1. – С. 19-33.
8. Сергеев C.B., Жмотова Е.А., Киммельфельд И.М. и др.
Эволюция коксартроза в свете экспертизы трудоспособности // Вестник травматол. и ортопед. – 1996. -№2. – С. 3-5.
9. Bllllnghurst RC, Buxton EM, Edwards MG. Use of an
antineoepitope antibody for identification of type-ll collagen degradation in equine articular cartilage. // Am. J. Vet. Res. – 2001. – Vol. 62, N7.-P. 1031-1039.
СЕРИЯ «ЕСТЕСТВЕННЫЕ НАУКИ», ВЫПУСК 5
УДК 541.135; 543.7
Л.В.Мосталыгина, А.Г.Мосталыгин, А.В.Костин, С.Н.Елизарова, Н.АЛбабкова Курганский государственный университет
ОПРЕДЕЛЕНИЕ ТОЧКИ НУЛЕВОГО ЗАРЯДА БЕНТОНИТОВОЙ ГЛИНЫ ЗЫРЯНСКОГО
МЕСТОРОЖДЕНИЯ МЕТОДОМ ВЕСОВОГО ТИТРОВАНИЯ
Аннотация
Определена точка нулевого заряда бентонитовой глины Зырянского месторождения методом весового титрования при разных ионных силах и при различном исходном значении рН. Показано, что ионная сила раствора влияет на данный показатель.
Ключевые слова: бентонитовая глина, точка нулевого заряда,титрование.
L.V.Mostalygina, A.V.Kostin, S.N.EIizarova,
N.A.Ababkova
Kurgan State University
IDENTIFYING THE POINT OF ZERO CHARGE OF BENTONITE CLAY ZYRYANSKY DEPOSITS BY WEIGHT TITRATION
Annotation
The point of zero charge ofbentonite clay Zyryansky deposits by weight titration method at different ionic strengths and at different initial pH has been defined. It is shown that the ionic strength of the solution affects the figure.
Keywords: bentonite clay, the point of zero charge, the titration.
Введение
Природные сорбенты исследуют широко по причине их высоких сорбционных свойств, безвредности для окружающей среды, дешевизны. Нами в качестве объекта изучения выбрана бентонитовая глина Зырянского месторождения Курганской области — местное сырье.
Известно, что многие геохимические процессы -удаление загрязнений из подземных вод, формирование пород, изменение почвенного состава – включают процессы адсорбции на границе раздела минерал/вода. Такие процессы, как адсорбция на поверхности минералов протонов, органических веществ, а также катионов металлов влияют на заряд поверхности [1]. Таким образом, для объяснения механизма сорбции веществ различной природы на поверхности данного минерала необходима количественная инфор-
107
мация о характеристиках поверхностного заряда на глине. Глины различных месторождений имеют свои физико-химические особенности, что непосредственно влияет на величину точки нулевого заряда (ТНЗ).
Точка нулевого заряда (ТНЗ) или рНТНЗ – это значение рН, при котором общий чистый заряд поверхности частицы равен 0. Значение рН точки нулевого заряда является очень важной электрохимической характеристикой минералов. Если значение рН окружающего раствора будет превышать рНТНЗ, то минерал будет способен к поглощению в основном катионов. Если значение рН раствора ниже рНТНЗ, минерал поглощает преимущественно анионы. Наличие в составе твердой фазы почвы минералов с разными значениями рНТНЗ существенно влияет на процессы поглощения и десорбции химических элементов, присутствующих в почвенных растворах в катионной и анионной формах [1; 2].
ТНЗ – это важный параметр, играющий решающую роль во многих химических явлениях, таких, как адсорбция, взаимодействие частиц в коллоидальных суспензиях, коагуляция, растворение минералов гидроксидов, электрохимических явлениях. Для его определения разработано несколько методов. Наиболее часто используются классические методы потен-циометрического титрования, реже – весового титрования. Данные по потенциометрическому определению ТНЗ весьма противоречивы и значения варьируются от 2,6 до 8,8 в зависимости от условий эксперимента [1; 2]. Поэтому на первом этапе стояла задача определения ТНЗ бентонитовой глины Зырянского месторождения весовым методом. Дальнейшие исследования предполагают сопоставление двух методов — весового и потенциометрического.
1. Материалы и методы исследования
1.1. Подготовка глины
Использованный в работе материал — бентонитовая глина Зырянского месторождения – исследован нами ранее. Материал в предшествующих работах охарактеризован нами методами ИК-спектроскопии, рентгенофазового анализа, сканирующей электронной микроскопии и других.
Среднюю пробу бентонитовой глины Зырянского
месторождения грубого помола просушивали до постоянной массы при температуре 105±50 в течение 3 часов, далее просеивали через сито с диаметром отверстий 0,1 мм. Из глины готовили около 50 навесок массой 0,05 г.
2.2. Приготовление раствора хлорида натрия
Для приготовления раствора с концентрацией 0,1М навеску препарата 1,4625г растворяли в 250мл дистиллированной воды. Путем последовательного разбавления получали растворы с концентрациями 0,01М и 0,001 М, которые создавали в растворе ионную силу (I) равную 0,1; 0.01 и 0,01 соответственно.
2.3 Методика определения точки нулевого заряда бентонитовой глины методом весового титрования
Традиционным является метод кислотно-основного титрования. Однако ряд авторов предлагают использовать метод весового титрования [3; 4]. Суть метода — измерение величины предельного значения рН при увеличении весовых фракций бентонитовой глины.
В стакан вместимостью 50 мл наливали 30 мл раствора хлорида натрия с требуемой ионной силой. Измеряли рН исходного раствора. В стакан помещали навеску глины (0,05г) и перемешивали с помощью магнитной мешалки в течение 10 минут до установления равновесного значения рН. После чего добавляли очередную порцию глины. Эксперимент продолжали до неизменного значения рН при добавлении минерала. Таким образом, в этой части исследований меняли значения ионной силы (0,1; 0,01; 0,001). Следующий эксперимент проводился при одной ионной силе (0,01М) и различных исходных значениях рН исследуемой суспензии глины. Начальное значение рН меняли с помощью фиксанальных растворов гид-роксида натрия и соляной кислоты.
2. Результаты и их обсуждение
Данные по исследованию зависимости точки нулевого заряда глины от ионной силы представлены в табл. 1.
Как видно из результатов весового титрования, ионная сила влияет на величину точки нулевого заряда, а значит, и на электрохимические свойства повер-
Таблица 1
Зависимость рН от массы глины при различных ионных силах
0,1М №С1 0,01М ШС1 0,001М ша
Масса глины рН Масса глины рН Масса глины рН
0 6,17 0 6,1 0 6,56
0,05 8,00 0,05 7,65 0,05 8,00
0,10 8,02 0,10 8,20 0,10 8,72
0,15 8,16 0,15 8,36 0,15 8,82
0,20 8,36 0,20 8,53 0,20 8,98
0,25 8,50 0,25 8,62 0,25 9,00
0,30 8,54 0,30 8,63 0,30 9,09
0,35 8,54 0,35 8,63 0,35 9,15
0,40 8,54 0,40 8,70 0,40 9,15
0,45 8,54 0,45 8.76 0,45 9,16
0,50 8,54 0,50 8,76 0,50 9,16
108
ВЕСТНИК КГУ, 2012. №3
хности: понижение ионной силы приводит к увеличению рНТНЗ от 8,54 (1=0,1) до 9,16 (1=0,001). Это говорит о том, что при разных ионных силах рН перезарядки поверхности глины, а соответственно способность ее к катионному или анионному обмену, меняется, что требуется учесть при объяснении механизма сорбции на поверхности глины положительно и отрицательно заряженных частиц. При ионной силе, равной 0,01, в интервале рН от 8,54 до 9,16 поверхность глины остается заряженной отрицательно, в это время из глины «выходят» гидроксид-ионы, что приводит к одновременному понижению заряда поверхности до нуля и повышению их концентрации в растворе, а значит, сдвигу величины рН в щелочную область. Аналогичные результаты для монтмориллонита, иллита и некоторых почв получены в работах Хендершота с сотрудниками [5] и Мадрида с сотрудниками [6]. Кривые зависимости рН суспензии от массы глины при различных концентрациях №С1 не пересекались.
Определение точки нулевого заряда при одной ионной силе (0,01М №С1) и разных значениях рН позволило установить точное значение рНТНЗ (табл. 2, рис. 1). Из рис. 1 видно, что при добавлении твердого минерала глины значение рН суспензии меняется и асимптотически приближается к некоторому постоянному пределу. При этом направление изменения рН определяется начальной его величиной. Значение рН, при котором прибавление глины не вызывает изменения рН системы, можно найти и интерполяцией. Найденное значение рН оказалось равным 8,75 и дает ТНЗ твердой фазы.
Заключение
Результаты исследований показали:
1. Образцы бентонитовой глины Зырянского месторождения в растворах с различной ионной силой (0,1; 0,01; 0,001М) дают кривые сорбции протонов, которые не пересекаются между собой.
2. Ионная сила влияет на величину точки нулевого заряда, а значит, и на электрохимические свойства поверхности: понижение ионной силы приводит к увеличению рНТНЗ от 8,54 (1=0,1) до 9,16 (1=0,001).
3. При одном значении ионной силы исходного раствора (0,01) и различных рН все кривые асимптотически приблизились к постоянной предельной величине, равной 8,75. Ее мы считаем точкой нулевого заряда исследуемого минерала.
m, г
Рис. 1. Зависимость величины рН суспензии глины от ее массы при различных значениях рН исходного раствора (1=0,01)
4. Предполагается в ближайшее время провести сравнительный анализ двух методов определения ТНЗ глины – потенциометрического и весового титрования для установления истинного значения ТНЗ, что позволит лучше понять механизмы сорбции на поверхности глины.
Список литературы
1. Криаа А., Хамди Н, Срасра Э. Химия кислотно-основных
взаимодействий для монтмориллонита и бейделит-монтмориллонитного смектита // Электрохимия. -2007. – Т.43, №2. – С.175-187.
2. Фрини-Срасра Н., Криаа А,Срасра Е. Кислотно-основные
свойства Тунисского палыгорскита в водной среде // Электрохимия.- 2007. – Т.43, №7. – С.834-842.
3. Avena M, De Hauli C.P.//J.Colloid Interface Sci.1998.-V. 202.-
P.195
4. Nov S.J., Schwartz A.J.//J.Colloid Interface Sci.1989.-V. 130.-
P.157
5. Hendershot W.H., Lavkulich L.M. // Soil Sci. Soc. Amer.J.
1983. – V. 47. – P. 1252.
6. Madrid L., Diaz-
Barrientos E. // J. Soil Sci. Soc. 1988.V. – 39. P. – 215.
Таблица 2
Зависимость рН суспензии глины от массы глины при различных значениях рН исходного раствора (1= 0,01)
Масса рН Масса рН Масса рН
0 10,16 0 9,32 0 6,1
0,05 9,30 0,05 8,95 0,05 7,65
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
0,10 8,39 0,10 8,73 0,10 8,20
0,15 8,27 0,15 8,75 0,15 8,36
0,20 8,29 0,20 8,70 0,20 8,53
0,25 8,36 0,25 8,79 0,25 8,62
0,30 8,38 0,30 8,76 0,30 8,63
0,35 8,42 0,35 8,75 0,35 8,63
0,40 8,47 0,40 8,75 0,40 8,70
0,45 8,55 0,45 8,75 0,45 8.76
0,50 8,58 0,50 8,75 0,50 8,76
0,55 8,60 0,55 8,75 0,55 8,76
0,60 8,75 0,60 8,75 0,60 8,76
СЕРИЯ «ЕСТЕСТВЕННЫЕ НАУКИ», ВЫПУСК 5
109

Двойной электрический слой (EDL) вокруг отрицательно заряженной частицы в суспензии в воде.
Точка нулевого заряда (PZC) , как правило , описываются как рН , при котором суммарный заряд от общей поверхности частиц (т.е. впитывающей – й поверхность) равен нуль, что концепция была введен в исследованиях , рассматриваемый коллоидной флокуляцией для объяснения рНа влияя на явление.
Связанное с этим понятие в электрохимии – электродный потенциал в точке нулевого заряда. Как правило, pzc в электрохимии представляет собой значение отрицательного десятичного логарифма активности определяющего потенциал иона в объеме жидкости. Pzc имеет фундаментальное значение в науке о поверхности. Например, в области наук об окружающей среде он определяет, насколько легко субстрат может адсорбировать потенциально вредные ионы. Он также имеет бесчисленное множество применений в технологии коллоидов , например, при флотации минералов. Таким образом, значение pzc было изучено во многих случаях применения адсорбции в науке об окружающей среде. Значение pzc обычно получают титрованием, и было разработано несколько методов титрования . Связанные значения, связанные с характеристиками почвы, существуют вместе со значением pzc, включая нулевую точку заряда (zpc), точку нулевого чистого заряда (pznc) и т. Д.
Срок определения точки нулевого заряда
Точка нулевого заряда – это pH, при котором чистый поверхностный заряд адсорбента равен нулю. Эта концепция была введена увеличением интереса к pH раствора во время адсорбции. Причина, по которой pH привлекает большое внимание, заключается в том, что адсорбция некоторых веществ очень зависит от pH. Значение pzc определяется характеристиками адсорбента. Например, поверхностный заряд адсорбента описывается ионом, который лежит на поверхности частицы (адсорбента) со структурой, подобной изображению. При более низком pH ионы водорода (протоны, H + ) будут адсорбироваться больше, чем другие катионы (адсорбат), так что другие катионы будут меньше адсорбироваться в случае отрицательно заряженной частицы. С другой стороны, если поверхность заряжена положительно и pH увеличивается, анионы будут меньше адсорбироваться по мере увеличения количества гидроксид-ионов . С точки зрения адсорбента, если pH ниже значения pzc, поверхностный заряд адсорбента будет положительным, так что анионы могут адсорбироваться. И наоборот, если pH выше значения pzc, поверхностный заряд будет отрицательным, так что катионы могут адсорбироваться.
Например, заряд на поверхности кристаллов йодида серебра может определяться концентрацией ионов йодида в растворе над кристаллами. Тогда значение pzc поверхности AgI будет описываться концентрацией I – в растворе (или отрицательным десятичным логарифмом этой концентрации, pI – ).
Связь pzc с изоэлектрической точкой
Pzc совпадает с изоэлектрической точкой (iep), если нет адсорбции других ионов, кроме потенциала, определяющего H + / OH – на поверхности. Это часто имеет место в случае чистых («безупречная поверхность») оксидов в воде. При наличии специфической адсорбции pzc и изоэлектрическая точка обычно имеют разные значения.
Метод экспериментального определения
Pzc обычно получают кислотно-основным титрованием коллоидных дисперсий при мониторинге электрофоретической подвижности частиц и pH суспензии. Чтобы отличить pzc от iep, требуется несколько титрований с использованием разных электролитов (включая изменение ионной силы электролита). После получения удовлетворительных графиков (количество кислоты / основания – pH и pH – дзета-потенциал) устанавливается pzc как общая точка пересечения (cip) линий. Поэтому pzc также иногда называют cip.
Помимо pzc, iep и cip, в литературе также используется множество других терминов, обычно выражаемых как инициализмы с идентичным или (что сбивает с толку) почти идентичным значением: нулевая точка заряда (zpc), точка нулевого чистого заряда (pznc ), точка нулевого чистого заряда протона (pznpc), исходная точка нулевого заряда (ppzc), точка нулевого солевого эффекта (pzse), нулевая точка титрования (zpt) коллоидной дисперсии и изоэлектрическая точка твердого тела (ieps) и точка нулевого поверхностного натяжения (pzst или pzs).
Применение в электрохимии
В электрохимии граница раздела электрод-электролит обычно заряжена. Если электрод поляризуемый , то его поверхностный заряд зависит от потенциала электрода .
IUPAC определяет потенциал в точке нулевого заряда как потенциал электрода (относительно определенного электрода сравнения), при котором один из определенных зарядов равен нулю.
Потенциал нулевого заряда используется для определения абсолютного потенциала электрода в данном электролите .
IUPAC также определяет разность потенциалов относительно потенциала нулевого заряда как:
- E pzc = E – E σ = 0
куда:
- E pzc – разность потенциалов электродов относительно точки нулевого заряда, E σ = 0
- E – потенциал того же электрода относительно определенного электрода сравнения в вольтах.
- E σ = 0 – потенциал того же электрода, когда заряд поверхности равен нулю, в отсутствие специфической адсорбции, отличной от адсорбции растворителя, против электрода сравнения, как указано выше, в вольтах.
Структура электролита на поверхности электрода также может зависеть от заряда поверхности с изменением около pzc-потенциала. Например, сообщалось, что на платиновом электроде молекулы воды слабо связаны водородными связями с ориентацией “кислород вверх” на отрицательно заряженных поверхностях и сильно связаны водородными связями с почти плоской ориентацией на положительно заряженных поверхностях.
При pzc коллоидная система демонстрирует нулевой дзета-потенциал (то есть частицы остаются неподвижными в электрическом поле ), минимальную стабильность (демонстрирует максимальную скорость коагуляции или флокуляции ), максимальную растворимость твердой фазы, максимальную вязкость дисперсии и другие параметры. особенности.
Применение в геохимии окружающей среды
В области науки об окружающей среде адсорбция используется во многих частях технологий, которые могут удалять загрязнители и управлять концентрацией химических веществ в почве и / или атмосфере. При изучении разложения загрязняющих веществ или геохимических процессов изучалась величина pzc, связанная с адсорбцией. Например, природные и органические субстраты, включая древесную золу, опилки и т. Д., Должны использоваться в качестве адсорбента, удаляя вредные тяжелые металлы, такие как мышьяк, кобальт, ионы ртути и т. Д., В загрязненном нейтральном дренаже (CND), который является пассивным реактором. это может привести к адсорбции металлов дешевыми материалами. Поэтому значения pzc органических подложек были оценены для оптимизации выбора материалов в CND. Другой пример – выброс азотистой кислоты , которая регулирует окислительную способность атмосферы . Различный pH почвы приводит к разным поверхностным зарядам минералов, поэтому выбросы азотистой кислоты будут разными, что еще больше повлияет на биологический цикл, связанный с видами азотистой кислоты.
дальнейшее чтение
- Космульский М. (2009). Поверхностная зарядка и точки нулевого заряда . CRC Press; 1-е издание (в твердом переплете).
ISBN 978-1-4200-5188-9
