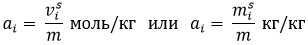Определение удельной поверхности
адсорбента
Определение удельной поверхности адсорбента.
В
последнее время все более широкое
применение в медицине находят методы
экстракорпоральной детоксикации
организма, используемые при многих
патологических состояниях организма.
Такие методы обработки биологических
жидкостей (крови, плазмы, лимфы) основаны
на способности многих веществ
адсорбироваться на поверхности раздела
фаз.
Адсорбция – процесс
самопроизвольного концентрирования
поверхностно активных веществ в
поверхностном слое в результате перехода
его из объема фазы.
Поверхностно
активные вещества обладают двойственной
дифильной природой. Молекулы их
состоят из полярной части, хорошо
взаимодействующей с водой – это группы
-COOH,
-COO
, -OH
, -SO3H,
-NH2,
и т.д. (гидрофильная часть молекулы), и
неполярного углеводородного радикала
(гидрофобная часть).
Поверхность раздела
фаз характеризуется особым энергетическим
состоянием атомов и молекул, находящихся
на границе раздела. Это энергетическое
состояние характеризуется избытком
свободной поверхностной энергии.
Граница раздела
жидкость – газ характеризуется
поверхностным натяжением. Его можно
определить как частную производную
любой характеристической функции по
площади раздела фаз при соответствующих
постоянных:
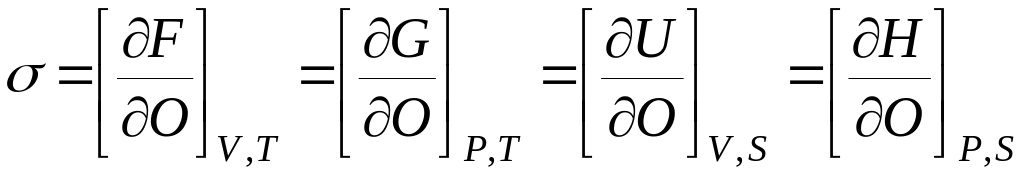
Все функции и
параметры относятся к системе в целом.
Из данного
определения следует, что
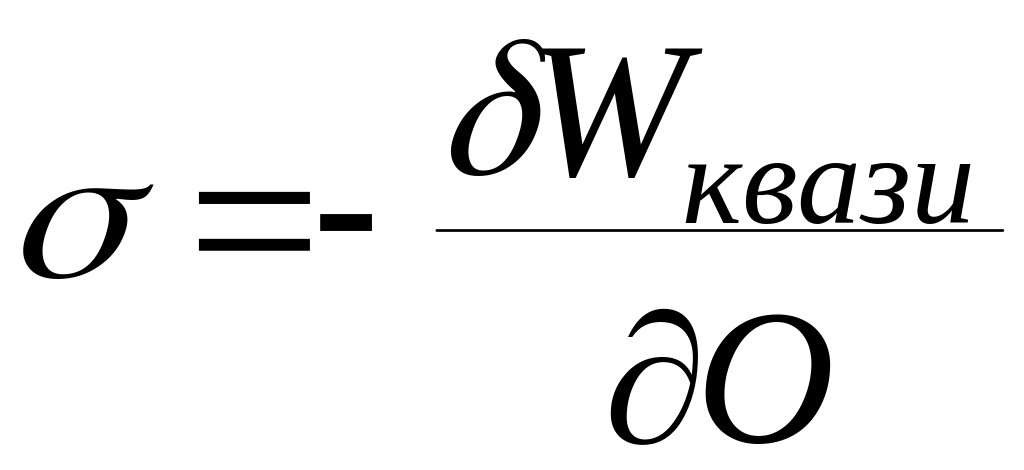
Граница раздела
фаз жидкость – жидкость характеризуется
межфазным натяжением, твердое – газ
кристаллоповерхностным давлением.
Адсорбция
поверхностноактивных веществ (ПАВ)
приводит к снижению избытка свободной
поверхностной энергии – переходу системы
в состояние с меньшей поверхностной
энергией.
Для
адсорбции наиболее часто используют
твердые адсорбенты, и самой важной
характеристикой их является удельная
поверхность – величина поверхности
раздела фаз, приходящаяся на единицу
массы или объема адсорбента.
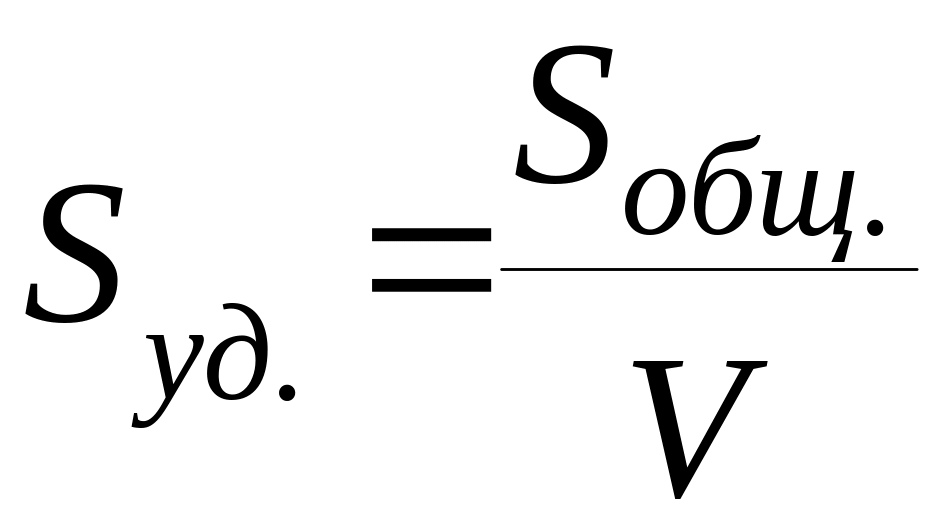
м2/кг
или м2/м3
Наиболее
распространенными методами определения
удельной поверхности являются
адсорбционные методы. Используя их,
величину поверхности, приходящуюся
на единицу массы материала, вычисляют
по количеству поглощенных этой
поверхностью веществ из раствора
или газовой фазы. Правильный расчет
удельной поверхности возможен, если
известно строение адсорбционных слоев.
Известны два типа
адсорбции: мономолекулярная и
полимолекулярная. В первом случае
поглощаемое вещество распределяется
по поверхности адсорбента, образуя
слой, толщина которого не превышает
размеров одной молекулы. Адсорбция по
второму типу приводит к образованию
на поверхности раздела нескольких слоев
адсорбированного вещества.
Расчет
удельной поверхности по данным
мономолекулярной адсорбции достаточно
прост. При
этом используется формула
![]()
где:
![]()
– максимально возможное число моль
вещества, поглощенное 1 г адсорбента;
Nа
– число Авогадро;
S0
– площадь, занимаемая одной молекулой
адсорбированного вещества при максимальной
упаковке молекул в адсорбционном слое.
Обычно величина
S0
приводится в справочниках.
Для нахождения
величины m![]()
используют уравнение изотермы
мономолекулярной адсорбции, предложенное
И.Ленгмюром:
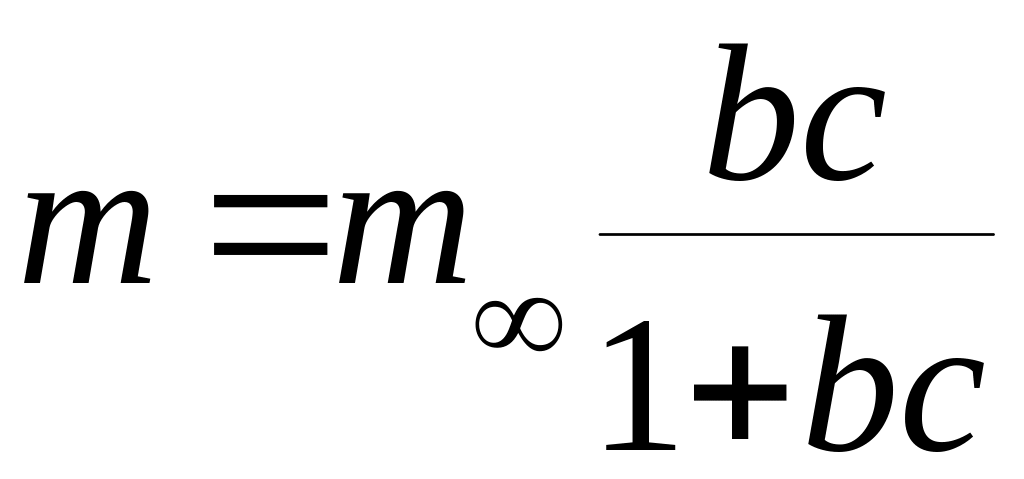
где:
m
– количество адсорбированного вещества
при данной концентрации С;
b
– постоянная.
Задача эксперимента
сводится к определению конкретного
вида зависимости адсорбции от концентрации.
Если эта зависимость установлена, то
константы уравнения находят, представляя
изотерму в координатах (1/m
, 1/С).Как видно из рисунка 2 в этих
координатах изотерма представляет
собой прямую, уравнение которой:
![]()



m
1/m
![]()
1/m∞
C
1/C
Рис.1 Изотерма
Ленгмюра Рис.2
Спрямленная
изотерма
Ленгмюра.
Для
вычисления адсорбции необходимо измерить
концентрацию до адсорбции С1
и после достижения адсорбционного
равновесия С2.
Расчет
производят по формуле:
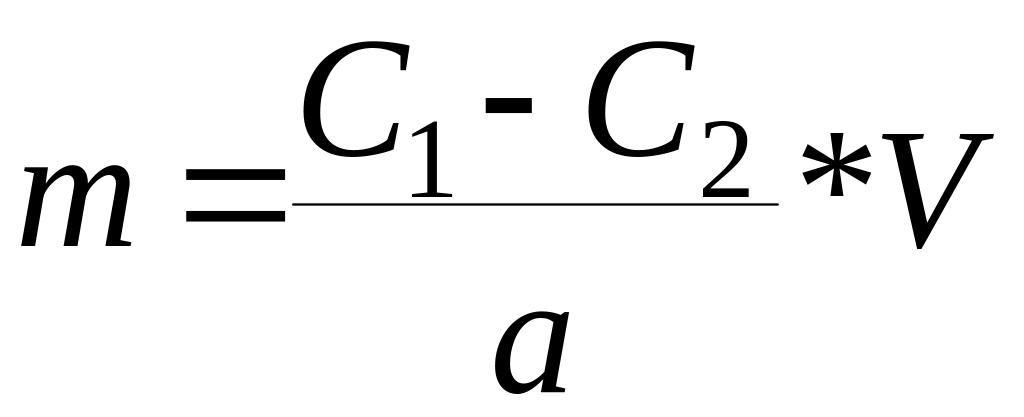
где: V
– обьем раствора;
а – навеска
адсорбента.
Способ определения
концентраций С1
и С2
зависит от свойств адсорбируемого
вещества. Например, если адсорбируются
карбоновые кислоты, то наиболее просто
установить их концентрацию титрованием
щелочью. В случае применения радиоактивных
веществ, концентрация последних
устанавливается измерением радиоактивности.
Если в качестве
адсорбируемого соединения используется
низкомолекулярные ПАВ – спирты или
карбоновые кислоты, в водных растворах
которых адсорбционное равновесие
устанавливается достаточно быстро,
можно использовать для определения
концентрации ПАВ измерение поверхностного
натяжения.
Зависимость
поверхностного натяжения от концентрации
для большинства ПАВ описывается
уравнением Б. Шишковского:
![]()
где:
![]()
–
поверхностное натяжение раствора ПАВ
концентрации С;
![]()
–
поверхностное натяжение чистой воды;
а, b
– постоянные уравнения.
Зависимость
адсорбции от поверхностного натяжения
и концентрации дается уравнением Гиббса:
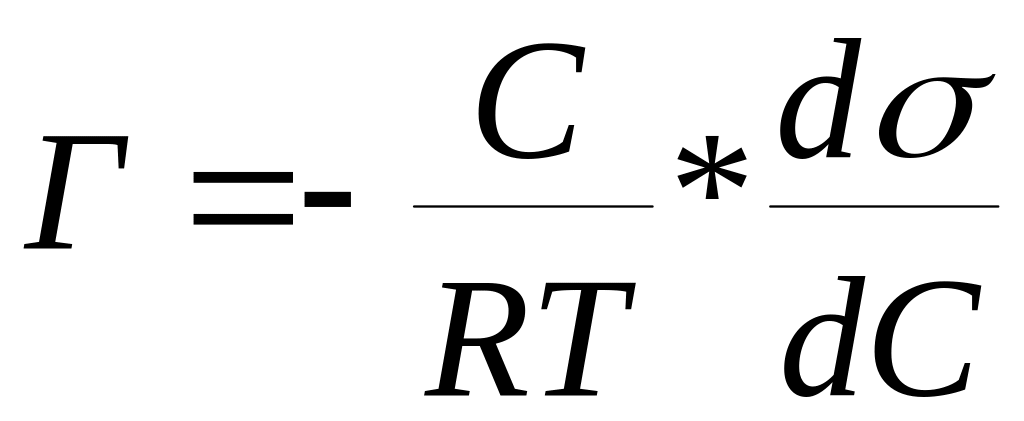
В данной работе
удельную поверхность определяют по
адсорбции уксусной кислоты активированным
углем.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
АдсорбцияАдсорбцией называется самопроизвольное изменение концентрации компонента в поверхностном слое по сравнению с его концентрацией в объеме фазы. Более плотную фазу (определяющую форму поверхности) принято называть адсорбентом, вещество, молекулы которого могут адсорбироваться – адсорбтивом, уже адсорбированное вещество – адсорбатом. Процесс, обратный адсорбции, называют десорбцией. Классификация адсорбционных процессовВ зависимости от природы адсорбционных сил, адсорбция может быть физической и химической. Количественные характеристики адсорбцииДля количественного описания адсорбции применяют три величины: избыточная, или гиббсовская адсорбция, абсолютная адсорбция, удельная адсорбция.
1. Избыточная, или гиббсовская адсорбция (Гi). Это избыток 2-го компонента в поверхностном слое по сравнению с его количеством в объеме фазы, приходящийся на единицу площади поверхности.
где cis и ci – молярная концентрация 1-го компонента соответственно в поверхностном слое и в объеме фазы, Vs – объем поверхностного слоя, который принято считать двухмерным и равным 1 см2, S1,2 – площадь поверхностного слоя. Учитывая, что молярная концентрация, умноженная на объем – это количество вещества,
2. Абсолютная адсорбция. В тех случаях, когда способность вещества к адсорбции резко выражена, и вследствие этого cis ≫ ci и vis ≫vi, адсорбцию характеризуют величиной Ai, называемой абсолютной адсорбцией.
где vis – количество вещества в поверхностном слое. 3. Удельная адсорбция. В тех случаях, когда измерить площадь поверхности S1,2 трудно, количество i-го компонента vis (или его массу mis) относят к массе адсорбента m, используя величину удельной, адсорбции ai:
Если адсорбтивом является газ, вместо его количества (моль) или массы (кг) применяют его объем, исходя из того, что при нормальных условиях (0°С, 1 атм) 1 моль любого газа занимает объем, равный 22,4 дм3. Тогда удельная адсорбция измеряется дм3/кг. Если Гi, Ai, ai > 0, адсорбцию называют положительной, если Гi, Ai, ai < 0, то имеет место отрицательная адсорбция. Список использованной литературы
|
Информация о статье: Просмотров: 13976 Оценка информации: 5.0 з 5 Количество голосов – 1
|
12. Адсорбция. Площадь, приходящаяся на одну молекулу в адсорбционном слое
Адсорбция (от лат. ad — «на, при» и sorbeo — «поглощаю») — это поглощение вещества из газообразной среды или раствора поверхностным слоем жидкости или твердого тела, следствием которого является самопроизвольное концентрирование веществ вблизи поверхности раздела фаз. Вещество, на поверхности которого происходит адсорбция, называется адсорбентом, а поглощаемое из объемной фазы вещество — адсорбатом. После адсорбции внутреннее притяжение частично компенсируется притяжением со стороны адсорбционного слоя, и поверхностное натяжение уменьшается. Слой жидкости, который прилегает к поверхности и равен по толщине радиусу сферы молекулярного взаимодействия, называется поверхностным слоем. Молекулы жидкости в поверхностном слое находятся под действием сил притяжения соседних молекул. Равнодействующая этих сил притяжения направлена в глубь жидкости, передвижение молекул из глубины жидкости в поверхностный слой требует затрат работы на преодоление сил межмолекулярного сцепления (когезии). Работа, выполняемая для увеличения поверхности жидкости на единицу, называется поверхностным натяжением. Поверхностное натяжение можно рассматривать как силу, которая действует на единицу длины контура, который ограничивает поверхность и пытается ее сократить по нормали к касательной к поверхности. Поверхностное натяжение измеряется в Дж/м2 или Н/м. Работа по образованию новой поверхности, которая происходит в условиях изотермического или обратимого процесса (максимальная работа), осуществляется за счет изменения изохорно-изотермического потенциала.
Для единицы поверхности (S):

Поверхностное натяжение представляет собой свободную энергию единицы поверхности. Запас свободной поверхностной энергии гетерогенной системы с межфазной поверхностью раздела S: F = σ х s. Самопроизвольное стремление к уменьшению F системы может быть реализовано или путем уменьшения межфазной поверхности (например, при коагуляции), или за счет уменьшения поверхностного натяжения раствора. Если растворенное вещество способно уменьшать поверхностное натяжение раствора, то оно будет концентрироваться (адсорбироваться) на поверхностном слое. Эти вещества называют поверхностно-активными веществами (ПАВ). Связь между адсорбцией и поверхностным натяжением выражается уравнением Гиббса:

где Г — удельная адсорбция растворенного вещества в моль/м2, т. е. избыточная концентрация растворенного вещества в поверхностном слое раствора в сравнении с его объемной концентрацией с; s — поверхностное натяжение раствора, Дж/м2; R — универсальная газовая постоянная; Т — температура, К.
Производная (изменение поверхностного натяжения с концентрацией) называется поверхностной активностью растворенного вещества. Такие вещества называются поверхностно-инактивными веществами (ПИАВ). Изменение поверхностного натяжения по сравнению с поверхностным натяжением растворителя описывается эмпирическим уравнением Шишковского:
σ0 — σ = B ln(1 + Ac) < 0, где А и В — эмпирические константы. Продифференцировав, имеем:

 — удельная адсорбция при максимально заполненной поверхности (граничная удельная адсорбция). Отсюда В = Г∞RT. Площадь, которую занимает одна молекула в адсорбированном слое:
— удельная адсорбция при максимально заполненной поверхности (граничная удельная адсорбция). Отсюда В = Г∞RT. Площадь, которую занимает одна молекула в адсорбированном слое:
S = 1 / Г∞N.