Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 26 ноября 2022 года; проверки требует 1 правка.
Уде́льная теплота́ плавле́ния (также: энтальпия плавления; также существует равнозначное понятие уде́льная теплота́ кристаллиза́ции) — количество теплоты, которое необходимо сообщить одной единице массы кристаллического вещества в равновесном изобарно-изотермическом процессе, чтобы перевести его из твёрдого (кристаллического) состояния в жидкое (то же количество теплоты выделяется при кристаллизации вещества).
Единица измерения — Дж/кг. Теплота плавления — частный случай теплоты термодинамического фазового перехода.
Расчёт удельной теплоты плавления[править | править код]
Удельная теплота плавления обозначается буквой 
где 

Значения удельной теплоты плавления некоторых веществ[править | править код]
| Вещество | Удельная теплота плавления (кДж/кг) |
|---|---|
| Алюминий | 390 |
| Железо | 247 |
| Золото | 67 |
| Лёд | 333.5 |
| Медь | 213 |
| Нафталин | 151 |
| Олово | 59 |
| Платина | 101 |
| Ртуть | 12 |
| Свинец | 25 |
| Серебро | 105 |
| Цинк | 112 |
| Чугун (белый) | 130 |
| Чугун (серый) | 100 |
См. также[править | править код]
- Молярная теплота плавления
- Энтальпия
- Сублимация
- Удельная теплоёмкость
- Удельная теплота парообразования и конденсации
- Удельная теплота сгорания
Литература[править | править код]
- Енохович А. С. Краткий справочник по физике. — М.: Высшая школа, 1976. — С. 114. — 288 с.
Примечания[править | править код]
- ↑ Atkins, Peter & Jones, Loretta (2008), Chemical Principles: The Quest for Insight (4th ed.), W. H. Freeman and Company, с. 236, ISBN 0-7167-7355-4
- ↑ Hoffer J. K., Gardner W. R., Waterfield C. G., Phillips N. E. Thermodynamic properties of 4He. II. The bcc phase and the P-T and VT phase diagrams below 2 K (англ.) // Journal of Low Temperature Physics (англ.) (рус. : journal. — 1976. — April (vol. 23, no. 1). — P. 63—102. — doi:10.1007/BF00117245. — Bibcode: 1976JLTP…23…63H.
МИНИСТЕРСТВООБРАЗОВАНИЯРОССИЙСКОЙФЕДЕРАЦИИ
ГОСУДАРСТВЕННОЕУЧРЕЖДЕНИЕ
КУЗБАССКИЙГОСУДАРСТВЕННЫЙТЕХНИЧЕСКИЙУНИВЕРСТЕТ
КАФЕДРА ФИЗИКИ
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ И ТЕПЛОТЫ КРИСТАЛЛИЗАЦИИ ОЛОВА
Методические указания к лабораторной работе № 327 по курсу общей физики для подготовки студентов по всем направлениям
Составители В. П. Корчуганов А. А. Мальшин
Утверждены на заседании кафедры Протокол №1 от 30.08.01 Рекомендованы к печати методической комиссией направления 550600 Протокол №3 от 2.10.01 Электронная копия находится в
библиотеке главного корпуса ГУ КузГТУ
Кемерово 2002

tф.п.
1
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ И ТЕПЛОТЫ КРИСТАЛЛИЗАЦИИ ОЛОВА
Данная лабораторная работа относится к разделу «Молекулярная физика и термодинамика», тема «Законы термодинамики».
Перед занятием студент обязан самостоятельно подготовиться к лабораторной работе (см. п. 3). На выполнение и защиту данной работы отводится 2 часа аудиторных занятий.
1.ЦЕЛИ РАБОТЫ:
1)определение изменения энтропии при фазовом переходе на примере кристаллизации олова из расплава при его охлаждении;
2)определение теплоты кристаллизации олова.
2.ПРИБОРЫ И ПРИНАДЛЕЖНОСТИ: модуль стенда, измерительный модуль.
3.ПОДГОТОВКА К РАБОТЕ:
1)прочитать в учебнике [1, §§74,75];
2)изучить данные методические указания;
3)ответить на контрольные вопросы на с. 7.
4.ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
Переход твердого вещества в жидкое состояние (плавление) и обратный переход (кристаллизация) относятся к фазовым превращениям первого рода, при которых скачком изменя-
ются плотность, внутренняя Тпл энергия, энтропия тела. При этом поглощается (при плавлении) или выделяется (при кристаллизации) энергия, называемая теплотой плавления (кристаллизации).
При заданном давлении прямое и обратное фазовые превращения кристаллического вещества происходят при строго определенной температуре, поэтому изобарный фазовый переход одновременно является изотермическим. Одним из возможных способов измерения температуры и теплоты плавления (кристаллизации) является получение диа-

2
граммы плавления (или отвердевания), т.е. кривой зависимости температуры Т исследуемого вещества от времени t при неизменных внешних условиях. Эта кривая качественно показана на рис.1. Правая и левая возрастающие части на рис.1 показывают нагревание твердого образца и ампулы (слева) и нагревание расплава и ампулы (справа). Тепловая мощность на любом из этих участков равна изменению внутренней энергии системы в единицу времени:
|
N = (m c+m c ) |
d T |
, |
(1) |
|
1 1 d t |
где m – масса олова; m1 – масса ампулы; с – удельная теплоемкость оло-
ва; с1 – удельная теплоемкость ампулы; dTdt – скорость изменения тем-
пературы системы.
Горизонтальный участок на рис.1 соответствует процессу плавления металла. Ордината его – температура плавления, а приращение абсциссы – время фазового перехода tф.п.. Для этого случая закон сохранения энергии может быть записан следующим образом:
где λ – удельная теплота плавления олова. Исключив N из формул (1) и (2), найдем:
|
λ = |
m c + m1 c1 |
tф.п. |
d T |
. |
(3) |
|
|
m |
d t |
|||||
Введем изменение энтропии ∆S, определив его следующим обра-
зом:
∆S = ∆TQ ,
где ∆Q = λm, а Т = Тпл. С учетом этого изменение энтропии в процессе плавления (кристаллизации):
где Тпл – температура плавления олова.
Следовательно, для определения теплоты кристаллизации λ и изменения энтропии ∆S в рассматриваемом процессе необходимо из-
мерить Тпл и tф.п., вычислить производную dTdt функции T = f(t) в про-
извольной точке, соответствующей температуре твердого олова в про-
3
цессе его нагревания (охлаждения). Производная dTdt находится из
графика, построенного по экспериментальным данным (кривая охлаждения), а скорость охлаждения образца приблизительно равна:
|
d T |
≈ |
∆T |
. |
(5) |
|||||
|
d t |
|||||||||
|
∆t |
|||||||||
|
5. ОПИСАНИЕ УСТАНОВКИ |
|||||||||
|
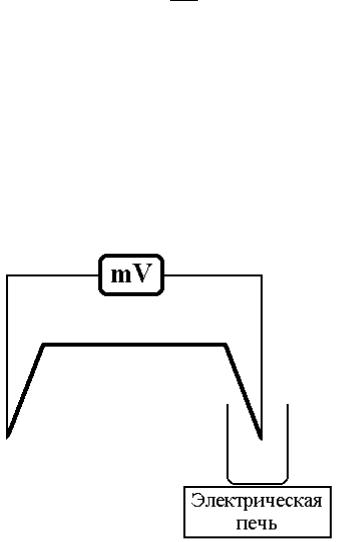
Принципиальная схема установки показана на рис.2. Спай диф- |
|||||||||
|
ференциальной |
термопары |
||||||||
|
2 находится в окружающей |
|||||||||
|
среде с постоянной темпе- |
|||||||||
|
ратурой Т0, а спай 1 нахо- |
|||||||||
|
дится в ампуле с оловом |
|||||||||
|
при температуре Т. Так как |
|||||||||
|
термопары |
включены |
на- |
|||||||
|
встречу друг другу, то мил- |
|||||||||
|
ливольтметр |
показывает |
Т0 |
2 |
Т 1 |
|||||
|
термо ЭДС, |
пропорцио- |
||||||||
|
нальную разности темпера- |
|||||||||
|
тур Т-Т0. Ампула с оловом |
|||||||||
|
нагревается |
в |
электриче- |
Рис.2. Принципиальная схема установки |
||||||
|
ской печи. |
|||||||||
|
Конструктивно |
уста- |
новка состоит (рис.3) из модуля стенда и измерительного модуля, размещенных в унифицированных корпусах.
Вмодуле стенда находится ампула с оловом, которая нагревается
вэлектрической печи, питающейся переменным током. Внутри ампулы находится металлическая трубка-чехол с дифференциальной хромелькопелевой термопарой, горячий спай которой находится в ампуле, а холодный – на воздухе. Выводы термопары соединены с гнездами 2 на лицевой панели стенда. На лицевой панели также расположено окно, в котором на вертикальной штанге установлен ползун, жестко соединенный с ампулой с оловом. Ползун фиксируется на штанге с помощью винта 1. Если, отвернув винт ползуна, опустить ползун вниз до упора, то ампула с оловом опустится в печь. Если же поднять ползун вверх до
4
упора и зафиксировать винтом, то ампула с оловом будет находиться вне печи.
На лицевой панели модуля измерительного стенда расположен мультиметр, милливольтметр которого соединяется с выходными гнездами модуля стенда для измерения электрического сигнала с термопары.
6.ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1.Опустить ампулу с оловом в печь, для чего отвернуть на полоборота винт 1 (рис.3)и опустить ползун вниз по штанге до упора.
2.Соединить проводами гнезда 2 (рис.3) модуля стенда и гнезда «*» и «U» мультиметра измерительного стенда, затем нажать третью снизу кнопку левого вертикального ряда кнопок мультиметра 3, все остальные кнопки должны быть отжаты.
3.Подсоединить к питающей сети 220 В вилки обоих стендов и включить оба стенда с помощью тумблеров «Вкл», «Сеть» на лицевых панелях, а также милливольтметр с помощью движка 4 (сдвинуть вниз), находящегося с правой стороны его панели. Процесс нагревания
иплавления олова занимает около 8 минут.
4.Проследить по показаниям милливольтметра в течение нескольких минут за тем, чтобы олово, находящееся в ампуле, расплавилось. Так как процесс плавления олова происходит при постоянной температуре, то при этом показания милливольтметра практически не изменяются. Окончание процесса плавления можно определить как момент времени, после которого показания милливольтметра начинают возрастать.
5.Через 1,5 минуты после окончания процесса плавления отключить электрическую печь и поднять ампулу с оловом из печи, для чего отвернуть на полоборота винт 1 и поднять ползун по штанге вверх до упора, после этого винт закрутить.
6.Включить секундомер и через каждые 15 секунд снимать показания милливольтметра U, пропорциональные разности температур олова и окружающей среды Т-Т0:
где k=0,0000543В/К для термопары хромель-копель.

5

6
7.Измерения продолжать до тех пор, пока не будут пройдены три области процесса охлаждения: область полного расплава; область кристаллизации; область охлаждения твердого олова. Время опыта – около 10 минут.
8.Результаты измерений занести в таблицу.
|
№ |
U |
(Т-Т0) |
Т |
t |
Тпл |
λ |
∆S |
|
опыта |
мВ |
К |
К |
с |
К |
Дж/кг |
Дж/К |
|
1 |
|||||||
|
2 |
|||||||
|
3 |
|||||||
|
… |
|||||||
|
40 |
9. По данным таблицы построить диаграмму затвердевания олова T=f(t), которая качественно показана на рис.1. Из диаграммы определить температуру плавления олова Тпл, время фазового перехода tф.п. и скорость
изменения температуры системы ddTt , воспользовавшись участком полного
расплава диаграммыиприближеннымсоотношением(5). Затемпоформуле
(3) вычислить удельную теплоту плавления олова λ и изменение энтропии ∆S в процессе кристаллизации по формуле (4). Параметры установки: m = 78 г, m1 = 50 г, с= 230 Дж/(кгК), с1 = 1503 Дж/кгК.
10.Сделать выводы.
7.ИССЛЕДОВАТЕЛЬСКОЕ ЗАДАНИЕ ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ ТЕПЛОТЫ ПЛАВЛЕНИЯ
ЛЬДА КАЛОРИМЕТРИЧЕСКИМ МЕТОДОМ
1.Поместить кусок льда массой m при температуре плавления Т в
алюминиевый калориметр массой m1, содержащий воду массой m2 при температуре Т1. Равновесная температура будет равна Т2. Измерить массы: m, m1, m2; температуры: T1, T2. Удельные теплоемкости льда, воды и алюминия считать известными.
2.Получить рабочую формулу для расчета удельной теплоты
плавления льда λ и рассчитать ее значение.
7
3. Определить абсолютную погрешность измерения данным методом.
8.КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Чем отличается характер плавления кристаллических и аморфных тел?
2.Как опытным путем определить температуру плавления кристаллического твердого вещества?
3.Что такое фаза?
4.Какие превращения называются фазовыми переходами I и II
рода?
5.Приведите примеры фазовых переходов первого рода.
6.Приведите примеры фазовых переходов второго рода.
7.Приведите пример диаграммы равновесия (фазовой диаграммы) вещества в координатах (р, Т).
8.Приведите примеры обратимых и необратимых термодинамических процессов.
9.Сформулируйте второе начало термодинамики.
10.Что такое энтропия?
11.Что такое удельная теплоемкость тела?
12.Каков характер изменения энтропии в обратимых и необратимых процессах?
13.Что такое теплота кристаллизации вещества?
14.Принцип работы термопары.
15.Что такое дифференциальная термопара?
16.Каков вид зависимости термо ЭДС от измеряемой темпера-
туры?
17.Какой температуре пропорциональна термо ЭДС дифференциальной термопары, если один спай находится в окружающей среде, а другой – в расплавленном олове?
18.Какой температуре пропорциональна термо ЭДС дифференциальной термопары, если один спай находится в сосуде со льдом, а другой – в сосуде с кипящей водой?
19.Почему при плавлении кристаллического вещества его температура остается постоянной?
20.Почему при кристаллизации вещества его температура остается постоянной?
8
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1.Трофимова Т.И. Курс физики. -М.: Высш. шк., 2000. – 542 с.
2.Детлаф А.А. Курс физики /А.А. Детлаф, Б.М. Яворский.– М.:
Высш. шк., 2000. – 718 с.
3.Савельев И.В. Курс общей физики. Т.3. -М.: Высш. шк., 1998. –
208 с.
Составители
Валентин Павлович Корчуганов Анатолий Александрович Мальшин
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ И ТЕПЛОТЫ КРИСТАЛЛИЗАЦИИ ОЛОВА
Методические указания к лабораторной работе № 327 по курсу общей физики для подготовки студентов по всем направлениям
Рецензент Г. Б. Исаева
Редактор Е. Л. Наркевич
Л Р № 020313 от 23.12.96
Подписано в печать 03.10.01 Формат 60 × 84/16. Бумага офсетная. Отпечатано на ризографе. Уч. – изд. л. 0,5. Тираж 75 экз. Заказ
ГУ Кузбасский государственный технический университет. 650026, Кемерово, ул. Весенняя, 28.
Типография ГУ Кузбасский государственный технический университет. 650099, Кемерово, ул. Д. Бедного, 4 А.
Для характеристики процесса плавления вводится физическая величина «удельная теплота плавления», показывающая, как изменяется внутренняя энергия тела массой (1) кг при теплообмене.
Удельная теплота плавления обозначается
λ
(греч. буква лямбда).
Обрати внимание!
Единица измерения —
1Джкг
.
Определяют удельную теплоту плавления опытным путём.
Обрати внимание!
Чтобы рассчитать количество теплоты, необходимое для плавления кристаллического тела, нужно удельную теплоту плавления умножить на его массу.
Получим формулы для нахождения удельной теплоты плавления тела и массы тела:
Удельная теплота плавления при нормальном атмосферном давлении некоторых веществ представлена в таблице.
|
Вещество |
Удельная теплота плавления, Джкг |
|
Алюминий |
(3,9) ⋅105 |
|
Лёд |
(3,4) ⋅105 |
|
Железо |
(2,7) ⋅105 |
|
Медь |
(2,1) ⋅105 |
|
Серебро |
(0,87) ⋅105 |
|
Сталь |
(0,84) ⋅105 |
|
Золото |
(0,67) ⋅105 |
|
Олово |
(0,59) ⋅105 |
|
Свинец |
(0,25) ⋅105 |
|
Ртуть |
(0,12) ⋅105 |

