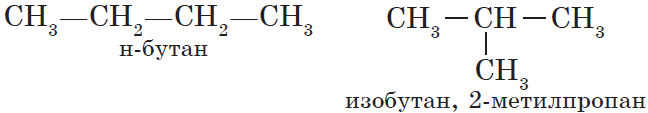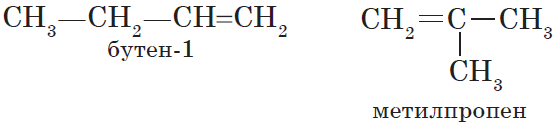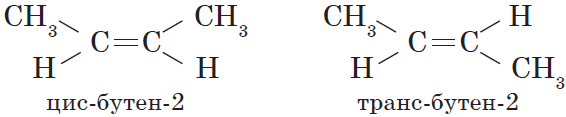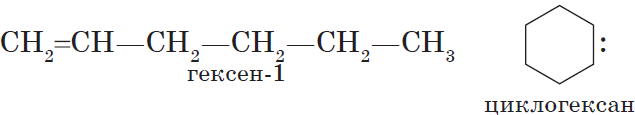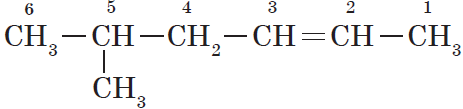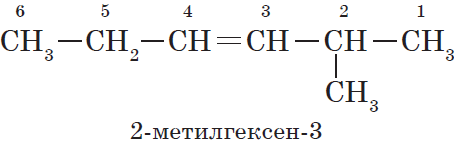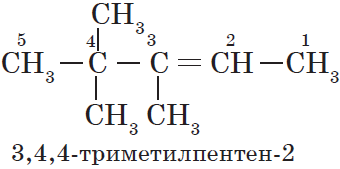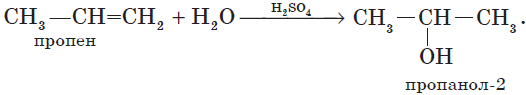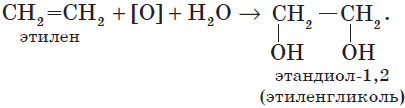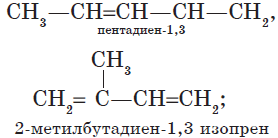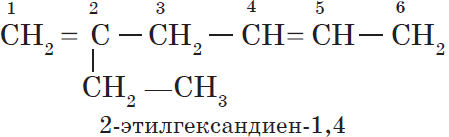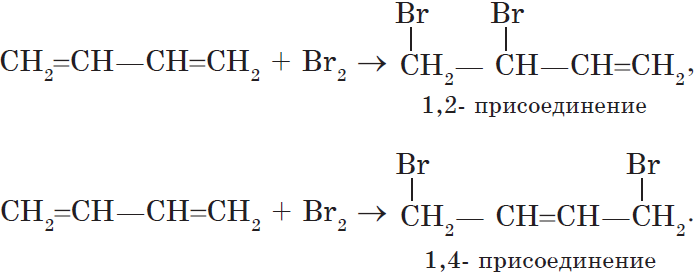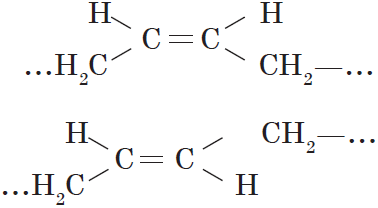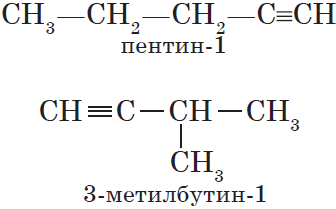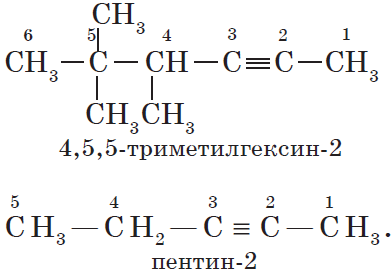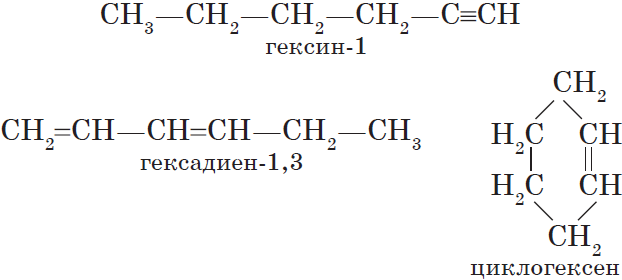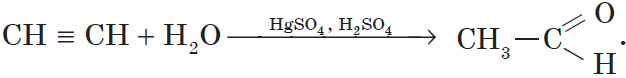В этой статье мы разберем, как составлять молекулярные формулы основных классов органических соединений из информации об особенностях строения (наличие кратных связей, циклов, функциональных групп), и наоборот — как определять общую формулу гомологического ряда веществ с определенными функциональными группами, кратными связями или циклами.
Углеводороды
За основу берем формулу алканов — предельных нециклических углеводородов с одинарными связями между атомами углерода.
В молекуле линейных алканов на каждый атом углерода приходится по два атома водорода плюс по одному дополнительному атому водорода на концах углеродной цепи:
Таким образом, общая формула предельных нециклических углеводородов (алканов) — CnH2n+2.
В алкенах присутствует одна двойная связь. Двойная связь «отщипывает» от молекулы два атома водорода:
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть одна двойная связь (алкенов) CnH2n+2-2 — CnH2n.
Формулы алкенов отличаются от формул алканов с таким же количеством атомов углерода на 2 атома водорода:
C3H8 — C3H6 = 2H
Каждая пара атомов водорода определяет степень ненасыщенности молекулы. Степень ненасыщенности алкенов равна одному.
В алкинах присутствует одна тройная связь. Тройная связь «отщипывает» от молекулы уже четыре атома водорода:
| Ацетилен, этин | H-C≡C-H |
| Пропин | H-C≡C-СH3 |
| Бутин-1 | H-C≡C-СH2-СH3 |
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть одна тройная связь (алкинов): CnH2n+2-4 — CnH2n-2.
Формулы алкинов отличаются от формул алканов с таким же количеством атомов углерода на 4 водорода:
C3H8 — C3H4 = 4H
Степень ненасыщенности алкинов равна двум.
В алкадиенах присутствуют две двойные связи. Две двойные связи «отщипывают» от молекулы уже четыре атома водорода:
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть две двойные связи (алкадиенов): CnH2n+2-4 — CnH2n-2.
Степень ненасыщенности алкадиенов также равна двум.
В циклоалканах присутствуют только одинарные связи и атомы углерода образуют замкнутый цикл. Наличие цикла также уменьшает количество атомов водорода на два:
Таким образом, общая формула циклических углеводородов, в молекулах которых есть только одинарные связи (циклоалканов): CnH2n+2-2 — CnH2n.
В циклоалкенах присутствует одна одинарная связь и атомы углерода образуют замкнутый цикл. Наличие цикла и двойной связи уменьшает количество атомов водорода на четыре:
| Циклобутен |  |
Таким образом, общая формула циклических углеводородов, в молекулах которых есть одна двойная связь (циклоалкенов): CnH2n+2-4 — CnH2n-2.
Этот ряд можно продолжить и дальше:
Алкатриены — содержат три двойные связи, общая формула: CnH2n+2-6 = CnH2n-4
Алкенины — содержат одну двойную и одну тройную связь, общая формула:
CnH2n+2-6 = CnH2n-4
и так далее.
| Класс/группа | Тип связей и наличие цикла | Степень ненасыщенности | Общая формула |
| Алканы |
одинарные связи |
0 | CnH2n+2 |
| Алкены | двойная связь | 1 | CnH2n |
| Алкины | тройная связь | 2 | CnH2n-2 |
| Алкадиены | две двойные связи | 2 | CnH2n-2 |
| Циклоалканы | одинарные связи, цикл | 2 | CnH2n |
| Циклоалкены | двойная связь, цикл | 2 | CnH2n-2 |
| Циклоалкины | тройная связь, цикл | 6 | CnH2n-4 |
| Циклоалкадиены | две двойные связи, цикл | 6 | CnH2n-4 |
Определите молекулярную формулу и степень ненасыщенности гомологического ряда следующих классов органических веществ:
а) алкадиенины
б) циклоалкины
в) циклоалкатриены
г) алкендиины
а) CnH2n-6, степень ненасыщенности 4, не хватает 8 атомов Н до алкана
б) CnH2n-4, степень ненасыщенности 3, не хватает 6 атомов Н до алкана
в)CnH2n-6, степень ненасыщенности 4, не хватает 8 атомов Н до алкана
г) CnH2n-8, степень ненасыщенности 5, не хватает 10 атомов Н до алкана
Эта система работает и наоборот: знание молекулярной формулы можно определить возможный состав вещества.
Например, проанализируем формулу С3Н6.
До формулы алкана не хватает С3Н8 — С3Н6 = 2Н два атома водорода.
Степень непредельности равна одному. То есть в молекуле органического вещества есть либо цикл, либо двойная связь.
Определите возможную структуру (наличие кратных связей, циклов) молекул, которым соответствуют следующие формулы:
а) CnH2n-2
б) CnH2n-4
в) CnH2n-6
г) CnH2n-8
а) CnH2n-2, степень ненасыщенности 4, в молекуле либо две двойные связи, либо цикл и двойная связь, либо тройная связь
б) CnH2n-4, степень ненасыщенности 6, в молекуле либо три двойные связи; цикл и тройная связь; тройная связь и двойная связь и др.
в) CnH2n-6, степень ненасыщенности 8:
4 двойные связи; цикл и 3 двойные связи; две тройные связи; тройная связь и две двойные связи и др.
г) CnH2n-8, степень ненасыщенности 10:
5 двойных связей; цикл и 4 двойные связи и др.
Разработка
урока
по теме: «Генетическая связь между классами
углеводородов»
10
класс (с профильным изучением химии)
Цели и задачи урока
- рассмотреть генетическую связь между типами
углеводородов и классами органических соединений; - обобщить и систематизировать знания учащихся
об углеводородах и их производных на основе сравнительной характеристики
их свойств. - развитие логического мышления, опираясь на
химию углеводородов и их производных. - формирование навыков самообразования у
учащихся.
- развивать у учащихся логическое мышление
(посредством установления генетической связи между разными классами
углеводородов, выдвижения гипотез о химических свойствах незнакомых
органических веществ); - развивать у учащихся способность к сравнению
(на примере сравнения химических свойств углеводородов); - развивать информационно-познавательную
компетентность учащихся; - развивать коммуникативные способности
учащихся, воспитывать умение выслушивать ответы одноклассников.
Методы:
- словесные (беседа),
- практические – составление схем превращений
и их выполнение, - выполнение самостоятельной работы.
Оборудование:
- компьютер,
- мультимедийный проектор,
- интерактивная доска
Д/з 1)§10-16 повторить
2)выполнить все задания к §.
Ход урока
Вводное слово учителя:
органическая химия – наука о жизненно-важных веществах.
Углеводороды имеют большое значение для современных отраслей промышленности,
техники, повседневной жизни людей. Эти вещества, как в индивидуальном
состоянии, так и в виде природных смесей (газ, нефть, уголь), служат сырьем для
производства десятка тысяч более сложных органических соединений, несут в наши
дома тепло и свет. В нашей жизни органические вещества занимают очень большое
место. Без них из обихода исчезли бы многие привычные вещи: изделия из пластмасс
и резины, средства бытовой химии, косметика. Каждый день синтезируются все
новые и новые вещества. Знать все обо всем невозможно. Но можно понять
основные закономерности, которые применяются в превращении органических
веществ.
Большое значение имеют разработки наших русских ученых – Н.Д.Зелинского,
В.В.Марковникова, Б.А.Казанского, М.Г.Кучерова.
Таким
образом, ребята, мы на завершающем (на обобщающем) этапе изучения темы
«Углеводороды». На сегодняшнем уроке займемся установлением генетической связи
между классами углеводородов
В тетрадях запишем
сегодняшнее число 19.12.08 и тему урока:
Генетическая связь между классами
углеводородов.
Запишем
также дом.задание на следующий урок: §10-16 повторить и выполнить все задания
к §10-13.
На уроке мы
должны сформировать целостное представление об углеводородах через изучение
их генетической взаимосвязи систематизировать и корректировать наши знания,
устанавливать причинно-следственную связь через рассмотрение
СОСТАВА → СТРОЕНИЯ
→СВОЙСТВ изученных классов углеводородов. Мы
знаем, что на сегодняшний день их насчитывается более 20 миллионов. В чем
же кроются причины многообразия углеводородов? ( гомологические ряды,
изомерия, способность углерода соединяться в цепи, образовывать кратные связи)
Классификация
углеводородов и их генетическая связь поможет нам объединить в единое целое то,
о чем только что говорили.
УГЛЕВОДОРОДЫ
Непредельные
Предельные Циклические
Алкадиены
Алканы Циклоалканы
СпН2п-2
СпН2п+2 СпН2п
Алкены
Арены
СпН2п
СпН2п-6
Алкины
СпН2п-2
А теперь попробуем сформулировать
отличительные признаки каждой группы углеводородов (предельные
до предела насыщены атомами водорода, не содержат кратных связей или цикла;
непредельные имеют хотя бы одну
двойную или тройную связь между атомами углерода;
циклические содержат замкнутую цепочку углеродных атомов).
Как отличаются
углеводороды по составу? (гомологи различаются на одну или несколько групп
–СН2 – гомологическая разность, непредельные и циклические – меньшим
числом атомов водорода по отношению к углеродным.)
Отсюда можно
сделать важный вывод о том, что углеводороды одного класса можно превратить
в другой класс с помощью присоединения или отщепления атомов водорода. Этот
метод пригоден для большинства переходов, но он не универсален.
Демонстрация
таблицы Стрелками на схеме связаны углеводороды, которые можно превратить друг
в друга одной реакцией.
А сейчас попробуем
осуществить превращения и устанавливать генетическую связь на конкретном
примере (Работа с конвертами).
(проверка цепочек по вариантам:
Карбид кальция → Этин →Бензол →
Циклогексан → Гексан →Пропан
Карбид алюминия →Метан →Этин →Этен → Этан → Хлорэтан
Пропановая кислота →Этан→ Этин →Этин →Бензол →Оксид
углерода (IV)
Осуществите эти
реакции в рабочих тетрадях. Какие типы реакций вы использовали?
Существует ли
взаимосвязь между классами углеводородов? С другими классами органических
соединений? С неорганическими веществами? (Да.
Карбоновые кислоты. Карбиды кальция и алюминия, диоксид улерода.) Ребята,
мы знаем, что углеводороды с 6-12 атомами углерода можно получить из синтез
газа, т.е. из смеси СО и Н2.
Изучение
генетической связи углеводородов было бы неполным без рассмотрения
взаимосвязи состава, строения и свойств изученных нами классов этих соединений.
Используя таблицу-матрицу «Сравнительная характеристика углеводородов»,
попробуем дать сравнительную характеристику углеводородов по составу, строению,
свойствам.
Алкадиены сюда не
включены, т.к. они во многом родственны с алкенами.
(Обратим внимание!!!)
1) Ключевые С – это атомы углерода,
определяющие принадлежность вещества к тому или иному классу углеводородов.
2) Строка,
касающаяся взаимодействия с галогенами, на что здесь необходимо обратить
внимание? Важно запомнить!!! От условий реакции зависит возможность её
осуществления (алкан + бромная вода – нет реакции; алкан + газообр. Бром при
освещении есть реакция), так и направление протекания процесса (гомологи
бензола на свету бромируются по боковой цепи, в присутствие катализатора – по
кольцу).
Уравнения
реакций на доске.
Таким образом,
сегодня мы с вами убедились в том, что существует тесная взаимосвязь между
классами углеводородов. Используя определенные реагенты и условия, мы можем их
превратить друг в друга. Дома вы должны были составить свою цепочку
превращений, устанавливающую генетическую связь между отдельными классами
углеводородов. Удалось ли это вам? (Оценки за урок!!!)
А теперь, с целью закрепления,
используя таблицу-матрицу выполним задание. (Объяснение задания, совместное решение
с ребятами заданий 1в – 5, 2в – 7)
Ответы
|
№ |
Вариант |
№ |
Вариант |
|
1 |
1а, 2б, 3а, 3в, 3д, 4г, 5г, 5д |
1 |
1б, 2в, 3б, 4г, 4д, 5в |
|
2 |
1б, 2в |
2 |
1а, 2б, 3в, 3д |
|
3 |
2е, 3е, 4е, |
3 |
5е |
|
4 |
4г, 4г, 5д, 5г, 3а, 3а, 3а |
4 |
1з |
|
5 |
5з |
5 |
6з |
|
6 |
3а, 4г, 5г |
6 |
3а, 4г, 5г, 5д |
|
7 |
а) 1а, 2б, 3в,3д, 4г б) 3б, 5г, 5д |
7 |
7г |
|
8 |
6ж |
8 |
3и, 4и, 8и |
|
9 |
а) 7а б) 8в |
9 |
1ж или 4ж |
|
10 |
8е |
10 |
2е, 3е, 4е, 5е |
|
11 |
3а, 4г, 5г, 5д |
11 |
Да |
|
12 |
3г, 4г |
12 |
5и, 9и |
|
13 |
9б, 9в, 9е, 9ж |
13 |
9а, 9г, 9д, 9ж |
|
14 |
1б |
14 |
6е |
|
15 |
6е |
15 |
2е, 3е, 4е |
Вопросы к таблице-матрице «Сравнительная
характеристика углеводородов»:
Вариант 1
1. Представители
предельных углеводородов.
2. Алкены, не имеющие
изомеров.
3. Общая формула
непредельных углеводородов.
4. Изобутан,
2-метилпропан, 2,2-диметилпропан, 2,3-диметилбутан, 2,2-диметилпентан, 3,3-диметилпентан,
2,4-диметилпентан.
5. Как называют
вещества, сходные по составу, но отличающиеся по строению?
6. Алканы, для
которых характерна изомерия углеродного скелета.
7. Гомологи метана,
имеющие при н. у. а) газообразное, б) жидкое состояние.
8. Типы связей в
алкинах.
9.Численное значение
а) углов НСН в алканах; б) длины углерод-углеродных связей.
10. Частицы,
инициирующие реакции замещения алканов.
11.Для каких алканов
осуществима реакция 9г?
12. Продукты крекинга
октана.
13.Характерные
реакции для алкенов.
14.Может быть получен
гидрированием этина.
15.Структуру его
молекулы впервые предложил Ф.А.Кекуле.
Вариант 2
1.Представители ряда
алкенов.
2.Алканы, не имеющие
изомеров.
3.Общая формула
ароматических углеводородов.
4.Сколько веществ
скрывается под формулой 2б?
5. Чем являются по
отношению друг к другу вещества ряда этина?
6. Алканы, для
которых в справочнике можно найти несколько значений tпл, tкип и растворимости.
7. Тип гибридизации
атомных орбиталей в алкинах.
8.Вещества,
реагирующие с алканами.
9. Какие связи рвутся
при горении алканов?
10. Для каких
углеводородов характерна реакция с 1и?
11.Подвергаются ли
предельные углеводороды реакциям 9е?
12.Какие продукты при
этом образуются?
13. Характерные
реакции для алканов.
14. Может быть получен
тримеризацией ацетилена.
15. Для данного
класса углеводородов характерна реакция полимеризации.
Список литературы:
- Габриелян О.С., Остроумов И.Г. Настольная
книга учителя химии 10 класс: учебное пособие для учителей и студентов
старших курсов педагогических вузов. – М.: Блик и К0, 2001. - Габриелян О.С., Маскаев Ф.Н., Пономарев
С.Ю., Теренин В.И. Химия 10 класс: учебник для общеобразовательных учебных
заведений. – М.: Дрофа, 2010. - Новошинский И.И., Новошинская Н.С.
Органическая химия. 11 класс. Базовый уровень: Учебник для
общеобразовательных учреждений. – М.: ООО «ТИД «Русское слово» – РС»,
2007.
Учитель химии
МОБУ Гимназия №2 с.Бураево
Алиева Э. Х.
Учитель:
Какие классы углеводородов вы знаете, называйте сразу с общей формулой.
Таблица «Классификация веществ»
Ответить на вопросы:
Учитель:
– Чем отличаются по составу углеводороды разных типов?
Учащиеся (числом
атомов водорода)
Учитель:
– Какие реакции следует провести, чтобы из одного типа
углеводородов получить другой?
Учащиеся:
(Реакции гидрирования или
дегидрирования.
Так можно осуществить большинство переходов, однако, этот
способ получения углеводородов не является универсальным. Стрелками в
схеме указаны углеводороды, которые непосредственно можно превратить друг в
друга одной реакцией).
Учитель:
Схематически это выглядит так:
Задание: для
закрепления изученного материала осуществите несколько цепочек превращения.
Определите тип каждой реакции:
Учитель: А
теперь давайте поработаем во Flash – программе:
http://school-collection.edu.ru/catalog/res/0abbb096-4185-11db-b0de-0800200c9a66/view/
Учитель: Вы знаете, что
генетическая взаимосвязь существует не только между углеводородами, но и между
их производными – кислородосодержащими органическими веществами, которые в
промышленных масштабах получают из продуктов переработки нефти, газа и
угля. Давайте выявим эту взаимосвязь на примере цепочек превращения:
1)
Далее учащиеся выполняют это превращение по алгоритму в
рабочих тетрадях, на обычной доске или на интерактивной доске в «режиме белой
доски».
Работа учащегося на интерактивной доске.
Это позволяет осуществить целенаправленный синтез заданных
соединений, используя ряд необходимых химических реакций (цепь превращений)
Учитель: http://school-collection.edu.ru/catalog/res/0abbb097-4185-11db-b0de-0800200c9a66/view/
1)Сначала просматриваем весь фрагмент.
2) Потом учитель останавливает кадр на определенном моменте, а
учащиеся составляют превращение блоками – самостоятельно на доске.
3) Когда превращение составлено, осуществляем его с помощью записи
уравнений реакций по алгоритму действий.
Фрагмент видео-сюжета.
Задание: составить уравнения реакций, указать условия
протекания и тип реакций.
Вывод: Сегодня на
уроке – на примере генетической связи органических веществ разных
гомологических рядов мы увидели и доказали с помощью превращений – единство
материального единства мира.
Домашнее задание:
Решить задачу: Дано 2
моль этилового спирта.
Сколько образуется 1 ряд – грамм дибромэтана;
2 ряд – литров углекислого газа
3 ряд – грамм этиленгликоля;
Повторить темы по гомологии и изомерии: составить формулы
одного и двух изомеров состава .
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 декабря 2021 года; проверки требуют 8 правок.
Не следует путать с термином «углеводы».
Метан CH4, простейший углеводород
Углеводоро́ды — органические соединения, состоящие из атомов углерода и водорода[1].
Углеводороды служат фундаментальной основой органической химии — молекулы любых других органических соединений рассматривают как их производные.
Если в углеводороде один или несколько атомов водорода замещён на другой атом или группу атомов, называемую функциональной группой, то данное соединение называется производным углеводорода.[источник не указан 447 дней]
Поскольку углерод (C) в возбуждённом состоянии имеет четыре валентных электрона, а водород (H) — один, в соответствии с правилом октета молекула простейшего насыщенного углеводорода — CH4 (метан). При систематизации углеводородов принимают во внимание строение углеродного скелета и тип связей, соединяющих атомы углерода. В зависимости от строения углеродного скелета, углеводороды подразделяют на ациклические и карбоциклические. В зависимости от кратности углерод-углеродных связей, углеводороды подразделяют на предельные (алканы) и непредельные (алкены, алкины, диены). Циклические углеводороды разделяют на: алициклические и ароматические.
Большинство углеводородов в природе Земли встречаются в сырой нефти[2][3]. Также углеводороды делятся на несколько групп:
| Ациклические (с открытой цепью) | Карбоциклические (с замкнутой цепью) | ||||
|---|---|---|---|---|---|
| предельные | непредельные | предельные | непредельные | ||
| с одинарной связью | с двойной связью | с тройной связью | с двумя двойными связями | с одинарной связью | с бензольным кольцом |
| ряд метана (алканы) | ряд этилена (алкены) | ряд ацетилена (алкины) | ряд диеновых углеводородов | ряд полиметиленов (нафтены) | ряд бензола (ароматические углеводороды, или арены) |
Углеводороды, как правило, не смешиваются с водой, поскольку атомы углерода и водорода имеют близкую электроотрицательность, и связи в углеводородах малополярны. Для предельных углеводородов характерны химические реакции замещения, а для непредельных — присоединения.
Основные источники углеводородов — нефть, природный и сланцевый газ, каменный уголь.
Сравнительная таблица углеводородов[править | править код]
| Характеристика | Алканы | Алкены | Алкины | Алкадиены | Циклоалканы | Арены |
|---|---|---|---|---|---|---|
| Общая формула | CnH2n+2 | CnH2n | CnH2n-2 | CnH2n-2 | CnH2n | CnH2n-6 |
| Строение | sp3-гибридизация — 4 электронных облака направлены в вершины тетраэдра под углами 109°28′. Тип углеродной связи — σ-связи | sp2-гибридизация, валентный угол 120°.Тип углеродной связи — π-связи. lc-c — 0,134 нм. | sp-гибридизация, молекула плоская (180°), тройная связь, lc-c — 0,120 нм. | lc-c — 0,132 нм — 0,148 нм, 2 или более π-связей. У каждого атома три гибридные sp2-орбитали. | sp3-гибридизация, валентный угол около 100° lc-c — 0,154 нм. | Строение молекулы бензола (6 р-электронов, n = 1), Валентный угол 120° lc-c — 0,140 нм, молекула плоская (6 π | σ) |
| Изомерия | Изомерия углеродного скелета, возможна оптическая изомерия | Изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная | Изомерия углеродного скелета, положения тройной связи, межклассовая | Изомерия углеродного скелета, положения двойной связи, межклассовая и цис-транс-изомерия | Изомерия углеродного скелета, положения двойной связи, межклассовая и цис-транс-изомерия | Изомерия боковых цепей, а также их взаимного положения в бензольном ядре |
| Химические свойства | Реакции замещения (галогенирование, нитрирование), окисления, радикальное галогенирование CH4 + Cl2 → CH3Cl + HCl (хлорметан), горения, отщепления (дегидрирование) | Реакции присоединения (гидрирование, галогенирование, гидрогалогенирование, гидратация), горения | Реакции присоединения (гидрирование, галогенирование, гидрогалогенирование, гидратация), горения | Реакции присоединения | Для колец из 3-4 атомов углерода — раскрытие кольца | Реакции электрофильного замещения |
| Физические свойства | С CH4 до C4H10 — газы; с C5H12 до C15H32 — жидкости; после C16H34 — твёрдые тела. | С C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. | Алкины по своим физическим свойствам напоминают соответствующие алкены | Бутадиен — газ (t кип −4,5 °C), изопрен — жидкость, кипящая при 36 °C, диметилбутадиен — жидкость, кипящая при 70 °C. Изопрен и другие диеновые углеводороды способны полимеризоваться в каучук | С C3H6 до C4H8 — газы; с C5H10 до C16H32 — жидкости; после C17H34 — твёрдые тела. | Все ароматические соединения — твёрдые или жидкие вещества. Отличаются от алифатических и алициклических аналогов высокими показателями преломления и поглощения в близкой УФ и видимой области спектра |
| Получение | Восстановление галогенпроизводных алканов, восстановление спиртов, восстановление карбонильных соединений, гидрирование непредельных углеводородов, Реакция Вюрца. | Каталитический и высокотемпературный крекинг углеводородов нефти и природного газа, реакции дегидратации соответствующих спиртов, дегидрогалогенирование и дегалогенирование соответствующих галогенпроизводных | Основным промышленным способом получения ацетилена является электро- или термокрекинг метана. Пиролиз природного газа и карбидный метод. | Постадийное дегидрирование алканов, дегидрирование спиртов. | Гидрирование ароматических углеводородов, отщепление двух атомов галогена от дигалогеналканов | Дегидрирование циклогексана, тримеризация ацетилена, выделение из нефти |
См. также[править | править код]
- Углеводы
Примечания[править | править код]
- ↑ Silberberg, Martin. Chemistry: The Molecular Nature Of Matter and Change (англ.). — New York: McGraw-Hill Companies, 2004. — ISBN 0-07-310169-9.
- ↑ Clayden, J., Greeves, N., et al. (2001) Organic Chemistry Oxford ISBN 0-19-850346-6 p. 21
- ↑ McMurry, J. (2000). Organic Chemistry 5th ed. Brooks/Cole: Thomson Learning. ISBN 0-495-11837-0 pp. 75–81
Алканы
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле $С_{n}Н_{2n+2}$.
Гомологический ряд метана
Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп $СН_2$.
Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан:
Рассмотрим подробнее для алканов основы номенклатуры ИЮПАК:
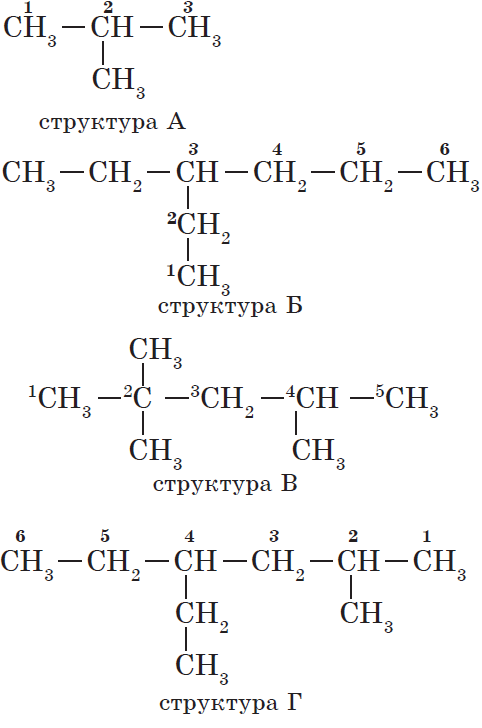
1. Выбор главной цепи.
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи.
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—$СН_3$), затем пропил ($—СН_2—СН_2—СН_3$), этил ($—СН_2—СН_3$) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия.
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую ($2.2-$). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д.).
Названия веществ, структурные формулы которых приведены выше, следующие:
— структура А: $2$-метилпропан;
— структура Б: $3$-этилгексан;
— структура В: $2,2,4$-триметилпентан;
— структура Г: $2$-метил $4$-этилгексан.
Физические и химические свойства алканов
Физические свойства. Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах газа, почувствовав который, надо звонить $104$, определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах, для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от $С_5Н_{12}$ до $С_{15}Н_{32}$ — жидкости; более тяжелые углеводороды — твердые вещества.
Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства.
1. Реакции замещения. Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения наиболее характерных реакций.
Галогенирование:
$CH_4+Cl_2→CH_3Cl+HCl$.
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
$CH_3Cl+Cl_2→HCl+{CH_2Cl_2}↙{text”дихлорметан(хлористый метилен)”}$,
$CH_2Cl_2+Cl_2→HCl+{CHСl_3}↙{text”трихлорметан(хлороформ)”}$,
$CHCl_3+Cl_2→HCl+{CCl_4}↙{text”тетрахлорметан(четыреххлористый углерод)”}$.
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
2. Дегидрирование (отщепление водорода). В ходе пропускания алканов над катализатором ($Pt, Ni, Al_2O_3, Cr_2O_3$) при высокой температуре ($400–600°С$) происходит отщепление молекулы водорода и образование алкена:
$CH_3—CН_3→СH_2=CH_2+Н_2↑$
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
$СН_4+2О_2→СО_2+2Н_2O+880 кДж.$
В общем виде реакцию горения алканов можно записать следующим образом:
$C_{n}H_{2n+2}+({3n+1}/{2})O_2→nCO_2+(n+1)H_2O$
Термическое расщепление углеводородов:
$C_{n}H_{2n+2}{→}↖{400-500°C}C_{n-k}H_{2(n-k)+2}+C_{k}H_{2k}$
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов:
$R—CH_2CH_2:CH_2—R→R—CH_2CH_2·+·CH_2—R$.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
$R—CH_2CH_2·+·CH_2—R→R—CH=CH_2+CH_3—R$.
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
При нагревании метана до температуры $1000°С$ начинается пиролиз метана — разложение на простые вещества:
$CH_4{→}↖{1000°C}C+2H_2↑$
При нагревании до температуры $1500°С$ возможно образование ацетилена:
$2CH_4{→}↖{1500°C}CH=CH+3H_2↑$
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
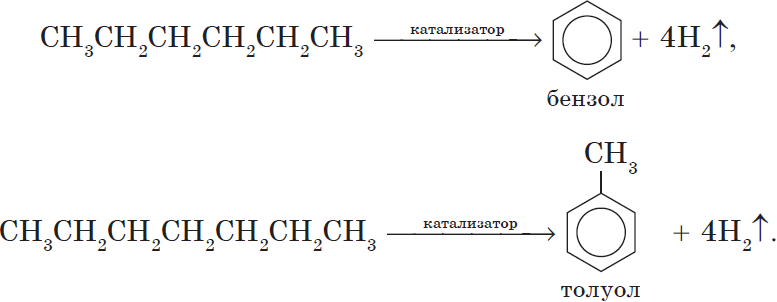
5. Ароматизация. Алканы с шестью и более углеродными атомами в цепи в присутствии катализатора циклизируются с образованием бензола и его производных:
В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии $sp^3$-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных $С—С$ (углерод — углерод) связей и слабополярных $С—Н$ (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т.е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т.к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Алкены
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкадиены (полиены), алкины. Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство непредельности связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов.
Алкены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n}$.
Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от лат. oleum — масло).
Гомологический ряд этена
Неразветвленные алкены составляют гомологический ряд этена (этилена):
$С_2Н_4$ — этен, $С_3Н_6$ — пропен, $С_4Н_8$ — бутен, $С_5Н_{10}$ — пентен, $С_6Н_{12}$ — гексен и т. д.
Изомерия и номенклатура
Для алкенов, так же, как и для алканов, характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:
Особым видом структурной изомерии является изомерия положения двойной связи:
$СН_3—{СН_2}↙{бутен-1}—СН=СН_2$ $СН_3—{СН=СН}↙{бутен-2}—СН_3$
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис-транс изомерии.
Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости $π$-связи, а следовательно, и свойствами.
Алкены изомерны циклоалканам (межклассовая изомерия), например:
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения:
$5$-метилгексен-$2$, а не $2$-метилгексен-$4$, как можно было бы предположить.
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей, так же, как для предельных углеводородов.
3. Формирование названия.
Названия алкенов формируются так же, как и названия алканов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, — -ен.
Например:
Физические и химические свойства алкенов
Физические свойства. Первые три представителя гомологического ряда алкенов — газы; вещества состава $С_5Н_{10}$ – $С_{16}Н_{32}$ — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства.
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
$CH_3—CH_2—CH=CH_2+H_2{→}↖{Pt}CH_3—CH_2—CH_2—CH_3$.
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т.к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе ($CCl_4$) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалоген алканов:
$СН_2=СН_2+Br_2→CH_2Br—CH_2Br$.
3. Гидрогалогенирование (присоединение галогеноводорода).
$CH_3-{CH}↙{пропен}=CH_2+HBr→CH_3-{CHBr}↙{2-бромпропен}-CH_3$
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т.е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды).
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
${CH_2}↙{этен}=CH_2+H_2O{→}↖{t,H_3PO_4}CH_3-{CH_2OH}↙{этанол}$
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
$nCH_2{=}↙{этен}CH_2{→}↖{УФ-свет,R}(…{-CH_2-CH_2-}↙{полиэтилен}…)_n$
Эта реакция присоединения протекает по свободнорадикальному механизму.
6. Реакция окисления.
Как и любые органические соединения, алкены горят в кислороде с образованием $СО_2$ и $Н_2О$:
$СН_2=СН_2+3О_2→2СО_2↑+2Н_2О$.
В общем виде:
$C_{n}H_{2n}+{3n}/{2}O_2→nCO_2↑+nH_2O$
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
Алкадиены (диеновые углеводороды)
Алкадиены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные связи между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n-2}$.
В зависимости от взаимного расположения двойных связей различают три вида диенов:
— алкадиены с кумулированным расположением двойных связей:
$CH_2=C=CH_2$;
— алкадиены с сопряженными двойными связями;
$CH_2=CH—CH=CH_2$;
— алкадиены с изолированными двойными связями
$CH_2=CH—CH_2—CH=CH_2$.
Эти все три вида алкадиенов существенно отличаются друг от друга по строению и свойствам. Центральный атом углерода (атом, образующий две двойные связи) в алкадиенах с кумулированными связями находится в состоянии $sp$-гибридизации. Он образует две $σ$-связи, лежащие на одной прямой и направленные в противоположные стороны, и две $π$-связи, лежащие в перпендикулярных плоскостях. $π$-Связи образуются за счет негибридизированных р-орбиталей каждого атома углерода. Свойства алкадиенов с изолированными двойными связями весьма специфичны, т.к. сопряженные $π$-связи существенно влияют друг на друга.
р-Орбитали, образующие сопряженные $π$-связи, составляют практически единую систему (ее называют $π$-системой), т.к. р-орбитали соседних $π$-связей частично перекрываются.
Изомерия и номенклатура
Для алкадиенов характерна как структурная изомерия, так и цис-, транс-изомерия.
Структурная изомерия.
— изомерия углеродного скелета:
— изомерия положения кратных связей:
${CH_2=CH—CH=CH_2}↙{бутадиен-1,3}$ ${CH_2=C=CH—CH_3}↙{бутадиен-1,2}$
Цис-, транс-изомерия (пространственная и геометрическая)
Например:
Алкадиены изомерны соединениям классов алкинов и циклоалкенов.
При формировании названия алкадиена указывают номера двойных связей. Главная цепь должна обязательно содержать две кратные связи.
Например:
Физические и химические свойства алкадиенов
Физические свойства.
В обычных условиях пропандиен-1,2, бутадиен-1,3 — газы, 2-метилбутадиен-1,3 — летучая жидкость. Алкадиены с изолированными двойными связями (простейший из них — пентадиен-1,4) — жидкости. Высшие диены — твердые вещества.
Химические свойства.
Химические свойства алкадиенов с изолированными двойными связями мало отличаются от свойств алкенов. Алкадиены с сопряженными связями обладают некоторыми особенностями.
1. Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
Особенностью присоединения к алкадиенам с сопряженными связями является способность присоединять молекулы как в положениях 1 и 2, так и в положениях 1 и 4.
Соотношение продуктов зависит от условий и способа проведения соответствующих реакций.
2. Реакция полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Полимеризация этих соединений является основой синтетических каучуков:
$nCH_2={CH—CH=CH_2}↙{бутадиен-1,3}→{(… —CH_2—CH=CH—CH_2— …)_n}↙{text”синтетический бутадиеновый каучук”}$.
Полимеризация сопряженных диенов протекает как 1,4-присоединение.
В этом случае двойная связь оказывается центральной в звене, а элементарное звено, в свою очередь, может принимать как цис-, так и транс-конфигурацию.
Алкины
Алкины — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n-2}$.
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена):
$С_2Н_2$ — этин, $С_3Н_4$ — пропин, $С_4Н_6$ — бутин, $С_5Н_8$ — пентин, $С_6Н_{10}$ — гексин и т. д.
Изомерия и номенклатура
Для алкинов, так же как и для алкенов, характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
$СН_3—{СН_2}↙{бутин-1}—С≡СН$ $СН_3—{С≡С}↙{бутин-2}—СН_3$
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:
Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс-) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом -ин, а ее положение в цепи — номером атома углерода.
Например:
Алкинам изомерны соединения некоторых других классов. Так, химическую формулу $С_6Н_{10}$ имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):
Физические и химические свойства алкинов
Физические свойства. Температуры кипения и плавления алкинов, так же, как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Химические свойства.
Реакции присоединения. Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения.
1. Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома):
$CH≡CH+Br_2→{CHBr=CHBr}↙{1,2-дибромэтан},$
$CHBr=CHBr+Br_2→{CHBr_2-CHBr_2}↙{1,1,2,2-тетрабромэтан}$
2. Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идет в две стадии, причем на обеих стадиях выполняется правило Марковникова:
$CH_3-C≡CH+Br→{CH_3-CBr=CH_2}↙{2-бромпропен},$
$CH_3-CBr=CH_2+HBr→{CH_3-CHBr_2-CH_3}↙{2,2-дибромпропан}$
3. Гидратация (присоединение воды). Боль шое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:
4. Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов ($Pt, Pd, Ni$):
$R-C≡C-R+H_2{→}↖{Pt}R-CH=CH-R,$
$R-CH=CH-R+H_2{→}↖{Pt}R-CH_2-CH_2-R$
Так как тройная связь содержит две реакционноспособные $π$-связи, алканы присоединяют водород ступенчато:
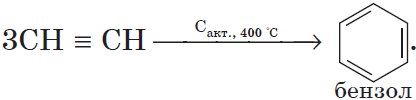
1) тримеризация.
При пропускании этина над активированным углем образуется смесь продуктов, одним из которых является бензол:
2) димеризация.
Помимо тримеризации ацетилена, возможна его димеризация. Под действием солей одновалентной меди образуется винилацетилен:
$2HC≡CH→{HC≡C-CH=CH_2}↙{text”бутен-1-ин-3(винилацетилен)”}$
Это вещество используется для получения хлоропрена:
$HC≡C-CH=CH_2+HCl{→}↖{CaCl}H_2C={CCl-CH}↙{хлоропрен}=CH_2$
полимеризацией которого получают хлоропреновый каучук:
$nH_2C=CCl-CH=CH_2→(…-H_2C-CCl=CH-CH_2-…)_n$
Окисление алкинов.
Этин (ацетилен) горит в кислороде с выделением очень большого количества теплоты:
$2C_2H_2+5O_2→4CO_2↑+2H_2O+2600кДж$ На этой реакции основано действие кислородно-ацетиленовой горелки, пламя которой имеет очень высокую температуру (более $3000°С$), что позволяет использовать ее для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, т.к. содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленные растворы перманганата калия; при этом происходит разрушение кратной связи.
Итак, Вы закончили
просмотр теории по химии углеводородов
– основополагающего раздела органической
химии. Какой вывод можно сделать на
основании изложенного материала?
Очевидно, следующий:
свойства
углеводородов зависят от химического,
пространственного, электронного строения
молекул и характера химических связей.
Определяющую роль
в особенностях строения и свойств
отдельных типов углеводородов играет
вид гибридизации атомных орбиталей
углерода, которая изменяется при переходе
от одной разновидности углеводородов
к другой. Общие характеристики
углеводородов можно представить в
сводной таблице:
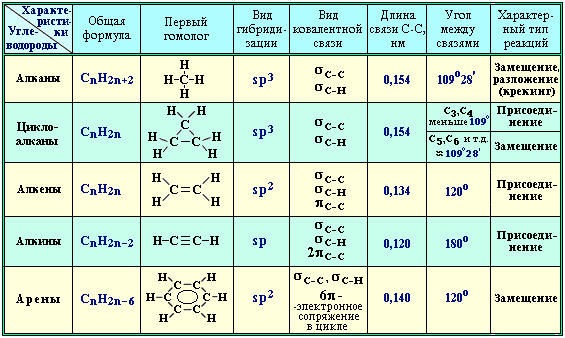
Изучение
строения, химических свойств и способов
получения углеводородов различных
групп показывает, что все они генетически
связаны
между собой, т.е. возможны превращения
одних углеводородов в другие:
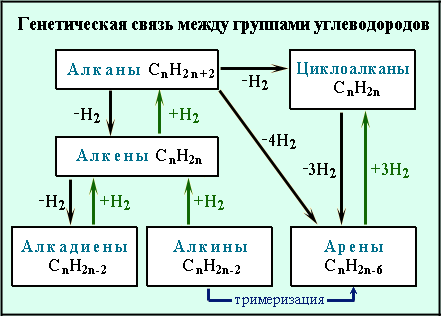
Это позволяет
осуществлять целенаправленный синтез
заданных соединений, используя ряд
необходимых химических реакций (цепь
превращений).
* * *
Для
закрепления учебного материала и
активизации учебной деятельности
рекомендуется обратить особое внимание
на решение
задач.
По характеру выполняемых действий
химические задачи подразделяются на
две основные категории: расчетные и
качественные задачи. Различные сочетания
действий используются в комбинированных
задачах.
Расчетные задачи, в которых
вычисляются параметры и характеристики
веществ по их формулам и уравнениям
реакций, рассматриваются в разделе
III “Методика решения задач”.
Качественные
задачи (или упражнения) основаны на
умении применить знания о свойствах
соединений, способах их получения,
условиях протекания химических реакций
и не связаны с числовыми операциями.
Такие задачи помогают усвоить фактический
материал органической химии.
Среди
качественных задач можно выделить
следующие типы:
а) задачи на
распознавание веществ (качественные
реакции);
б) задачи на разделение
смесей веществ с помощью химических
реакций;
в) задачи, связанные с
взаимными превращениями веществ (цепочки
превращений).
Упражнения
по расшифровке цепей превращений (тип
“в”) помогают лучше понять генетические
связи между органическими соединениями.
После изучения темы “Углеводороды”
следует обратить внимание на решение
именно этого типа задач (см. пример).
Задача.
Назовите промежуточные продукты в
следующей схеме превращений:
Решение.
В данной цепи превращений, включающей
4 реакции, из этилового спирта С2Н5ОН
должен быть получен бутадиен-1,3
СН2=СН–СН=СН2.
-
При
нагревании спиртов с концентрированной
серной кислотойH2SO4
(водоотнимающее средство) происходит
их дегидратация
с образованием алкена (раздел
4.5. Получение алкенов).
Отщепление воды от этилового спирта
приводит к образованию этилена:
Таким
образом, вещество Х,
образующееся при дегидратации этилового
спирта и способное прореагировать с
НBr, является этиленом СН2=СН2.
-
Этилен
– представитель алкенов. Являясь
ненасыщенным соединением, он способен
вступать в реакции присоединения
(раздел
4.4.1).
В результате гидробромирования
этилена:
образуется
бромэтан СН3–СН2–Br
(вещество Y):
-
При
нагревании бромэтана в присутствии
металлического натрия (реакция
Вюрца,
раздел
2.7)
образуется н-бутан (вещество Z):
-
Дегидрирование
н-бутана в присутствии катализатора –
один из способов получения бутадиена-1,3
СН2=СН–СН=СН2(раздел
5.4. Получение алкадиенов).
Ответ:
X
– этилен СН2=СН2;
Y
– бромэтан СН3–СН2–Br;
Z
– н-бутан СН3–СН2–СН2–СН3
.
Cхема превращений:
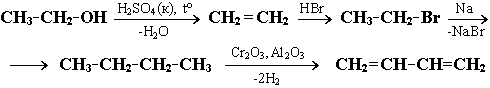
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #