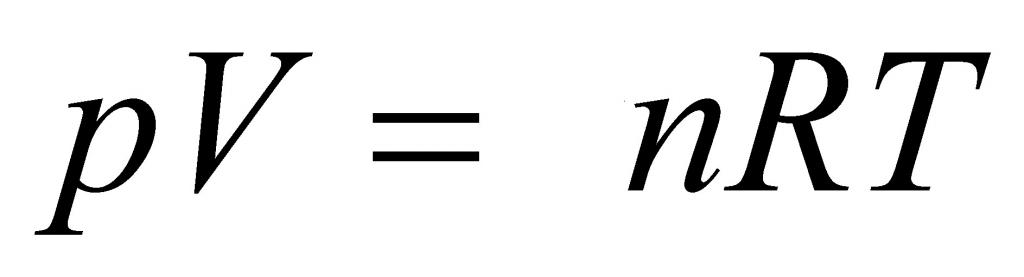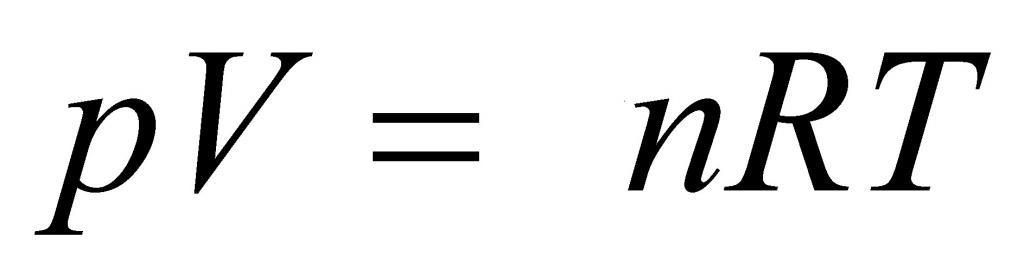Универса́льная га́зовая постоя́нная — константа, численно равная работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К. Равна произведению постоянной Больцмана на число Авогадро. Обозначается латинской буквой R.
Общая информация[править | править код]
И. П. Алымов (1865)[1][2][3], Цейнер (1866)[4], Гульдберг (1867)[5], Горстман (1873)[6] и Д. И. Менделеев (1874)[7][2][3] пришли к выводу, что произведение индивидуальной для каждого газа постоянной в уравнении Клапейрона на молекулярный вес μ газа должно быть постоянной для всех газов величиной. Д. И. Менделеев вычислил[8][9] значение константы R, используя закон Авогадро, согласно которому 1 моль различных газов при одинаковом давлении и температуре занимает одинаковый объём 
Входит в уравнение состояния идеального газа


В Международной системе единиц (СИ) универсальная газовая постоянная, в силу точно установленных численных значений постоянных Авогадро и Больцмана, в точности равна
- R = 8,314 462 618 153 24 Дж/(моль∙К).
В системе СГС универсальная газовая постоянная равна R = 83 144 626,181 532 4 эрг/(моль∙К) (точно).
Универсальная газовая постоянная равна разности молярных теплоёмкостей идеального газа при постоянном давлении и постоянном объёме: 

У идеального газа показатель адиабаты связан с числом степеней свободы f молекулы соотношением 




Эти соотношения обусловлены законом равнораспределения энергии по степеням свободы, утверждающим, что в тепловом равновесии при температуре T на одну степень свободы вращательного и поступательного движения молекулы приходится в среднем энергия, равная (1/2)kT, а на одну колебательную степень свободы — энергия kT[10]; здесь k — постоянная Больцмана. Для большинства двухатомных газов при комнатной температуре колебательные степени свободы не возбуждаются (это проявление квантового характера осцилляций молекулы), и их не нужно учитывать. При увеличении температуры на 1 К при постоянном объёме энергия каждой молекулы газа по каждой кинетической степени свободы в среднем увеличивается на k/2, а энергия 1 моля газа (число Авогадро молекул, NA) — на NAk/2. Так, энергия молекулы одноатомного газа увеличивается на 


Универсальная газовая постоянная возникает и в приложениях термодинамики, относящихся к жидкостям и твёрдым телам. Так, эмпирический закон Дюлонга — Пти утверждает, что при комнатной температуре молярная теплоёмкость твёрдых простых веществ близка к 3R. Он объясняется тем, что атом в кристаллической решётке имеет три колебательные степени свободы, то есть согласно закону равнораспределения на каждый атом приходится в среднем 3kT/2 кинетической и столько же потенциальной энергии. Отсюда моль атомов обладает тепловой энергией 
Иногда рассматривается также индивидуальная газовая постоянная конкретного газа, равная отношению R к молекулярной массе данного газа (или к средней молекулярной массе смеси газов): R′ = R / μ. Для сухого воздуха R′ ≈ 287 Дж/(кг∙К), для водорода 4125 Дж/(кг∙К).
Связь между газовыми константами[править | править код]
Как показано выше, универсальная газовая постоянная выражается через произведение постоянной Больцмана на число Авогадро[11]:
Постоянную Больцмана используют в формулах, описывающих изучаемое явление или поведение рассматриваемого объекта с микроскопической точки зрения (см. Молекулярно-кинетическая теория, Статистическая физика, Физическая кинетика), тогда как универсальная газовая постоянная более удобна при расчетах, касающихся макроскопических систем, когда число частиц задано в молях.
См. также[править | править код]
- Постоянная Больцмана
- Число Авогадро
- Уравнение состояния идеального газа
Примечания[править | править код]
- ↑ Алымов И., 1865, с. 106.
- ↑ 1 2 Кипнис А. Я., 1962.
- ↑ 1 2 Гельфер Я. М., 1981, с. 123.
- ↑ Zeuner G., 1866, p. 105.
- ↑ Partington J. R., 1913, p. 135.
- ↑ Partington J. R., 1949, p. 644.
- ↑ Голоушкин В. Н., 1951.
- ↑ Менделеев Д. И. О сжимаемости газов (Из лаборатории С.-Петербургского Университета) // Журнал русского химического общества и физического общества. — 1874. — Т. 6. — С. 309—352. Архивировано 30 июня 2015 года.
- ↑ Д. Менделеев. Объ упругости газовъ. 1875 г. Дата обращения: 12 января 2013. Архивировано 6 декабря 2015 года.
- ↑ Разница в два раза объясняется тем, что для вращательных и поступательных степеней свободы играет роль лишь кинетическая энергия, а для колебательных — кинетическая и потенциальная.
- ↑ Больцмана постоянная, 1988.
Литература[править | править код]
- Partington J. R. A Text-book of Thermodynamics (with Special Reference to Chemistry). — London: Constable & Company LTD, 1913. — x + 544 p.
- Partington J. R. An Advanced Treatise on Physical Chemistry. Vol. 1. Fundamental Principles. The Properties of Gases. — London — New York — Toronto: Longmans, Green and Co, 1949. — xlii + 943 p.
- Zeuner G. Grundzüge der mechanischen Wärmetheorie. — 2. vollständig umgearbeitete Auflage. — Leipzig: Verlag von Arthur Felix, 1866. — xvi + 568 + xxv p.
- Алымов И. Научные выводы относительно водяного пара // Морской сборник. — 1865. — Т. 77, № 3. — С. 87—113.
- Больцмана постоянная // Физическая энциклопедия. — 1988. — Т. 1. — С. 222.
- Гельфер Я. М. История и методология термодинамики и статистической физики. — 2-е изд., перераб. и доп. — М.: Высшая школа, 1981. — 536 с.
- Голоушкин В. Н. Уравнение состояния идеального газа Д.И. Менделеева // Успехи физических наук. — 1951. — Т. 45, № 4. — С. 616—621. — doi:10.3367/UFNr.0045.195112c.0616.
- Кипнис А. Я. К истории установления уравнения состояния идеального газа // Вопросы истории естествознания и техники. — Изд-во АН СССР, 1962. — № 13. — С. 91—94.
From Wikipedia, the free encyclopedia
| Value of R[1] | Unit |
|---|---|
| SI units | |
| 8.31446261815324 | J⋅K−1⋅mol−1 |
| 8.31446261815324 | m3⋅Pa⋅K−1⋅mol−1 |
| 8.31446261815324 | kg⋅m2⋅s−2⋅K−1⋅mol−1 |
| Other common units | |
| 8314.46261815324 | L⋅Pa⋅K−1⋅mol−1 |
| 8.31446261815324 | L⋅kPa⋅K−1⋅mol−1 |
| 0.0831446261815324 | L⋅bar⋅K−1⋅mol−1 |
| 8.31446261815324×107 | erg⋅K−1⋅mol−1 |
| 0.730240507295273 | atm⋅ft3⋅lbmol−1⋅°R−1 |
| 10.731577089016 | psi⋅ft3⋅lbmol−1⋅°R−1 |
| 1.985875279009 | BTU⋅lbmol−1⋅°R−1 |
| 297.031214 | inH2O⋅ft3⋅lbmol−1⋅°R−1 |
| 554.984319180 | torr⋅ft3⋅lbmol−1⋅°R−1 |
| 0.082057366080960 | L⋅atm⋅K−1⋅mol−1 |
| 62.363598221529 | L⋅Torr⋅K−1⋅mol−1 |
| 1.98720425864083… | cal⋅K−1⋅mol−1 |
| 8.20573660809596…×10−5 | m3⋅atm⋅K−1⋅mol−1 |
The molar gas constant (also known as the gas constant, universal gas constant, or ideal gas constant) is denoted by the symbol R or R. It is the molar equivalent to the Boltzmann constant, expressed in units of energy per temperature increment per amount of substance, i.e. the pressure–volume product, rather than energy per temperature increment per particle. The constant is also a combination of the constants from Boyle’s law, Charles’s law, Avogadro’s law, and Gay-Lussac’s law. It is a physical constant that is featured in many fundamental equations in the physical sciences, such as the ideal gas law, the Arrhenius equation, and the Nernst equation.
The gas constant is the constant of proportionality that relates the energy scale in physics to the temperature scale and the scale used for amount of substance. Thus, the value of the gas constant ultimately derives from historical decisions and accidents in the setting of units of energy, temperature and amount of substance. The Boltzmann constant and the Avogadro constant were similarly determined, which separately relate energy to temperature and particle count to amount of substance.
The gas constant R is defined as the Avogadro constant NA multiplied by the Boltzmann constant k (or kB):
Since the 2019 redefinition of SI base units, both NA and k are defined with exact numerical values when expressed in SI units.[2] As a consequence, the SI value of the molar gas constant is exactly 8.31446261815324 J⋅K−1⋅mol−1.
Some have suggested that it might be appropriate to name the symbol R the Regnault constant in honour of the French chemist Henri Victor Regnault, whose accurate experimental data were used to calculate the early value of the constant. However, the origin of the letter R to represent the constant is elusive. The universal gas constant was apparently introduced independently by Clausius’ student, A.F. Horstmann (1873)[3][4]
and Dmitri Mendeleev who reported it first on Sep. 12, 1874.[5]
Using his extensive measurements of the properties of gases,[6][7]
Mendeleev also calculated it with high precision, within 0.3% of its modern value.[8]
The gas constant occurs in the ideal gas law:
where P is the absolute pressure, V is the volume of gas, n is the amount of substance, m is the mass, and T is the thermodynamic temperature. Rspecific is the mass-specific gas constant. The gas constant is expressed in the same unit as are molar entropy and molar heat.
Dimensions[edit]
From the ideal gas law PV = nRT we get:
where P is pressure, V is volume, n is number of moles of a given substance, and T is temperature.
As pressure is defined as force per area of measurement, the gas equation can also be written as:
Area and volume are (length)2 and (length)3 respectively. Therefore:
Since force × length = work:
The physical significance of R is work per degree per mole. It may be expressed in any set of units representing work or energy (such as joules), units representing degrees of temperature on an absolute scale (such as kelvin or rankine), and any system of units designating a mole or a similar pure number that allows an equation of macroscopic mass and fundamental particle numbers in a system, such as an ideal gas (see Avogadro constant).
Instead of a mole the constant can be expressed by considering the normal cubic meter.
Otherwise, we can also say that:
Therefore, we can write R as:
And so, in terms of SI base units:
- R = 8.314462618… kg⋅m2⋅s−2⋅K−1⋅mol−1.
Relationship with the Boltzmann constant[edit]
The Boltzmann constant kB (alternatively k) may be used in place of the molar gas constant by working in pure particle count, N, rather than amount of substance, n, since
where NA is the Avogadro constant.
For example, the ideal gas law in terms of the Boltzmann constant is
where N is the number of particles (molecules in this case), or to generalize to an inhomogeneous system the local form holds:
where ρN = N/V is the number density.
Measurement and replacement with defined value[edit]
As of 2006, the most precise measurement of R had been obtained by measuring the speed of sound ca(P, T) in argon at the temperature T of the triple point of water at different pressures P, and extrapolating to the zero-pressure limit ca(0, T). The value of R is then obtained from the relation
where:
- γ0 is the heat capacity ratio (5/3 for monatomic gases such as argon);
- T is the temperature, TTPW = 273.16 K by the definition of the kelvin at that time;
- Ar(Ar) is the relative atomic mass of argon and Mu = 10−3 kg⋅mol−1 as defined at the time.
However, following the 2019 redefinition of the SI base units, R now has an exact value defined in terms of other exactly defined physical constants.
Specific gas constant[edit]
| Rspecific for dry air |
Unit |
|---|---|
| 287.052874 | J⋅kg−1⋅K−1 |
| 53.3523 | ft⋅lbf⋅lb−1⋅°R−1 |
| 1,716.46 | ft⋅lbf⋅slug−1⋅°R−1 |
| Based on a mean molar mass for dry air of 28.964917 g/mol. |
The specific gas constant of a gas or a mixture of gases (Rspecific) is given by the molar gas constant divided by the molar mass (M) of the gas or mixture.
Just as the molar gas constant can be related to the Boltzmann constant, so can the specific gas constant by dividing the Boltzmann constant by the molecular mass of the gas.
Another important relationship comes from thermodynamics. Mayer’s relation relates the specific gas constant to the specific heat capacities for a calorically perfect gas and a thermally perfect gas.
where cp is the specific heat capacity for a constant pressure and cv is the specific heat capacity for a constant volume.[9]
It is common, especially in engineering applications, to represent the specific gas constant by the symbol R. In such cases, the universal gas constant is usually given a different symbol such as R to distinguish it. In any case, the context and/or unit of the gas constant should make it clear as to whether the universal or specific gas constant is being referred to. [10]
In case of air, using the perfect gas law and the standard sea-level conditions (SSL) (air density ρ0 = 1.225 kg/m3, temperature T0 = 288.15 K and pressure p0 = 101325 Pa), we have that Rair = P0/(ρ0T0) = 287.052874247 J·kg−1·K−1. Then the molar mass of air is computed by M0 = R/Rair = 28.964917 g/mol.[11]
U.S. Standard Atmosphere[edit]
The U.S. Standard Atmosphere, 1976 (USSA1976) defines the gas constant R∗ as:[12][13]
- R∗ = 8.31432×103 N⋅m⋅kmol−1⋅K−1 = 8.31432 J⋅K−1⋅mol−1.
Note the use of kilomoles, with the resulting factor of 1000 in the constant. The USSA1976 acknowledges that this value is not consistent with the cited values for the Avogadro constant and the Boltzmann constant.[13] This disparity is not a significant departure from accuracy, and USSA1976 uses this value of R∗ for all the calculations of the standard atmosphere. When using the ISO value of R, the calculated pressure increases by only 0.62 pascal at 11 kilometers (the equivalent of a difference of only 17.4 centimeters or 6.8 inches) and 0.292 Pa at 20 km (the equivalent of a difference of only 33.8 cm or 13.2 in).
Also note that this was well before the 2019 SI redefinition, through which the constant was given an exact value.
References[edit]
- ^ “2018 CODATA Value: molar gas constant”. The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2019-05-20.
- ^ “Proceedings of the 106th meeting” (PDF). 16–20 October 2017.
- ^ Jensen, William B. (July 2003). “The Universal Gas Constant R“. J. Chem. Educ. 80 (7): 731. Bibcode:2003JChEd..80..731J. doi:10.1021/ed080p731.
- ^ “Ask the Historian: The Universal Gas Constant — Why is it represented by the letter R?” (PDF).
- ^ Mendeleev, Dmitri I. (September 12, 1874). “An exert from the Proceedings of the Chemical Society’s Meeting on Sept. 12, 1874”. Journal of Russian Chemical-Physical Society, Chemical Part. VI (7): 208–209.
- ^ Mendeleev, Dmitri I. (1875). On the elasticity of gases [Объ упругости газовъ]. A.M. Kotomin, St.-Petersburg.
- ^ D. Mendeleev. On the elasticity of gases. 1875 (in Russian)
- ^ Mendeleev, Dmitri I. (March 22, 1877). “Mendeleef’s researches on Mariotte’s law 1”. Nature. 15 (388): 498–500. Bibcode:1877Natur..15..498D. doi:10.1038/015498a0.
- ^ Anderson, Hypersonic and High-Temperature Gas Dynamics, AIAA Education Series, 2nd Ed, 2006
- ^ Moran and Shapiro, Fundamentals of Engineering Thermodynamics, Wiley, 4th Ed, 2000
- ^ Manual of the US Standard Atmosphere (PDF) (3 ed.). National Aeronautics and Space Administration. 1962. pp. 7–11.
- ^ “Standard Atmospheres”. Retrieved 2007-01-07.
- ^ a b NOAA, NASA, USAF (1976). U.S. Standard Atmosphere, 1976 (PDF). U.S. Government Printing Office, Washington, D.C. NOAA-S/T 76-1562.
{{cite book}}: CS1 maint: multiple names: authors list (link) Part 1, p. 3, (Linked file is 17 Meg)
External links[edit]
- Ideal gas calculator Archived 2012-07-15 at the Wayback Machine – Ideal gas calculator provides the correct information for the moles of gas involved.
- Individual Gas Constants and the Universal Gas Constant – Engineering Toolbox
В физике мы частенько встречаемся с такой штукой, как универсальная газовая постоянная. Вроде как и понятно, что её значение равно 8,31 Дж/Моль*градус.
Используется она преимущественно в задачах про газы и газовые законы. Но пытливые умы обязательно спросят…А зачем всё это и почему универсальная?
Для начала начнем со стандартного определения из учебника:
Универсальная газовая постоянная — константа, численно равная работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К. Равна произведению постоянной Больцмана на число Авогадро. Обозначается латинской буквой R.
Разбираем определение по атомам
Слово константа оно и понятно без лишних комментариев. В физике оно означает нечто типа “неизменная не при каких условиях величина“. Скажем, масса гири 10 кг и при нормальных условиях этот параметр не изменится, если не отпилить от гири кусок.
Численно равная – это просто красивая формулировка, которая означает что одно число равно другому числу.
Одного моля… – что такое моль мы наверное помним. Это количество вещества. Такая единица измерения объема. Для тех, кто не помнит, отметим, что моль – это количество вещества массой равной его молекулярной массе. Например, есть молекула водорода, состоящая из двух атомов. У неё есть стандартная масса. Значит, чтобы взять 1 моль водорода, нужно взять массу водорода, равную массе 1 молекулы этого водорода. Для каждого вещества это свой объем.
Идеальный газ – это несуществующий в природе газ. Его упрощенная модель, которая не учитывает взаимодействие между самим частицами газа, кроме их соударений друг с другом или при ударе об стенки. Почему модель? Потому что если брать газ реальный, то крыша может натурально поехать. Для упрощения мы рассматриваем модель.
Изобарный процесс – это процесс, который протекает при постоянном давлении. Скажем, если кипятить воду в открытой кастрюле, то процесс изобарный. Давление постоянное, так как крышки нет, а температура с объемом могут изменяться.
Про число Авогадро мы писали отдельно в этом материале. Повторяться уже не будем.
А вот про постоянную Больцмана вспомним! Это физическая постоянная, определяющая связь между температурой и энергией. Грубо говоря, благодаря этому значению можно рассчитать, насколько вырастет энергия газа при нагреве. Ну а равна она 1,38*10^-23 Дж/К.
Как всё это увязать в голове
Здорово…Теперь мы все термины знаем. Но всё равно непонятно, для чего нужна газовая постоянная. Попробуем сказать понятными словами тоже самое.
Если увеличить температуру на один кельвин при неизменном давлении процесса, то газ расширяется и при этом расширении системой (газом) совершается работа (или затрачивается энергия), равная универсальной газовой постоянной или 8,31 Дж.
Ну так-то вроде теперь всё понятно! Кроме того, для чего это знать…
Для чего нужна универсальная газовая постоянная
Нужна эта величина для упрощения расчётов. Она так и будет мелькать во всем курсе физики. Физический смысл мы уже знаем.
Эта величина используется всегда, когда речь заходит о процессах, где есть работа при изменении состояния газов. Скажем, когда нужно рассчитать изменение термодинамических параметров если изменился один из них. Выведение этой величины в единую газовую постоянную упрощает дальнейшие расчёты.
Универсальная газовая постоянная удобна при расчетах, касающихся макроскопических систем, когда число частиц задано в молях.
————
Обязательно оцените статью лайком и подпишитесь на проект! Это очень важно для развития канала. Виноваты странные алгоритмы Дзена!
————-
Советую также прочитать на нашем канале:
—–
Смотрите нас на YouTube и присоединяйтесь к нашему Телеграм!
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 августа 2018;
проверки требуют 2 правки.
Универса́льная га́зовая постоя́нная — константа, равная работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К. Обозначается латинской буквой R.
Общая информация[править | править код]
И. П. Алымов (1865)[1][2][3], Цейнер (1866)[4], Гульдберг (1867)[5], Горстман (1873)[6] и Д. И. Менделеев (1874)[7][2][3] пришли к выводу, что произведение индивидуальной для каждого газа постоянной в уравнении Клапейрона на молекулярный вес газа должно быть постоянной для всех газов величиной. Д. И. Менделеев вычислил[8][9] значение константы R, используя закон Авогадро, согласно которому 1 моль различных газов при одинаковом давлении и температуре занимает одинаковый объём 
Входит в уравнение состояния идеального газа


В Международной системе единиц (СИ) универсальная газовая постоянная равна[10]
R = 8,3144598(48) Дж⁄(моль∙К).
В системе СГС универсальная газовая постоянная равна R = 8,3144598(48)·107 эрг⁄(моль∙К).
Удельная газовая постоянная (R/M) для сухого воздуха: R ≈ 287 Дж⁄(кг∙К).
Связь между газовыми константами[править | править код]
Универсальная газовая постоянная выражается через произведение постоянной Больцмана на число Авогадро[11]:
Постоянную Больцмана используют в формулах, описывающих изучаемое явление или поведение рассматриваемого объекта с микроскопической точки зрения (см. Молекулярно-кинетическая теория, Статистическая физика, Физическая кинетика), тогда как универсальная газовая постоянная более удобна при расчетах, касающихся макроскопических систем, когда число частиц задано в молях.
См. также[править | править код]
- Постоянная Больцмана
- Число Авогадро
- Уравнение состояния идеального газа
Примечания[править | править код]
- ↑ Алымов И., 1865, с. 106.
- ↑ 1 2 Кипнис А. Я., 1962.
- ↑ 1 2 Гельфер Я. М., 1981, с. 123.
- ↑ Zeuner G., 1866, p. 105.
- ↑ Partington J. R., 1913, p. 135.
- ↑ Partington J. R., 1949, p. 644.
- ↑ Голоушкин В. Н., 1951.
- ↑ Д. И. Менделеев. О сжимаемости газов (Из лаборатории С.-Петербургского Университета). Журнал русского химического общества и физического общества. — 1874. — Т. 6. — C. 309—352.
- ↑ Д. Менделеев. Объ упругости газовъ. 1875 г.
- ↑ Значение, рекомендованное CODATA, 2014 г.
- ↑ Больцмана постоянная, 1988.
Литература[править | править код]
- Partington J. R. A Text-book of Thermodynamics (with Special Reference to Chemistry). — London: Constable & Company LTD, 1913. — x + 544 p.
- Partington J. R. An Advanced Treatise on Physical Chemistry. Vol. 1. Fundamental Principles. The Properties of Gases. — London — New York — Toronto: Longmans, Green and Co, 1949. — xlii + 943 p.
- Zeuner G. Grundzüge der mechanischen Wärmetheorie. — 2. vollständig umgearbeitete Auflage. — Leipzig: Verlag von Arthur Felix, 1866. — xvi + 568 + xxv p.
- Алымов И. Научные выводы относительно водяного пара (рус.) // Морской сборник. — 1865. — Т. 77, № 3. — С. 87—113.
- Больцмана постоянная (рус.) // Физическая энциклопедия. — 1988. — Т. 1. — С. 222.
- Гельфер Я. М. История и методология термодинамики и статистической физики. — 2-е изд., перераб. и доп. — М.: Высшая школа, 1981. — 536 с.
- Голоушкин В. Н. Уравнение состояния идеального газа Д.И. Менделеева (рус.) // Успехи физических наук. — 1951. — Т. 45, № 4. — С. 616—621. — DOI:10.3367/UFNr.0045.195112c.0616.
- Кипнис А. Я. К истории установления уравнения состояния идеального газа (рус.) // Вопросы истории естествознания и техники. — Изд-во АН СССР, 1962. — № 13. — С. 91—94.
Закон Клапейрона-Менделеева для идеального газа: исторические предпосылки, формула, пример задачи
Рассмотрение свойств газов в физике в первом приближении основывается на концепции идеального газа. В данной статье подробно изучим эту концепцию и приведем уравнение, которое описывает численно термодинамические свойства упомянутой текучей субстанции. Это уравнение называется законом Клапейрона-Менделеева.
Концепция идеального газа
В школьном курсе физики газовое агрегатное состояние вещества характеризуется произвольным перемещением с различными скоростями всех составляющих его атомов и молекул. Эти частицы считаются в первом приближении абсолютно упругими материальными точками. Они имеют массу, но не размеры. Весь характер их взаимодействия друг с другом заключается в абсолютно упругих столкновениях, в результате которых сохраняется количество движения и энергия. Все перечисленные свойства частиц и их приближения образуют концепцию идеального газа.
Любой реальный газ, будь то гелий, кислород или воздух, можно с высокой точностью считать идеальным, если его давление составляет порядка одной атмосферы и ниже, а температура соответствует комнатной или выше. Если эти условия не выполняются, то газ считается реальным, и для его описания следует использовать уравнение Ван-дер-Ваальса, а не закон Клапейрона-Менделеева, о котором пойдет речь далее в статье.
Предпосылки возникновения уравнения состояния идеального газа
Под уравнением состояния газа идеального принято понимать математическую формулировку газового закона Менделеева-Клапейрона. Как и любое открытие в физике, это уравнение не появилось из неоткуда, а имело вполне определенные исторические предпосылки.
В 60-70-е годы XVII века англичанин Роберт Бойль и француз Эдм Мариотт независимо друг от друга в результате многих проведенных экспериментов с различными газами установили, что произведение объема на давление для закрытой системы с газом остается постоянным для любых процессов, в результате которых температура не изменяется. В настоящее время этот газовый закон носит фамилии названных ученых.
Спустя почти 1,5 века, в конце XVIII – начале XIX веков французы Шарль и Гей Люссак открывают еще два экспериментальных закона в поведении идеальных газов. Они устанавливают прямо пропорциональную зависимость между давлением и температурой при постоянном объеме и между объемом и температурой при постоянном давлении.
Наконец, в 1834 году Эмиль Клапейрон вывел, анализируя открытые предыдущими учеными газовые законы, уравнение Клапейрона. Менделеева фамилия появилась в названии этого уравнения благодаря его вкладу в преобразование исходного выражения к современному виду. В частности, Менделеев ввел понятие универсальной газовой постоянной.
Формула закона Клапейрона-Менделеева
Выше мы дали определение идеального газа, рассказали о законах, которые привели к формулировке универсального уравнения состояния. Теперь пришло время записать это уравнение:
Здесь P, V, n и T – давление, объем, количество вещества и температура, соответственно. Таким образом, произведение объема системы на давление в ней всегда находится для идеального газа в прямой пропорциональности произведению абсолютной температуры на количество вещества.
Коэффициентом пропорциональности является уже упомянутая универсальная постоянная R. Она равна 8,314 Дж/(моль*К). Если 1 моль газа нагреть на 1 кельвин, то в процессе расширения он совершит работу 8,314 Джоуля. Любопытно заметить, что универсальной величина R называется потому, что она не определяется химической природой газа. Для всех чистых газов и их смесей она принимает единственное значение.
Откуда выводится изучаемое уравнение?
Выше мы уже сказали, что Клапейрон свое уравнение получил в результате банального обобщения экспериментальных результатов различных ученых. Тем не менее, закон Клапейрона-Менделеева может быть получен чисто теоретическими методами.
Одним из них является МКТ (молекулярно-кинетическая теория). МКТ рассматривает газовую систему с точки зрения концентрации частиц, распределения их скоростей, учета их масс и следование концепции идеального газа. Универсальное уравнение газа однозначно следует, если применить второй закон Ньютона к процессу упругого соударения частиц со стенками герметичного сосуда. В результате применения МКТ получается выражение:
Это равенство приводит к записанному в предыдущем пункте уравнению, если учесть следующие выражения:
Использование универсального уравнения для решения задачи
Известно, что некоторый газ под давление 2 атмосферы находится в баллоне при температуре 25 o C. Объем баллона составляет 50 литров. Какое количество вещества содержится в баллоне?
Поскольку нам известны 3 из 4-х параметров, то можно применить закон Клапейрона-Менделеева, чтобы найти величину n. Прежде чем это сделать, переведем все единицы в систему СИ:
T = 25 + 273,15 = 298,15 К;
Теперь воспользуемся формулой, получим:
n = P*V/(R*T) = 202650*0,05/(8,314*298,15) = 4,09 моль.
Хотя само значение 4,09 моль является небольшим, количество частиц газа будет гигантским. Чтобы его получить, следует n умножить на NA=6,02*10 23 .
Закон Клапейрона-Менделеева для идеального газа: исторические предпосылки, формула, пример задачи
Рассмотрение свойств газов в физике в первом приближении основывается на концепции идеального газа. В данной статье подробно изучим эту концепцию и приведем уравнение, которое описывает численно термодинамические свойства упомянутой текучей субстанции. Это уравнение называется законом Клапейрона-Менделеева.
Концепция идеального газа
В школьном курсе физики газовое агрегатное состояние вещества характеризуется произвольным перемещением с различными скоростями всех составляющих его атомов и молекул. Эти частицы считаются в первом приближении абсолютно упругими материальными точками. Они имеют массу, но не размеры. Весь характер их взаимодействия друг с другом заключается в абсолютно упругих столкновениях, в результате которых сохраняется количество движения и энергия. Все перечисленные свойства частиц и их приближения образуют концепцию идеального газа.

Любой реальный газ, будь то гелий, кислород или воздух, можно с высокой точностью считать идеальным, если его давление составляет порядка одной атмосферы и ниже, а температура соответствует комнатной или выше. Если эти условия не выполняются, то газ считается реальным, и для его описания следует использовать уравнение Ван-дер-Ваальса, а не закон Клапейрона-Менделеева, о котором пойдет речь далее в статье.
Предпосылки возникновения уравнения состояния идеального газа
Под уравнением состояния газа идеального принято понимать математическую формулировку газового закона Менделеева-Клапейрона. Как и любое открытие в физике, это уравнение не появилось из неоткуда, а имело вполне определенные исторические предпосылки.
В 60-70-е годы XVII века англичанин Роберт Бойль и француз Эдм Мариотт независимо друг от друга в результате многих проведенных экспериментов с различными газами установили, что произведение объема на давление для закрытой системы с газом остается постоянным для любых процессов, в результате которых температура не изменяется. В настоящее время этот газовый закон носит фамилии названных ученых.
Спустя почти 1,5 века, в конце XVIII – начале XIX веков французы Шарль и Гей Люссак открывают еще два экспериментальных закона в поведении идеальных газов. Они устанавливают прямо пропорциональную зависимость между давлением и температурой при постоянном объеме и между объемом и температурой при постоянном давлении.
Наконец, в 1834 году Эмиль Клапейрон вывел, анализируя открытые предыдущими учеными газовые законы, уравнение Клапейрона. Менделеева фамилия появилась в названии этого уравнения благодаря его вкладу в преобразование исходного выражения к современному виду. В частности, Менделеев ввел понятие универсальной газовой постоянной.
Формула закона Клапейрона-Менделеева
Выше мы дали определение идеального газа, рассказали о законах, которые привели к формулировке универсального уравнения состояния. Теперь пришло время записать это уравнение:
Здесь P, V, n и T – давление, объем, количество вещества и температура, соответственно. Таким образом, произведение объема системы на давление в ней всегда находится для идеального газа в прямой пропорциональности произведению абсолютной температуры на количество вещества.
Коэффициентом пропорциональности является уже упомянутая универсальная постоянная R. Она равна 8,314 Дж/(моль*К). Если 1 моль газа нагреть на 1 кельвин, то в процессе расширения он совершит работу 8,314 Джоуля. Любопытно заметить, что универсальной величина R называется потому, что она не определяется химической природой газа. Для всех чистых газов и их смесей она принимает единственное значение.
Откуда выводится изучаемое уравнение?
Выше мы уже сказали, что Клапейрон свое уравнение получил в результате банального обобщения экспериментальных результатов различных ученых. Тем не менее, закон Клапейрона-Менделеева может быть получен чисто теоретическими методами.
Одним из них является МКТ (молекулярно-кинетическая теория). МКТ рассматривает газовую систему с точки зрения концентрации частиц, распределения их скоростей, учета их масс и следование концепции идеального газа. Универсальное уравнение газа однозначно следует, если применить второй закон Ньютона к процессу упругого соударения частиц со стенками герметичного сосуда. В результате применения МКТ получается выражение:
Это равенство приводит к записанному в предыдущем пункте уравнению, если учесть следующие выражения:
Использование универсального уравнения для решения задачи
Известно, что некоторый газ под давление 2 атмосферы находится в баллоне при температуре 25 oC. Объем баллона составляет 50 литров. Какое количество вещества содержится в баллоне?
Поскольку нам известны 3 из 4-х параметров, то можно применить закон Клапейрона-Менделеева, чтобы найти величину n. Прежде чем это сделать, переведем все единицы в систему СИ:
P = 2 атм. = 101325*2 = 202650 Па;
T = 25 + 273,15 = 298,15 К;
V = 50*10-3 = 0,05 м3.
Теперь воспользуемся формулой, получим:
n = P*V/(R*T) = 202650*0,05/(8,314*298,15) = 4,09 моль.
Хотя само значение 4,09 моль является небольшим, количество частиц газа будет гигантским. Чтобы его получить, следует n умножить на NA=6,02*1023.
Как появилось уравнение менделеева клапейрона
Уравнение Менделеева-Клапейрона – уравнение состояния для идеального газа, отнесенное к 1 молю газа. В 1874 г. Д. И. Менделеев на основе уравнения Клапейрона объединив его с законом Авогадро, используя молярный объем Vm и отнеся его к 1 молю, вывел уравнение состояния для 1 моля идеального газа:
pV = RT , где R — универсальная газовая постоянная,
R = 8,31 Дж/(моль . К)
Уравнение Клапейрона-Менделеева показывает, что для данной массы газа возможно одновременно изменение трех параметров, характеризующих состояние идеального газа. Для произвольной массы газа М, молярная масса которого m: pV = (М/m) . RT. или pV = NАkT,
где NА — число Авогадро, k — постоянная Больцмана.
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из параметров – давление, объем или температура – остается постоянным, а изменяются только остальные два и получить теоретически газовые законы для этих условий изменения состояния газа.
Такие процессы называют изопроцессами. Законы, описывающие изопроцессы, были открыты задолго до теоретического вывода уравнения состояния идеального газа.
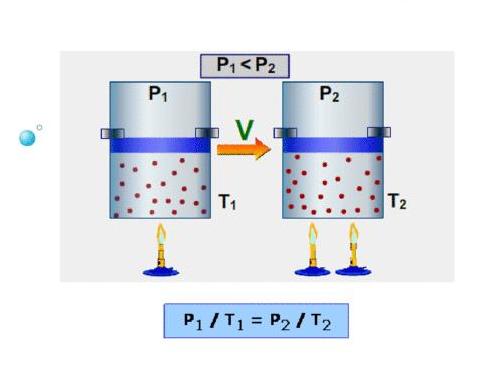
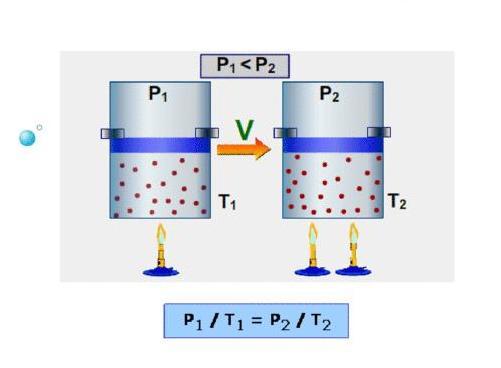
Изотермический процесс – процесс изменения состояния системы при постоянной температуре. Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется. Это закон Бойля – Мариотта.
Для того, чтобы температура газа оставалась в процессе неизменной, необходимо, чтобы газ мог обмениваться теплотой с внешней большой системой – термостатом. Роль термостата может играть внешняя среда (воздух атмосферы). Согласно закону Бойля-Мариотта, давление газа обратно пропорционально его объему: P1V1=P2V2=const. Графическая зависимость давления газа от объема изображается в виде кривой (гиперболы), которая носит название изотермы. Разным температурам соответствуют разные изотермы.
Изобарный процесс – процесс изменения состояния системы при постоянном давлении. Для газа данной массы отношение объема газа к его температуре остается постоянным, если давление газа не меняется. Это закон Гей-Люссака. Согласно закону Гей-Люссака, объем газа прямо пропорционален его температуре: V/T=const. Графически эта зависимость в координатах V-T изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изобарой. Разным давлениям соответствуют разные изобары. Закон Гей-Люссака не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов.
Изохорный процесс – процесс изменения состояния системы при постоянном объеме. Для данной массы газа отношение давления газа к его температуре остается постоянным, если объем газа не меняется. Этот газовый закон Шарля. Согласно закону Шарля, давление газа прямо пропорционально его температуре: P/T=const. Графически эта зависимость в координатах P-Т изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изохорой. Разным объемам соответствуют разные изохоры. Закон Шарля не соблюдается в области низких температур, близких и температуре сжижения (конденсации) газов.
Итак, из закона pV = (М/m) . RT выводятся следующие законы:
p = const => V/T = const — закон Гей – Люссака .
V= const => p/T = const — закон Шарля
Если идеальный газ является смесью нескольких газов, то согласно закону Дальтона, давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов. Парциальное давление – это такое давление, которое производил бы газ, если бы он один занимал весь объем, равный объему смеси.
Некоторых, возможно, интересует вопрос, каким образом удалось определить постоянную Авогадро NA = 6,02·10 23 ? Значение числа Авогадро было экспериментально установлено только в конце XIX – начале XX века. Опишем один из таких экспериментов.
В откачанный до глубокого вакуума сосуд объемом V = 30 мл поместили навеску элемента радия массой 0,5 г и выдержали там в течение одного года. Было известно, что за секунду 1 г радия испускает 3,7·10 10 альфа-частиц. Эти частицы представляют собой ядра гелия, которые тут же принимают электроны из стенок сосуда и превращаются в атомы гелия. За год давление в сосуде выросло до 7,95·10 -4 атм (при температуре 27 о С). Изменением массы радия за год можно пренебречь. Итак, чему равна NA?
Сначала найдем, сколько альфа-частиц (то есть атомов гелия) образовалось за один год. Обозначим это число как N атомов:
N = 3,7·10 10 · 0,5 г · 60 сек · 60 мин · 24 час · 365 дней = 5,83·10 17 атомов.
Запишем уравнение Клапейрона-Менделеева PV = nRT и заметим, что число молей гелия n = N/NA. Отсюда:
NA = NRT = 5,83 . 10 17 . 0,0821 . 300 = 6,02 . 10 23
PV 7,95 . 10 -4 . 3 . 10 -2
В начале XX века этот способ определения постоянной Авогадро был самым точным. Но почему так долго (в течение года) длился эксперимент? Дело в том, что радий добывается очень трудно. При его малом количестве (0,5 г) радиоактивный распад этого элемента дает очень мало гелия. А чем меньше газа в замкнутом сосуде, тем меньшее он создаст давление и тем большей будет ошибка измерения. Понятно, что ощутимое количество гелия может образоваться из радия только за достаточно долгое время.
[spoiler title=”источники:”]
http://1ku.ru/obrazovanie/54500-zakon-klapejrona-mendeleeva-dlja-idealnogo-gaza-istoricheskie-predposylki-formula-primer-zadachi/
http://www.sites.google.com/site/opatpofizike/uravnenie-mendeleeva-klapejrona
[/spoiler]