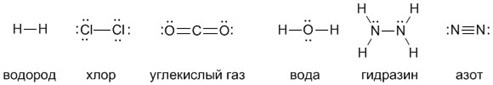Валентность алюминия.
Валентность алюминия:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность алюминия равна III. Алюминий проявляет постоянную валентность.
| Валентность алюминия в соединениях | |
| III | Al2O3, Al(OH)3, AlCl3 |
Все свойства атома алюминия
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности
402
Валентность химических элементов (Таблица)
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0. Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Как можно определить валентность в соединениях:
— Валентность водорода (H) постоянна всегда 1. Отсюда в соединении H2O валентность O равна 2.
— Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
— Высшая валентность всегда равна № группы.
— Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
— У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
— У неметаллов обычно две валентности: высшая и низшая.

Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
|
Атомный № |
Химический элемент |
Символ |
Валентность химических элементов |
Примеры соединений |
|
1 |
Водород / Hydrogen |
H |
I |
HF |
|
2 |
Гелий / Helium |
He |
отсутствует |
— |
|
3 |
Литий / Lithium |
Li |
I |
Li2O |
|
4 |
Бериллий / Beryllium |
Be |
II |
BeH2 |
|
5 |
Бор / Boron |
B |
III |
BCl3 |
|
6 |
Углерод / Carbon |
C |
IV, II |
CO2, CH4 |
|
7 |
Азот / Nitrogen |
N |
I, II, III, IV |
NH3 |
|
8 |
Кислород / Oxygen |
O |
II |
H2O, BaO |
|
9 |
Фтор / Fluorine |
F |
I |
HF |
|
10 |
Неон / Neon |
Ne |
отсутствует |
— |
|
11 |
Натрий / Sodium |
Na |
I |
Na2O |
|
12 |
Магний / Magnesium |
Mg |
II |
MgCl2 |
|
13 |
Алюминий / Aluminum |
Al |
III |
Al2O3 |
|
14 |
Кремний / Silicon |
Si |
IV |
SiO2, SiCl4 |
|
15 |
Фосфор / Phosphorus |
P |
III, V |
PH3, P2O5 |
|
16 |
Сера / Sulfur |
S |
VI, IV, II |
H2S, SO3 |
|
17 |
Хлор / Chlorine |
Cl |
I, III, V, VII |
HCl, ClF3 |
|
18 |
Аргон / Argon |
Ar |
отсутствует |
— |
|
19 |
Калий / Potassium |
K |
I |
KBr |
|
20 |
Кальций / Calcium |
Ca |
II |
CaH2 |
|
21 |
Скандий / Scandium |
Sc |
III |
Sc2S3 |
|
22 |
Титан / Titanium |
Ti |
II, III, IV |
Ti2O3, TiH4 |
|
23 |
Ванадий / Vanadium |
V |
II, III, IV, V |
VF5, V2O3 |
|
24 |
Хром / Chromium |
Cr |
II, III, VI |
CrCl2, CrO3 |
|
25 |
Марганец / Manganese |
Mn |
II, III, IV, VI, VII |
Mn2O7, Mn2(SO4)3 |
|
26 |
Железо / Iron |
Fe |
II, III |
FeSO4, FeBr3 |
|
27 |
Кобальт / Cobalt |
Co |
II, III |
CoI2, Co2S3 |
|
28 |
Никель / Nickel |
Ni |
II, III, IV |
NiS, Ni(CO)4 |
|
29 |
Медь / Copper |
Сu |
I, II |
CuS, Cu2O |
|
30 |
Цинк / Zinc |
Zn |
II |
ZnCl2 |
|
31 |
Галлий / Gallium |
Ga |
III |
Ga(OH)3 |
|
32 |
Германий / Germanium |
Ge |
II, IV |
GeBr4, Ge(OH)2 |
|
33 |
Мышьяк / Arsenic |
As |
III, V |
As2S5, H3AsO4 |
|
34 |
Селен / Selenium |
Se |
II, IV, VI, |
H2SeO3 |
|
35 |
Бром / Bromine |
Br |
I, III, V, VII |
HBrO3 |
|
36 |
Криптон / Krypton |
Kr |
VI, IV, II |
KrF2, BaKrO4 |
|
37 |
Рубидий / Rubidium |
Rb |
I |
RbH |
|
38 |
Стронций / Strontium |
Sr |
II |
SrSO4 |
|
39 |
Иттрий / Yttrium |
Y |
III |
Y2O3 |
|
40 |
Цирконий / Zirconium |
Zr |
II, III, IV |
ZrI4, ZrCl2 |
|
41 |
Ниобий / Niobium |
Nb |
I, II, III, IV, V |
NbBr5 |
|
42 |
Молибден / Molybdenum |
Mo |
II, III, IV, V, VI |
Mo2O5, MoF6 |
|
43 |
Технеций / Technetium |
Tc |
I — VII |
Tc2S7 |
|
44 |
Рутений / Ruthenium |
Ru |
II — VIII |
RuO4, RuF5, RuBr3 |
|
45 |
Родий / Rhodium |
Rh |
I, II, III, IV, V |
RhS, RhF3 |
|
46 |
Палладий / Palladium |
Pd |
I, II, III, IV |
Pd2S, PdS2 |
|
47 |
Серебро / Silver |
Ag |
I, II, III |
AgO, AgF2, AgNO3 |
|
48 |
Кадмий / Cadmium |
Cd |
II |
CdCl2 |
|
49 |
Индий / Indium |
In |
III |
In2O3 |
|
50 |
Олово / Tin |
Sn |
II, IV |
SnBr4, SnF2 |
|
51 |
Сурьма / Antimony |
Sb |
III, V |
SbF5, SbH3 |
|
52 |
Теллур / Tellurium |
Te |
VI, IV, II |
TeH2, H6TeO6 |
|
53 |
Иод / Iodine |
I |
I, III, V, VII |
HIO3, HI |
|
54 |
Ксенон / Xenon |
Xe |
II, IV, VI, VIII |
XeF6, XeO4, XeF2 |
|
55 |
Цезий / Cesium |
Cs |
I |
CsCl |
|
56 |
Барий / Barium |
Ba |
II |
Ba(OH)2 |
|
57 |
Лантан / Lanthanum |
La |
III |
LaH3 |
|
58 |
Церий / Cerium |
Ce |
III, IV |
CeO2 , CeF3 |
|
59 |
Празеодим / Praseodymium |
Pr |
III, IV |
PrF4, PrO2 |
|
60 |
Неодим / Neodymium |
Nd |
III |
Nd2O3 |
|
61 |
Прометий / Promethium |
Pm |
III |
Pm2O3 |
|
62 |
Самарий / Samarium |
Sm |
II, III |
SmO |
|
63 |
Европий / Europium |
Eu |
II, III |
EuSO4 |
|
64 |
Гадолиний / Gadolinium |
Gd |
III |
GdCl3 |
|
65 |
Тербий / Terbium |
Tb |
III, IV |
TbF4, TbCl3 |
|
66 |
Диспрозий / Dysprosium |
Dy |
III |
Dy2O3 |
|
67 |
Гольмий / Holmium |
Ho |
III |
Ho2O3 |
|
68 |
Эрбий / Erbium |
Er |
III |
Er2O3 |
|
69 |
Тулий / Thulium |
Tm |
II, III |
Tm2O3 |
|
70 |
Иттербий / Ytterbium |
Yb |
II, III |
YO |
|
71 |
Лютеций / Lutetium |
Lu |
III |
LuF3 |
|
72 |
Гафний / Hafnium |
Hf |
II, III, IV |
HfBr3, HfCl4 |
|
73 |
Тантал / Tantalum |
Ta |
I — V |
TaCl5, TaBr2, TaCl4 |
|
74 |
Вольфрам / Tungsten |
W |
II — VI |
WBr6, Na2WO4 |
|
75 |
Рений / Rhenium |
Re |
I — VII |
Re2S7, Re2O5 |
|
76 |
Осмий / Osmium |
Os |
II — VI, VIII |
OsF8, OsI2, Os2O3 |
|
77 |
Иридий / Iridium |
Ir |
I — VI |
IrS3, IrF4 |
|
78 |
Платина / Platinum |
Pt |
I, II, III, IV, V |
Pt(SO4)3, PtBr4 |
|
79 |
Золото / Gold |
Au |
I, II, III |
AuH, Au2O3, Au2Cl6 |
|
80 |
Ртуть / Mercury |
Hg |
II |
HgF2, HgBr2 |
|
81 |
Талий / Thallium |
Tl |
I, III |
TlCl3, TlF |
|
82 |
Свинец / Lead |
Pb |
II, IV |
PbS, PbH4 |
|
83 |
Висмут / Bismuth |
Bi |
III, V |
BiF5, Bi2S3 |
|
84 |
Полоний / Polonium |
Po |
VI, IV, II |
PoCl4, PoO3 |
|
85 |
Астат / Astatine |
At |
нет данных |
— |
|
86 |
Радон / Radon |
Rn |
отсутствует |
— |
|
87 |
Франций / Francium |
Fr |
I |
— |
|
88 |
Радий / Radium |
Ra |
II |
RaBr2 |
|
89 |
Актиний / Actinium |
Ac |
III |
AcCl3 |
|
90 |
Торий / Thorium |
Th |
II, III, IV |
ThO2, ThF4 |
|
91 |
Проактиний / Protactinium |
Pa |
IV, V |
PaCl5, PaF4 |
|
92 |
Уран / Uranium |
U |
III, IV |
UF4, UO3 |
|
93 |
Нептуний |
Np |
III — VI |
NpF6, NpCl4 |
|
94 |
Плутоний |
Pu |
II, III, IV |
PuO2, PuF3, PuF4 |
|
95 |
Америций |
Am |
III — VI |
AmF3, AmO2 |
|
96 |
Кюрий |
Cm |
III, IV |
CmO2, Cm2O3 |
|
97 |
Берклий |
Bk |
III, IV |
BkF3, BkO2 |
|
98 |
Калифорний |
Cf |
II, III, IV |
Cf2O3 |
|
99 |
Эйнштейний |
Es |
II, III |
EsF3 |
|
100 |
Фермий |
Fm |
II, III |
— |
|
101 |
Менделевий |
Md |
II, III |
— |
|
102 |
Нобелий |
No |
II, III |
— |
|
103 |
Лоуренсий |
Lr |
III |
— |
|
Номер |
Элемент |
Символ |
Валентность химических элементов |
Пример |
Поделитесь ссылкой с друзьями:
Похожие таблицы
Комментарии:
Определение валентности химического элемента по формуле его соединения
Суммы единиц валентности каждого элемента в формуле бинарного соединения равны.
Пример:
определим валентность хлора в его соединении с кислородом —
Cl2O7
.
1. Записываем известную валентность кислорода над формулой. Неизвестную валентность обозначаем буквой (x):
2. Находим сумму единиц валентности каждого элемента. Для этого его валентность умножаем на число атомов:
3. Вычисляем (x):
2x=14,x=14:2=7.
Валентность хлора равна
VII
:
Составление формулы бинарного соединения по валентностям химических элементов
Если известны валентности двух элементов, то можно составить формулу их соединения.
Пример:
составим формулу соединения алюминия с углеродом, валентность которого равна
IV
.
1. Записываем символы химических элементов рядом. Указываем над ними валентности. Валентность алюминия постоянная и равна
III
.
2. Находим наименьшее общее кратное валентностей, записываем его над формулой.
Наименьшее общее кратное равно
3⋅4=12
.
3. Делим НОК на валентность каждого элемента:
12:3=4,12:4=3.
Получаем индексы в формуле соединения:
На уроках химии вы уже познакомились с понятием валентности химических элементов. Мы собрали в одном месте всю полезную информацию по этому вопросу. Используйте ее, когда будете готовиться к ГИА и ЕГЭ.
Валентность и химический анализ
Валентность – способность атомов химических элементов вступать в химические соединения с атомами других элементов. Другими словами, это способность атома образовывать определенное число химических связей с другими атомами.
С латыни слово «валентность» переводится как «сила, способность». Очень верное название, правда?
Понятие «валентность» – одно из основных в химии. Было введено еще до того, как ученым стало известно строение атома (в далеком 1853 году). Поэтому по мере изучения строения атома пережило некоторые изменения.
Так, с точки зрения электронной теории валентность напрямую связана с числом внешних электронов атома элемента. Это значит, что под «валентностью» подразумевают число электронных пар, которыми атом связан с другими атомами.
Зная это, ученые смогли описать природу химической связи. Она заключается в том, что пара атомов вещества делит между собой пару валентных электронов.
Вы спросите, как же химики 19 века смогли описать валентность еще тогда, когда считали, что мельче атома частиц не бывает? Нельзя сказать, что это было так уж просто – они опирались на химический анализ.
Путем химического анализа ученые прошлого определяли состав химического соединения: сколько атомов различных элементов содержится в молекуле рассматриваемого вещества. Для этого нужно было определить, какова точная масса каждого элемента в образце чистого (без примесей) вещества.
Правда, метод этот не без изъянов. Потому что определить подобным образом валентность элемента можно только в его простом соединении со всегда одновалентным водородом (гидрид) или всегда двухвалентным кислородом (оксид). К примеру, валентность азота в NH3 – III, поскольку один атом водорода связан с тремя атомами азота. А валентность углерода в метане (СН4), по тому же принципу, – IV.
Этот метод для определения валентности годится только для простых веществ. А вот в кислотах таким образом мы можем только определить валентность соединений вроде кислотных остатков, но не всех элементов (кроме известной нам валентности водорода) по отдельности.
Как вы уже обратили внимание, обозначается валентность римскими цифрами.
Валентность и кислоты
Поскольку валентность водорода остается неизменной и хорошо вам известна, вы легко сможете определить и валентность кислотного остатка. Так, к примеру, в H2SO3 валентность SO3 – I, в HСlO3 валентность СlO3 – I.
Аналогчиным образом, если известна валентность кислотного остатка, несложно записать правильную формулу кислоты: NO2(I) – HNO2, S4O6 (II) – H2 S4O6.
Валентность и формулы
Понятие валентности имеет смысл только для веществ молекулярной природы и не слишком подходит для описания химических связей в соединениях кластерной, ионной, кристаллической природы и т.п.
Индексы в молекулярных формулах веществ отражают количество атомов элементов, которые входят в их состав. Правильно расставить индексы помогает знание валентности элементов. Таким же образом, глядя на молекулярную формулу и индексы, вы можете назвать валентности входящих в состав элементов.
Вы выполняете такие задания на уроках химии в школе. Например, имея химическую формулу вещества, в котором известна валентность одного из элементов, можно легко определить валентность другого элемента.
Для этого нужно только запомнить, что в веществе молекулярной природы число валентностей обоих элементов равны. Поэтому используйте наименьшее общее кратное (соответсвует числу свободных валентностей, необходимых для соединения), чтобы определить неизвестную вам валентность элемента.
Чтобы было понятно, возьмем формулу оксида железа Fe2O3. Здесь в образовании химической связи участвуют два атома железа с валентностью III и 3 атома кислорода с валентностью II. Наименьшим общим кратным для них является 6.
- Пример: у вас есть формулы Mn2O7. Вам известна валентность кислорода, легко вычислить, что наименьше общее кратное – 14, откуда валентность Mn – VII.
Аналогичным образом можно поступить и наоборот: записать правильную химическую формулу вещества, зная валентности входящих в него элементов.
- Пример: чтобы правильно записать формулу оксида фосфора, учтем валентность кислорода (II) и фосфора (V). Значит, наименьшее общее кратное для Р и О – 10. Следовательно, формула имеет следующий вид: Р2О5.
Хорошо зная свойства элементов, которые они проявляют в различных соединениях, можно определить их валентность даже по внешнему виду таких соединений.
Например: оксиды меди имеют красную (Cu2O) и черную (CuО) окраску. Гидроксиды меди окрашены в желтый (CuОН) и синий (Cu(ОН)2) цвета.
А чтобы ковалентные связи в веществах стали для вас более наглядными и понятными, напишите их структурные формулы. Черточки между элементами изображают возникающие между их атомами связи (валентности):
Характеристики валентности
Сегодня определение валентности элементов базируется на знаниях о строении внешних электронных оболочек их атомов.
Валентность может быть:
- постоянной (металлы главных подгрупп);
- переменной (неметаллы и металлы побочных групп):
- высшая валентность;
- низшая валентность.
Постоянной в различных химических соединениях остается:
- валентность водорода, натрия, калия, фтора (I);
- валентность кислорода, магния, кальция, цинка (II);
- валентность алюминия (III).
А вот валентность железа и меди, брома и хлора, а также многих других элементов изменяется, когда они образуют различные химические соедения.
Валентность и электронная теория
В рамках электронной теории валентность атома определеяется на основании числа непарных электронов, которые участвуют в образовании электронных пар с электронами других атомов.
В образовании химических связей участвуют только электроны, находящиеся на внешней оболочке атома. Поэтому максимальная валентность химического элемента – это число электронов во внешней электронной оболочке его атома.
Понятие валентности тесно связано с Периодическим законом, открытым Д. И. Менделеевым. Если вы внимательно посмотрите на таблицу Менделеева, легко сможете заметить: положение элемента в перодической системе и его валентность неравзрывно связаны. Высшая валентность элементов, которые относятся к одной и тоже группе, соответсвует порядковому номеру группы в периодичнеской системе.
Низшую валентность вы узнаете, когда от числа групп в таблице Менделеева (их восемь) отнимете номер группы элемента, который вас интересует.
Например, валентность многих металлов совпадает с номерами групп в таблице периодических элементов, к которым они относятся.
Таблица валентности химических элементов
|
Порядковый номер хим. элемента (атомный номер)
|
Наименование |
Химический символ |
Валентность |
| 1
2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 |
Водород / Hydrogen
Гелий / Helium Литий / Lithium Бериллий / Beryllium Бор / Boron Углерод / Carbon Азот / Nitrogen Кислород / Oxygen Фтор / Fluorine Неон / Neon Натрий / Sodium Магний / Magnesium Алюминий / Aluminum Кремний / Silicon Фосфор / Phosphorus Сера / Sulfur Хлор / Chlorine Аргон / Argon Калий / Potassium Кальций / Calcium Скандий / Scandium Титан / Titanium Ванадий / Vanadium Хром / Chromium Марганец / Manganese Железо / Iron Кобальт / Cobalt Никель / Nickel Медь / Copper Цинк / Zinc Галлий / Gallium Германий /Germanium Мышьяк / Arsenic Селен / Selenium Бром / Bromine Криптон / Krypton Рубидий / Rubidium Стронций / Strontium Иттрий / Yttrium Цирконий / Zirconium Ниобий / Niobium Молибден / Molybdenum Технеций / Technetium Рутений / Ruthenium Родий / Rhodium Палладий / Palladium Серебро / Silver Кадмий / Cadmium Индий / Indium Олово / Tin Сурьма / Antimony Теллур / Tellurium Иод / Iodine Ксенон / Xenon Цезий / Cesium Барий / Barium Лантан / Lanthanum Церий / Cerium Празеодим / Praseodymium Неодим / Neodymium Прометий / Promethium Самарий / Samarium Европий / Europium Гадолиний / Gadolinium Тербий / Terbium Диспрозий / Dysprosium Гольмий / Holmium Эрбий / Erbium Тулий / Thulium Иттербий / Ytterbium Лютеций / Lutetium Гафний / Hafnium Тантал / Tantalum Вольфрам / Tungsten Рений / Rhenium Осмий / Osmium Иридий / Iridium Платина / Platinum Золото / Gold Ртуть / Mercury Талий / Thallium Свинец / Lead Висмут / Bismuth Полоний / Polonium Астат / Astatine Радон / Radon Франций / Francium Радий / Radium Актиний / Actinium Торий / Thorium Проактиний / Protactinium Уран / Uranium |
H
He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Сu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Th Pa U |
I
0 I II III (II), IV (I), II, III, IV, V II I 0 I II III (II), IV I, III, V II, IV, VI I, (II), III, (IV), V, VII 0 I II III II, III, IV II, III, IV, V II, III, VI II, (III), IV, VI, VII II, III, (IV), VI II, III, (IV) (I), II, (III), (IV) I, II, (III) II (II), III II, IV (II), III, V (II), IV, VI I, (III), (IV), V 0 I II III (II), (III), IV (II), III, (IV), V (II), III, (IV), (V), VI VI (II), III, IV, (VI), (VII), VIII (II), (III), IV, (VI) II, IV, (VI) I, (II), (III) (I), II (I), (II), III II, IV III, (IV), V (II), IV, VI I, (III), (IV), V, VII 0 I II III III, IV III III, IV III (II), III (II), III III III, IV III III III (II), III (II), III III IV (III), (IV), V (II), (III), (IV), (V), VI (I), II, (III), IV, (V), VI, VII (II), III, IV, VI, VIII (I), (II), III, IV, VI (I), II, (III), IV, VI I, (II), III I, II I, (II), III II, IV (II), III, (IV), (V) II, IV, (VI) нет данных 0 нет данных II III IV V (II), III, IV, (V), VI |
В скобках даны те валентности, которые обладающие ими элементы проявляют редко.
Валентность и степень окисления
Понятие валентности можно считать родственным такой характеристике, как степень окисления. Тем не менее, обе эти характеристики не тождественным друг другу.
Так, говоря о степени окисления, подразумевают, что атом в веществе ионной (что важно) природы имеет некий условный заряд. И если валентность – это нейтральная характеристика, то степень окисления может быть отрицательной, положительной или равной нулю.
Интересно, что для атома одного и того же элемента, в зависимости от элементов, с которыми он образует химическое соединение, валентность и степень окисления могут совпадать (Н2О, СН4 и др.) и различаться (Н2О2, HNO3).
Заключение
Углубляя свои знания о строении атомов, вы глубже и подробнее узнаете и валентность. Эта характеристика химических элементов не является исчерпывающей. Но у нее большое прикладное значение. В чем вы сами не раз убедились, решая задачи и проводя химические опыты на уроках.
Эта статья создана, чтобы помочь вам систематизировать свои знания о валентности. А также напомнить, как можно ее определить и где валентность находит применение.
Надеемся, этот материал окажется для вас полезным при подготовке домашних заданий и самоподготовке к контрольным и экзаменам.
Не забудьте поделиться ссылкой с друзьями в социальных сетях, чтобы они тоже могли воспользоваться этой полезной информацией.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
На чтение 11 мин Просмотров 2.4к. Опубликовано 28.04.2022
Алюминий — 13-й элемент в периодической таблице. Алюминий — элемент 13-й группы. Его символ Ал. Через свои валентные электроны алюминий образует связи. В данной статье подробно рассматриваются валентные элементы для алюминия. Алюминий является переходным металлом в группе бора. Как и в случае с этой группой, он образует соединения в основном со степенью окисления +3. Алюминий является наиболее распространенным металлическим элементом в земной коре, а также наиболее часто используемым цветным металлом. Алюминий не встречается в металлической форме из-за его химической активности. Однако его соединения можно найти почти во всех горных породах и растительности.
Содержание
- Истории
- Использование
- Положение алюминия в периодической таблице.
- Биологическая роль
- Влияние алюминия на здоровье
- Природное изобилие
- Воздействие алюминия на окружающую среду
- Изотопы
- Каковы валентные электроны алюминия (Al)?
- Какое количество электронов, протонов и нейтронов содержит алюминий (Al)?
- Как можно рассчитать количество валентных электронов в атоме алюминия (Al).
- Расчет количества электронов в алюминии (Al)
- Вам нужно будет провести электронные конфигурации алюминия (Al)
- Рассчитайте общее количество электронов и определите валентную оболочку
- Образование соединения алюминия
- Сколько валентных электронов содержит ион алюминия (Al 3+)?
- Какова валентность алюминия (Al)?
- Факты
- Рекомендации:
Истории
В магматических породах алюминий встречается главным образом в алюмосиликатах в полевых шпатах и полевых шпатах и слюдах. Его также можно найти в полученной из них почве в виде глины и после дальнейшего выветривания в виде боксита или богатого железом ларита. Основной источник алюминия находится в магматических породах в виде алюмосиликатов в полевых шпатах, полевых шпатах и слюдах; в полученной из них почве в виде глины; и при дальнейшем выветривании в виде бокситов или богатых железом латеритов. Другие драгоценные камни также содержат алюминий, в том числе топаз и гранат. алунит, криолит – два наиболее важных минерала алюминия.
Датский физик Ганс Христиан Орстед выделил сырой алюминий (1825 г.) путем восстановления сплава хлорида алюминия и калия. Сэр Хамфри Дэви, британский химик, создал (1809 г.) сплав железа и алюминия путем электролиза расплавленного оксида алюминия (оксид алюминия) и ранее дал название элементу. Фридрих Велер из Германии произвел алюминиевый порошок (1827 г.) и небольшие шарики (1845 г.), используя металлический калий в качестве восстановителя. По ним он смог определить некоторые свойства металла.
Использование
Алюминий можно использовать во многих продуктах, включая алюминиевую фольгу, кухонную утварь и оконные рамы. Именно благодаря уникальным свойствам алюминия он так популярен. Он имеет низкую плотность, нетоксичен и обладает высокой теплопроводностью. Его также можно легко отливать, обрабатывать и формовать. Он также немагнитен и не искрит. Это второй по пластичности и шестой по пластичности металл.
Поскольку алюминий не очень прочен, его часто используют в виде сплава. Алюминиевые сплавы, изготовленные из марганца и магния, а также кремния, легкие, но очень прочные. Эти сплавы имеют жизненно важное значение в конструкции самолетов и других видов транспорта. Алюминий образует отражающее покрытие, которое отражает свет и тепло при испарении в вакууме. Он не портится, как покрытие с серебряным покрытием. Алюминий является отличным проводником электричества и часто используется в линиях электропередач. Алюминий более доступен по цене, чем медь, и в два раза эффективнее меди в проводниках.
Положение алюминия в периодической таблице.
Биологическая роль
У алюминия нет биологической функции. Он токсичен для растений в растворимой форме +3. Кислые почвы составляют почти половину пахотных земель на Земле. Кислотность ускоряет высвобождение минералов Al3+. Al3+ может поглощаться сельскохозяйственными культурами, что приводит к снижению урожайности. Алюминий может накапливаться в организме. Связь с болезнью Альцгеймера (старческая потеря памяти) была предложена, но не доказана.
Количество алюминия в нашем рационе усваивается только нашим телом. За исключением приготовления пищи с кислыми продуктами, такими как ревень, использование алюминиевых кастрюль для приготовления пищи не увеличивает потребление пищи. Чистый гидроксид алюминия иногда используется в таблетках от расстройства желудка.
Влияние алюминия на здоровье
Алюминий является одновременно одним из наиболее часто используемых металлов и одним из наиболее распространенных соединений, встречающихся в земной коре. Из-за этих фактов алюминий часто называют невинным соединением. Однако высокий уровень алюминия может привести к проблемам со здоровьем. Эти вредные эффекты вызваны растворимой в алюминии формой. Они известны как ионы. Эти частицы часто встречаются в растворах алюминия, которые содержат другие ионы, такие как хлор алюминия.
Природное изобилие
Алюминий (8,1%) является наиболее распространенным металлом в земной коре, но редко встречается в природе в несоединенном виде. Его можно найти в таких минералах, как боксит или криолит. Этими минералами являются силикаты алюминия. Метод Холла-Эру является наиболее распространенным способом извлечения алюминия. Этот процесс включает растворение оксида алюминия в расплавленном криолите с последующим электролитическим восстановлением его до чистого алюминия. Производство алюминия чрезвычайно энергоемко. Производство алюминия потребляет 5% электроэнергии, производимой в США.
| атомный номер | 13 |
|---|---|
| атомный вес | 26.9815384 |
| точка кипения | 2467 ° С (4473 ° F) |
| температура плавления | 660 ° С (1220 ° F) |
| удельный вес | 2,70 (при 20 ° C [68 ° F]) |
| валентность | 3 |
| электронная конфигурация | 1 с 2 2 с 2 2 т 6 3 с 2 3 т 1 |
Воздействие алюминия на окружающую среду
Мы заметили эффекты алюминия, в основном из-за его подкисляющих свойств. Алюминий может накапливаться в растениях, и это может вызвать проблемы со здоровьем у животных, которые едят эти растения. Подкисленные озера имеют самые высокие концентрации алюминия. В этих озерах сокращается количество амфибий и рыб в результате реакций ионов алюминия и белков в жабрах и зародышах лягушек.
Высокий уровень алюминия может оказывать неблагоприятное воздействие на рыбу, а также птиц и других животных, которые едят зараженную рыбу и насекомых, а также на животных, вдыхающих воздух, содержащий алюминий.
Изотопы
Алюминий-27, единственный встречающийся в природе изотоп алюминия, является единственным. Элемент может состоять из нескольких форм, называемых изотопами. Массовое число изотопов отличает их друг от друга. Массовое число элемента указывается числом справа от его названия. Массовое число – это сумма всех протонов и нейтронов, находящихся в ядре элемента. Хотя количество протонов в элементе является наиболее важным, количество нейтронов в атоме также может варьироваться. Каждая вариация называется изотопом.
Алюминий — второй элемент в группе 13. Валентный электрон относится к числу электронов, оставшихся на конечной орбите. Валентные электроны – это количество электронов, оставшихся в оболочке после завершения электронной конфигурации. Свойства элемента определяются валентными электронами. Они также участвуют в образовании связей. Алюминий (Al) — тринадцатый элемент периодической таблицы. Атом элемента алюминия содержит тринадцать электронов. На этом сайте есть статья, в которой объясняется электронная конфигурация алюминия (Al). Вы можете прочитать его, если это необходимо.
Какое количество электронов, протонов и нейтронов содержит алюминий (Al)?
Ядро можно найти в середине атома. Ядро содержит протоны и нейтроны. Атомный номер алюминия равен 13. Число протонов в алюминии называется атомным номером. Количество протонов в алюминии (Al) равно тринадцати. Ядро содержит электронную оболочку, имеющую круглую форму и содержащую равные им протоны. Это означает, что атом алюминия может иметь общее число тринадцати электронов.
Разница между числом атомов и числом атомных масс определяет число нейтронов в элементе. Это означает, что число нейтронов (n) = атомная масса (A) + атомный номер (Z).
Мы знаем, что 13 — это атомный номер алюминия, а 27 — атомное массовое число. Нейтрон (n) = 27 – 13 = 14. Следовательно, количество нейтронов в алюминии (Al) равно 14.
Валентность – это способность атома химического элемента образовывать определенное количество химических связей с другими атомами. Он принимает значения от 1 до 8 и не может быть равен 0. Он определяется количеством электронов атома, потраченных на образование химических связей с другим атомом. Валентность является реальной ценностью. Числовые значения валентности обозначены римскими цифрами (I,II,III,IV,V,VI,VII,VIII).
Как можно рассчитать количество валентных электронов в атоме алюминия (Al).
Это шаги для определения валентного электрона. Одной из них является электронная конфигурация. Без электронной конфигурации невозможно определить валентность любого элемента. Легко определить валентность любого элемента, зная электронную конфигурацию. На этом сайте есть статья, объясняющая расположение электронов. Вы можете найти это здесь. Эта статья посвящена электронной конфигурации.
Вы можете идентифицировать валентные электроны, размещая электроны в соответствии с принципом Бора. Теперь мы узнаем, как идентифицировать валентный электрон для алюминия (Al).
Термины « степень окисления » и « валентность » могут не совпадать, но численно они почти идентичны. Условный заряд атома атома называется степенью окисления. Он может быть как положительным, так и отрицательным. Валентность относится к способности атома образовывать связи. Он не может иметь отрицательное значение.
Расчет количества электронов в алюминии (Al)
Во -первых , нам нужно знать общее количество электронов в атоме алюминия (Al). Вам нужно знать, сколько протонов в алюминии, чтобы определить число электронов. Чтобы узнать количество протонов в алюминии, необходимо также знать его атомный номер.
Периодическая таблица необходима для определения атомного номера. Периодическая таблица содержит атомный номер для элементов алюминия (Al). Число протонов называется атомным номером. Ядро также содержит электроны, равные протонам.
Это означает, что теперь мы можем сказать, что число электронов в атоме алюминия равно его атомному номеру. Атомный номер алюминия по периодической таблице равен 13. Это означает, что атом алюминия (Al) содержит в общей сложности тринадцать электронов.
- Валентность — числовая характеристика способности атомов данного элемента связываться с другими атомами.
- Валентность водорода постоянна и равна единице.
- Валентность кислорода также постоянна и равна двум.
- Валентность большинства других элементов непостоянна. Его можно определить по формулам их бинарных соединений с водородом или кислородом.
Вам нужно будет провести электронные конфигурации алюминия (Al)
Важный шаг 2. Этот шаг включает в себя расположение электронов алюминия (Al). Общее число электронов в атомах алюминия равно тринадцати. Электронная структура алюминия показывает, что на каждой оболочке по три электрона.
Это означает, что первая оболочка алюминия содержит два электрона, а вторая оболочка имеет восемь электронов. На третьей оболочке три электрона. По суборбите электронная конфигурация алюминия (Al) выглядит следующим образом: 1s 2 2s 2 2p 6 3s 2 3p 1 .
Рассчитайте общее количество электронов и определите валентную оболочку
Третий шаг – определение валентности. Валентная оболочка является последней оболочкой после электронной конфигурации. Валентный электрон – это сумма всех электронов, находящихся на валентной оболочке. Электронная конфигурация алюминия (Al) указывает на то, что последняя алюминиевая оболочка имеет три электрона (3s 2 3p 1 ). Следовательно, валентных электронов у алюминия три.
Образование соединения алюминия
Через свои валентные электроны алюминий участвует в образовании связей. Как известно, в алюминии находятся три валентных электрона. Этот валентный электрон участвует в образовании связей с другими элементами. Электронная конфигурация кислорода указывает на то, что в кислороде шесть валентных электронов. Атом алюминия отдает свои валентные электроны, а атом кислорода их получает.
Это означает, что кислород приобретает электронную конфигурацию неона, как и атомы алюминия. Al 2 O 3 образуется в результате обмена электронами между двумя атомами алюминия и тремя атомами кислорода. Ионная связь — это то, что образует оксид алюминия (Al 2 O 3 ).
Сколько валентных электронов содержит ион алюминия (Al 3+ )?
Электронная конфигурация завершается, когда оболочка, содержащая последний электрон атома алюминия, имеет три электрона. Валентность алюминия в данном случае равна 3. Это то, что мы знаем. Во время образования связи элементы с 1, 2 или тремя электронами на последних оболочках отдают эти электроны следующей оболочке.
Катионы – это элементы, отдающие электроны для образования связей. Алюминий отдает электрон с оболочки, образовавшей связи, и становится ионами алюминия. Алюминий является катионным элементом.
Электронная конфигурация иона алюминия (Al 3+ ) 1s 2 2s 2 2p 6 . Электронная конфигурация иона алюминия показывает, что алюминий имеет только две оболочки, а последняя оболочка содержит восемь электронов. Электронная конфигурация указывает на то, что ион алюминия (Al 3+ ) имеет электронную конфигурацию неона.
В этом случае валентность иона алюминия будет +3. Валентные электроны иона алюминия (Al 3+ ) имеют восемь электронов на своей последней оболочке.
Какова валентность алюминия (Al)?
Валентность (или валентность) — это способность атома элемента в молекуле присоединяться к другому атому при образовании. Есть несколько правил, которые можно использовать для определения валентности. Валентность элемента — это количество электронов, находящихся в неспаренном состоянии в оболочке, следующей за электронной конфигурацией.
Электронная конфигурация элемента в возбужденном состоянии определяет его ценность. Al*(13), электронная конфигурация алюминия (Al) в возбужденном состоянии имеет вид 1s 2 2s 2 2p 6 3s 1 3p x 1 3p y 1 . Электронная конфигурация алюминия указывает на то, что он имеет три неспаренных электрона на последней оболочке (3s 1 3p x 1 3p y 1 ).
Таким образом, валентность алюминия (Al) равна 3.
Факты
- Атомный символ (по Периодической таблице элементов: Al).
- 13 — это атомный номер, обозначающий количество протонов в ядре.
- Средняя масса атома (атомный вес): 26,9815386.
- Al-27 (стабильный) и Al-26 (радиоактивный; период полураспада 730 000 лет) являются наиболее распространенными изотопами.
- Фаза при комнатной температуре: твердая.
- Температура плавления: 1220,58 градуса по Фаренгейту (660,32 градуса по Цельсию).
- Плотность: 2,70 г на кубический сантиметр.
- Количество конюшен: 22.
- Температура кипения: 4566 градусов по Фаренгейту (2519 градусов по Цельсию).
Рекомендации:
- https://en.wikipedia.org/wiki/Aluminium
- https://www.britannica.com/science/aluminum
- https://periodic.lanl.gov/13.shtml
- https://www.cdc.gov/niosh/npg/npgd0022.html
- Ян Макнил, Энциклопедия истории технологий (1996).
- Дэвид Р. Лайд, CRC Handbook of Chemistry and Physics (2007).