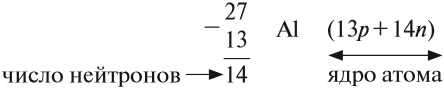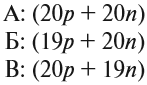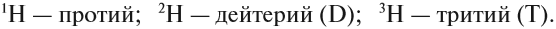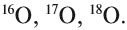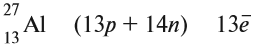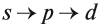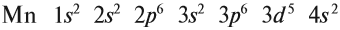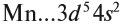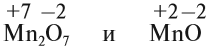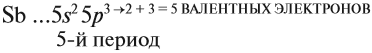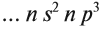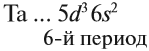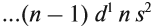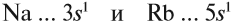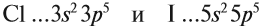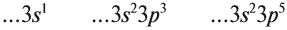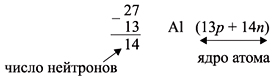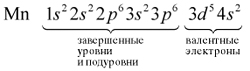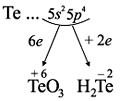|
Посмотрим на гениальную таблицу “Периодическая система элементов” от русского ученого Дмитрия Менделеева. Таблица Дмитрия Менделеева весьма стройная и системная. Она отвечает на многие вопросы, в том числе и на заданный вами. Максимальное число электронов на энергетическом уровне: где n – номер энергетического уровня система выбрала этот ответ лучшим Вита75 8 лет назад Таблица Менделеева состоит из 8-ми столбцов, соответственно элементы в 1-ом столбце будут иметь по 1 электрону на внешнем слое , а в 8-ом по 8. Собственно количество электронов и определяет свойства элемента, (например щелчные металлы очень активны, а энертвые газы наоборот фактически не вступают ни в какие реакции). это связано с тем, что чем меньше электронов на внешнем слое тем их легче потерять, и труднее захватить свободный электрон при потере. Так же есть такие элементы как изотопы, которые при одинаковом количестве электронов на внешней оболочке имеют кординально разные свойства. (например дейтерий и тритий) оба имеют по 1-му электрону, но ядро дейтерия состоит из положительно заряженного протона и нейтрального нейтрона, он стабилен и относится скорее к водороду (тяжелый водород), а тритий, состоящий из протона и 2-ух нейтронов, радиактивен и по свойствам ближе к литию. В порироде не встречается из-за короткой живучести (период полураспада примерно 12 лет). Так к слову, есть такой изотоп кальция 48, имеется в виду что у него не 40 нейтронов в ядре как у обычного кальция у нас в костях, а 48, радиактивен, (в природе встречается крайне редко), нарабатывается в атомных реакторах, обстрелом нейтронами, несколько грамм за год. Служит для получения сверхтяжелых элементов (путем обстрела мишени из урана, плутония и т.д.). на данный момент самый дорогой элемент, 1 грамм стоит около 400000 евро. Чосик более года назад Для этого потребуется таблица Менделеева. В ней восемь групп, которые представлены как восемь столбиков. И как раз номер группы указывает, сколько электронов у элемента на последнем внешнем уровне. Например, берем водород – Н. Он относится к первой группе, идет первым. А мы знаем, что порядковый номер элемента совпадает с числом электронов на обиталях и с числом протонов в ядре. И у водорода на s-орбитали один электрон. Теперь берем литий – Li. Он также относится к первой группе, идет третьим. Его s-орбиталь заполнена, там два электрона. А последний, третий, находится на второй s-орбитали. Номер же периода указывается на число энергетических уровней. Литий относится ко второму периоду, потому у него два энергетических уровня. KritikSPb 4 года назад Чтобы определить, сколько электронов на внешнем энергетическом уровне, нужно открыть Периодическую таблицу Менделеева. В ней расположено 8 групп элементов. Номера группы и соответствуют количеству электронов на внешнем уровне. Например, элементы Гелий, аргон, железо, криптон, рутений, ксенон, осмий и радон принадлежат к восьмой группе, значит и электронов на внешнем уровне 8. У лития, натрия и калия – по одному электрону, у берилия, магния и кальция – 2, у алюминия – 3, у кремния и титана – по 4, у серы и хрома – по 6, у хлора и марганца – 7. Далее определяем электронные уровни элементов по аналогии. владсандрович более года назад Для решения данной задачи, нам просто необходимо, будет взглянуть в таблицу Менделеева. Она насчитывает в себе восемь групп. Они расположены в порядке восьми столбиков. Каждая группа имеет свой номер и этот самый номер как раз таки и говорит нам о том , сколько электронов имеет в себе тот или иной элемент, касательно его последнего внешнего уровня. Например железо относится к восьмой группе, а значит электронов на внешнем уровне оно имеет именно 8. Знаете ответ? |
Атомно-молекулярное учение
Мы приступаем к изучению химии – мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а – отриц. частица + tomos – отдел, греч. atomos – неделимый) – электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется “планетарной” и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos – первый) – положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter – ни тот, ни другой) – нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron – янтарь) – стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома –
порядковый номер в таблице Менделеева – равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной “1s” ячейки, в которой помещаются 2 электрона (заполненный электронами – 1s2)
Состоит из s-подуровня: одной “s” ячейки (2s2) и p-подуровня: трех “p” ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной “s” ячейки (3s2), p-подуровня: трех “p” ячеек (3p6) и d-подуровня:
пяти “d” ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной “s” ячейки (4s2), p-подуровня: трех “p” ячеек (4p6), d-подуровня:
пяти “d” ячеек (4d10) и f-подуровня: семи “f” ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: “s”, “p” и “d”, которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный “рисунок”.
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь – клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной “ячейке”) не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода – 6, у серы – 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод – 1s22s22p2
- Серы – 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне – это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод – 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью – способностью атомов образовывать определенное число химических связей.

- Углерод – 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и скандия:
- Магний – 1s22s22p63s2
- Скандий – 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением – провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую “неправильную” (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
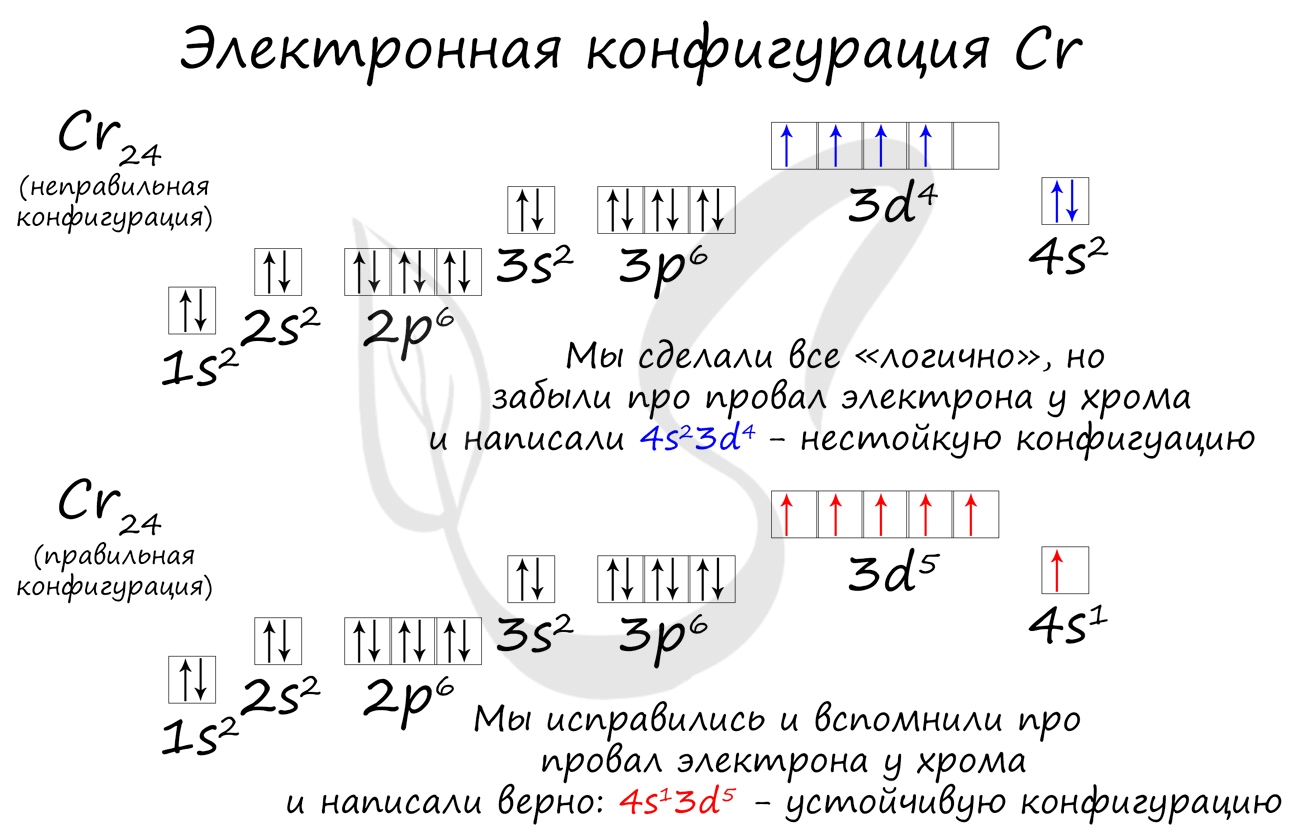
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора – возбужденное состояние невозможно, так как отсутствуют свободные орбитали (“ячейки”) – электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
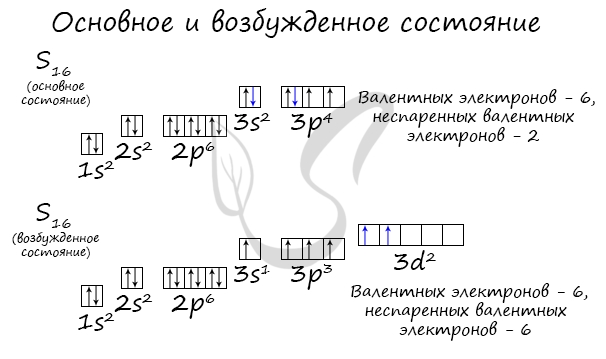
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Вспомните:
- что такое атом;
- из чего состоит атом;
- изменяется ли атом в химических реакциях?
АТОМ — это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Число электронов в ходе химических процессов может изменяться, но заряд ядра всегда остается неизменным. Зная распределение электронов в атоме (строение атома), можно предсказать многие свойства данного химического элемента, а также простых и сложных веществ, в состав которых этот элемент входит.
Содержание
- Структура Периодической системы Менделеева
- Ядро атома. Изотопы
- Распределение электронов в поле ядра атома
- Строение атома и свойства элементов
- Выводы
Структура Периодической системы Менделеева
Строение атома, т. е. состав ядра, распределение электронов вокруг ядра, несложно определить по положению элемента в Периодической системе. В Периодической системе Менделеева химические элементы располагаются в определённой последовательности. Эта последовательность тесно связана со строением атома этих элементов. Каждому химическому элементу в системе присвоен порядковый номер, кроме того, для него можно указать:
- номер периода;
- номер группы;
- вид подгруппы.
Зная точный «адрес» химического элемента, т. е. его группу, подгруппу и номер периода, можно однозначно определить строение его атома.
Период — это горизонтальный ряд химических элементов. В современной Периодической системе семь периодов. Первые три — малые, так как они содержат 2 или 8 элементов:
- 1-й период — Н, Не — 2 элемента;
- 2-й период — Li…Nе — 8 элементов;
- 3-й период — Na…Аr — 8 элементов.
Остальные периоды — большие. Каждый из них содержит 2–3 ряда элементов:
- 4-й период (2 ряда) — К…Кr — 18 элементов;
- 6-й период (3 ряда) — Сs…Rn — 32 элемента. В этот период входит ряд лантаноидов.
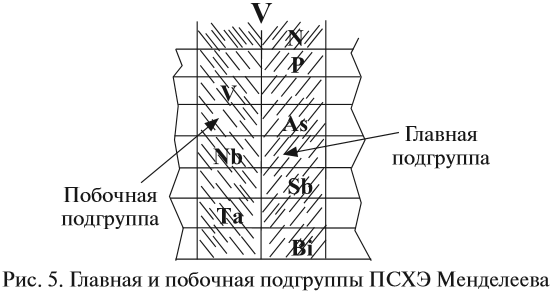
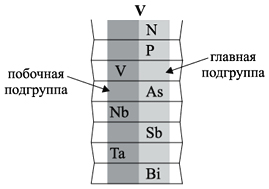
Группа — вертикальный ряд химических элементов. Всего групп восемь. Каждая группа состоит из двух подгрупп: главной подгруппы и побочной подгруппы (см. рис. 5).
Главную подгруппу (подгруппу А) образуют химические элементы малых периодов и больших периодов. На рисунке 5 показано, что главную подгруппу пятой группы составляют элементы малых периодов (N, P) и больших периодов (As, Sb, Bi).
Побочную подгруппу (подгруппу Б) образуют химические элементы только больших периодов. В нашем случае это V, Nb, Ta.
Визуально эти подгруппы различить легко: главная подгруппа «высокая», начинается с первого или второго периода. Побочная подгруппа — «низкая», начинается с 4-го периода.
Итак, каждый химический элемент Периодической системы имеет свой адрес:
- период;
- группу;
- подгруппу;
- порядковый номер.
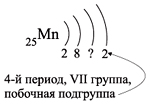
Например, ванадий (V) — это химический элемент 4-го периода, V группы, побочной подгруппы, порядковый номер 23.
Задание 3.1. Укажите период, группу и подгруппу для химических элементов с порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и название химического элемента, если известно, что он находится:
- в 4-м периоде, VI группе, побочной подгруппе;
- в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать эти сведения об элементе со строением его атома?
Ядро атома. Изотопы
Атом состоит из ядра, которое имеет положительный заряд, и электронов, которые имеют отрицательный заряд. В целом атом электронейтрален.
Положительный заряд ядра атома равен порядковому номеру химического элемента.
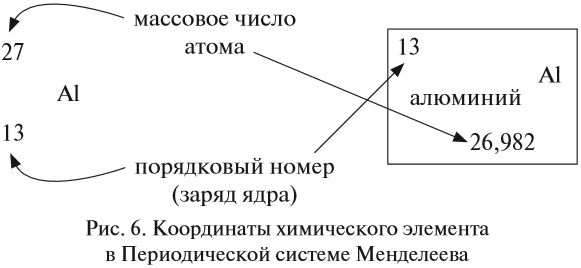
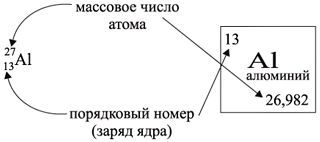
Ядро атома — сложная частица. В ней сосредоточена почти вся масса атома. Поскольку химический элемент — совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают (рис. 6).
По этим данным можно определить состав ядра. Ядро состоит из протонов и нейтронов.
- Протон (р) имеет массу, равную 1 (1,0073 а. е. м.) и заряд, равный +1.
- Нейтрон (n) заряда не имеет (нейтрален), а масса его приблизительно равна массе протона (1,0087 а. е. м.).
Какие частицы определяют заряд ядра? Протоны! Причём число протонов равно (по величине) заряду ядра атома, т. е. порядковому номеру:
Число нейтронов определяют по разности между величинами: «масса ядра» и «порядковый номер».
Задание 3.3. Определите состав ядер атомов, если химический элемент находится в:
- 3-м периоде, VII группе, главной подгруппе;
- 4-м периоде, IV группе, побочной подгруппе;
- 5-м периоде, I группе, главной подгруппе.
Обратите внимание, что при определении массового числа ядра атома приходится округлять атомную массу, указанную в Периодической системе! Почему? Ведь массы протона и нейтрона практически целочисленны, а массой электронов можно пренебречь.
Для того,чтобы ответить на этот вопрос, нужно понять:
- Что происходит с атомом в ходе химических процессов;
- Что такое «химический элемент».
В химических процессах обязательно изменяется распределение электронов вокруг ядра или даже изменяется их число. В последнем случае атом отдаёт или принимает электроны и превращается в заряженную частицу — ион. Но в химических реакциях никогда не меняется состав ядра атома, его заряд. Поэтому заряд ядра атома является своеобразным «паспортом» химического элемента.
Химический элемент — совокупность атомов или ионов с одинаковым зарядом ядра.
Для того чтобы разобраться, попробуйте определить, какие из ядер, состав которых указан ниже, принадлежат одному и тому же химическому элементу:
Атомам одного химического элемента принадлежат ядра А и В, так как они содержат одинаковое число протонов, т. е. заряд этих ядер одинаковый. Но ведь у них разная масса! Исследования показывают, что масса атома не оказывает существенного влияния на его химические свойства. Поэтому атомы одного и того же химического элемента (одинаковое число протонов), но с разной массой (разное число нейтронов) являются ИЗОТОПАМИ* этого элемента.
* Слово «изотоп» означает по смыслу «одно место», т. е. все изотопы данного химического элемента находятся в одной клетке ПСХЭ.
В таблице Менделеева указана средняя атомная масса всех природных изотопов данного элемента (Аr). Изотопы и их химические соединения отличаются друг от друга по физическим свойствам, но химические свойства у изотопов одного химического элемента одинаковы. Так, изотоп углерода-14 (14С) имеет такие же химические свойства, как и углерод-12 (12С), который входит в ткани любого живого организма, отличаясь от него только радиоактивностью. Поэтому изотопы применяют для диагностики и лечения различных заболеваний, для научных исследований.
Элемент «водород» встречается в природе в виде трёх изотопов:
Химический элемент «кислород» также представлен тремя природными изотопами:
Задание 3.4. Укажите состав ядер этих изотопов водорода и кислорода.
Если разные вещества содержат атомы одного и того же химического элемента, это не означает, что эти вещества имеют одни те же свойства. Например, химический элемент «хлор» в виде атомарного хлора Cl• разрушает метан, а также атмосферный озон. Тот же элемент в виде молекулярного хлора Cl2 ядовит, активно реагирует с водой, многими металлами, а ионы хлора (химический элемент — тот же!) в составе NaCl химически инертен, а с биологической точки зрения не только безвреден, но и полезен для нас. Эти ионы являются макроэлементами нашей пищи, которые входят в состав крови, желудочного сока. Суточная потребность — до 6 граммов.
Но вернемся к описанию строения атома.
Распределение электронов в поле ядра атома
Как известно, ядро атома в химических процессах не меняется. А что меняется? Общее число электронов и распределение электронов. Общее число электронов определить несложно: оно равно порядковому номеру, т. е. заряду ядра атома:
Электроны имеют отрицательный заряд –1, а масса их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны отталкиваются и поэтому находятся на разных расстояниях от ядра. При этом электроны, имеющие приблизительно равный запас энергии, образуют энергетический уровень.
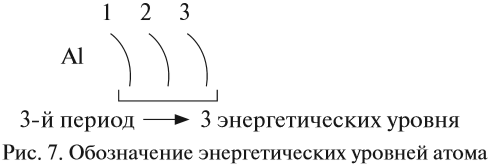
Число энергетических уровней в атоме равно номеру периода, в котором находится химический элемент. Энергетические уровни условно обозначают так (рис. 7).
Задание 3.5. Определите число энергетических уровней в атомах кислорода, магния, кальция, свинца.
На каждом энергетическом уровне может находиться ограниченное число электронов:
- на первом энергетическом уровне не более 2 электронов;
- на втором энергетическом уровне не более 8 электронов;
- на третьем энергетическом уровне не более 18 электронов.
ЗАПОМНИТЕ ЭТИ ЧИСЛА!
Они показывают, что, например, на втором энергетическом уровне может находиться 2 или 5 или 7 электронов, но не может быть 9 или 12 электронов.
Важно знать, что, независимо от номера энергетического уровня, на внешнем (последнем) уровне не может быть больше восьми электронов. Внешний восьмиэлектронный энергетический уровень является наиболее устойчивым и называется завершённым. Такие энергетические уровни имеются у самых неактивных элементов — благородных газов.
Как определить число электронов на внешнем уровне остальных атомов? Для этого существует простое правило – число внешних электронов равно:
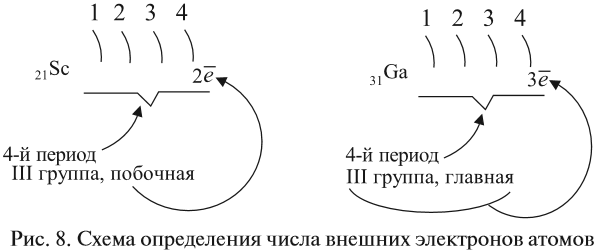
- для элементов главных подгрупп — номеру группы;
- для элементов побочных подгрупп — оно не может быть больше двух (рис. 8).
Например:
Задание 3.6. Укажите число внешних электронов для химических элементов с порядковыми номерами 15, 25, 30, 53.
Задание 3.7. Найдите в Периодической системе химические элементы, в атомах которых имеется завершённый внешний уровень.
Очень важно правильно определять число внешних электронов, так как именно с ними связаны важнейшие свойства атома. Так, в химических реакциях атомы стремятся «приобрести» устойчивый, завершённый внешний уровень (8ē). Для этого атомы, на внешнем уровне которых мало электронов, «предпочитают» их отдать.
Химические элементы, атомы которых способны только отдавать электроны, относятся к МЕТАЛЛАМ. Очевидно, что на внешнем уровне атома металла должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома много электронов, то такие атомы стремятся принять электроны до завершения внешнего энергетического уровня, т. е. до восьми электронов. Такие элементы относятся к НЕМЕТАЛЛАМ.
Вопрос. К каким элементам (металлам или неметаллам) относятся химические элементы побочных подгрупп? Почему?
Металлы и неметаллы главных подгрупп в таблице Менделеева отделяет линия, которую можно провести от бора к астату. Выше этой линии (и на линии) располагаются неметаллы, ниже — металлы.
Задание 3.8. Определить, к металлам или неметаллам относятся: фосфор, ванадий, кобальт, селен, висмут. Вывод сделайте, определив положение элемента в Периодической системе химических элементов и число электронов на внешнем уровне.
Для того чтобы составить распределение электрона по остальным уровням и подуровням, следует воспользоваться следующим АЛГОРИТМОМ:
- Определить общее число электронов в атоме (по порядковому номеру).
- Определить число энергетических уровней (по номеру периода).
- Определить число внешних электронов (по виду подгруппы и номеру группы).
- Указать число электронов на всех уровнях, кроме предпоследнего.
- Рассчитать число электронов на предпоследнем уровне.
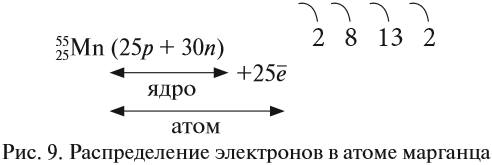
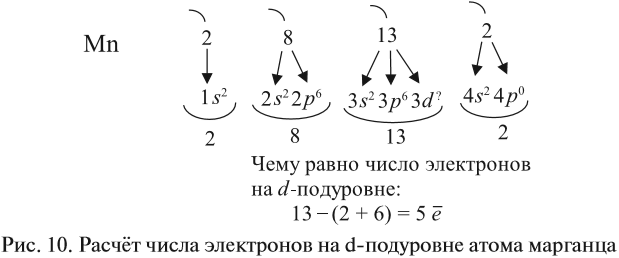
Например, согласно пунктам 1…4 для атома марганца определено:
Получили распределение электронов в атоме марганца (рис. 9):
Задание 3.9. Отработайте алгоритм, составив схемы строения атомов для элементов № 16, 26, 33, 37. Укажите: металлы это или неметаллы? Ответ поясните.
Составляя вышеприведенные схемы строения атома, мы не учитывали, что электроны в атоме занимают не только определённые уровни, но и определённые подуровни каждого уровня. Вид подуровня обозначается латинской буквой: s, p, d.
Число возможных подуровней равно номеру уровня, т. е.
- первый уровень состоит из одного s-подуровня;
- второй уровень состоит из двух подуровней: s и р и т. д.
На каждом подуровне может находиться строго ограниченное число электронов:
- на s-подуровне — не больше 2ē;
- на р-подуровне — не больше 6ē;
- на d-подуровне — не больше 10ē.
Подуровни одного уровня заполняются в строго определённом порядке:
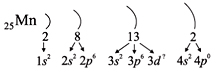
Таким образом, р-подуровнь не может начать заполняться, если не заполнен s-подуровень данного энергетического уровня и т. д. Исходя из этого правила, несложно составить электронную конфигурацию атома марганца (рис. 10).
В целом электронная конфигурация атома марганца выглядит так:
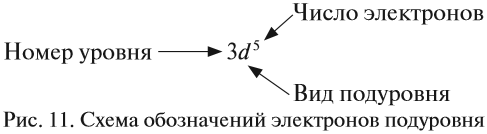
Здесь и далее приняты обозначения (рис. 11).
Задание 3.10. Составьте электронные конфигурации атомов для химических элементов № 16, 26, 33, 37.
Для чего необходимо составлять электронные конфигурации атомов? Для того чтобы определять свойства этих химических элементов!
Для этого следует помнить: в химических процессах участвуют только валентные электроны.
Валентные электроны находятся на внешнем энергетическом уровне и незавершённом d-подуровне предвнешнего уровня.
Определим число валентных электронов для марганца:
или сокращённо:
Строение атома и свойства элементов
Мы получили краткую электронную формулу атома марганца, которая отражает распределение его валентных электронов. Что можно определить по этой формуле?
1. Какие свойства — металла или неметалла — преобладают у этого элемента? Ответ: марганец — металл, так как на внешнем (четвёртом) уровне 2 электрона.
2. Какой процесс характерен для металла? Ответ: всегда только отдача электронов.
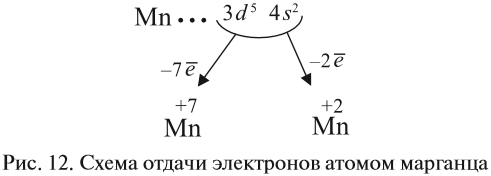
3. Какие электроны и сколько их будет отдавать атом марганца? Ответы:
- два внешних электрона (они дальше всех от ядра и слабее притягиваются им);
- семь (2+5) валентных электронов (так как в этом случае на третьем уровне атома останется восемь электронов, т. е. образуется завершённый уже внешний уровень).
Все эти рассуждения и заключения можно отразить при помощи схемы (рис. 12).
Полученные условные заряды атома называются степенью окисления.
Рассматривая строение атомов кислорода и водорода и рассуждая аналогично, можно показать, что типичными степенями окисления для кислорода является –2, а для водорода +1.
Вопрос. С каким из этих химических элементов может образовывать соединения марганец, если учесть полученные выше степени окисления его?
Только с кислородом, так как его атом имеет противоположную по заряду (знаку) степень окисления. В этом случае несложно составить формулы соответствующих оксидов марганца (здесь степени окисления соответствуют валентностям этих химических элементов):
Строение атома марганца подсказывает, что большей степени окисления, чем +7, у марганца быть не может, так как в этом случае пришлось бы затрагивать устойчивый, теперь уже завершённый предвнешний уровень. Поэтому степень окисления +7 является высшей, а соответствующий оксид Мn2О7 — высшим оксидом марганца.
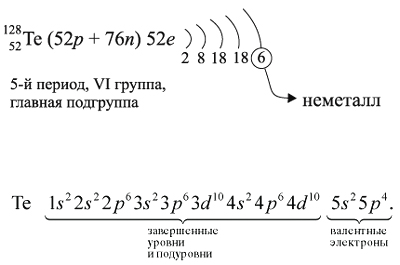
Для закрепления всех этих понятий рассмотрим строение атома теллура и некоторые его свойства (см. рис. 13). Этот рисунок показывает, что теллур относится к неметаллам, так как, во-первых, у него на внешнем уровне шесть электронов и, во-вторых, его символ находится в главной подгруппе выше линии В — At. Поэтому его атом может и принимать (до завершения внешнего уровня, и отдавать электроны. В результате, в отличие от металлов, неметалл теллур может проявлять низшую степень окисления (–2) и образовывать летучие водородные соединения с водородом (Н2Те). Высшая степень окисления атома теллура (+6), как и у металлов соответствует номеру группы и, находясь в этой степени окисления, теллур образует высший оксид ТеО3.
Задание 3.11. Изобразить электронные конфигурации атомов Nа, Rb, Сl, I, Si, Sn. Определить свойства этих химических элементов, формулы их простейших соединений (с кислородом и с водородом).
Сделаем выводы.
- В химических реакциях участвуют только валентные электроны, которые могут находиться только на последних двух уровнях.
- Атомы металлов могут только отдавать эти электроны (все или несколько), принимая положительные степени окисления.
- Атомы неметаллов могут принимать (недостающие до восьми) электроны, получая при этом отрицательные степени окисления, и отдавать валентные электроны (все или несколько), принимая при этом положительные степени окисления.
Возникает вопрос: как составить краткую электронную формулу (распределение валентных электронов), сразу, не составляя длинных электронных конфигураций? Для этого нужно помнить несколько простых правил.
1. Номер периода соответствует числу энергетических уровней у атомов химических элементов этого периода.
2. Номер группы, как правило, совпадает с числом валентных электронов, (исключение составляют только подгруппы меди и железа).
3. Подгруппа (главная или побочная) включает химические элементы, у которых имеется одинаковое распределение валентных электронов, причём в атомах элементов главной и побочной подгруппы электроны распределяются по-разному.
3.1. У элементов главных подгрупп все валентные электроны находятся на внешнем уровне, например:
V группа, главная → 5 валентных электронов
Поэтому для всех химических элементов главной подгруппы пятой группы (пять валентных электронов) распределение этих электронов следующее:
3.2. У элементов побочных подгрупп число внешних электронов не превышает двух, например:
5 валентных электронов ← V группа, побочная → 2 электрона на внешнем уровне*.
* За счёт «провала электрона» число внешних электронов может быть меньше. Но число валентных электронов при этом не меняется, поэтому свойства элемента будут такими же. Эти случаи рассмотрены в Самоучителе второго уровня, часть 1.
Для большинства химических элементов побочных подгрупп, у которых на внешнем энергетическом уровне два электрона, остальные (N – 2) валентные электроны будут находиться на d-подуровне предвнешнего уровня (N – номер группы), например:
Вопрос. Для элементов какой группы составлена такая запись?
Задание 3.12. Составьте краткие электронные формулы для атомов химических элементов № 35 и 42, а затем составьте распределение электронов в этих атомах по алгоритму. Убедитесь, что ваше «предсказание» сбылось.
Сравним теперь свойства химических элементов одной подгруппы, например:
Что общего в строении атомов этих элементов? На внешнем уровне каждого атома по одному электрону — это активные металлы. Металлическая активность связана со способностью отдавать электроны: чем легче отдает электроны атом, тем сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их к ядру. Чем ближе электроны к ядру, тем сильнее они притягиваются ядром атома, тем труднее их «оторвать».
Исходя из этого, сделаем вывод: какой элемент — Nа или Rb — легче отдает внешний электрон? Какой из них является более активным металлом? Очевидно, рубидий, так как его валентные электроны находятся дальше от ядра (и слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз металлические свойства усиливаются, так как возрастает радиус атома и валентные электроны слабее притягиваются к ядру.
Сравним свойства:
Оба химических элемента — неметаллы, так как до завершения внешнего уровня не хватает одного электрона, и эти атомы будут активно притягивать недостающий электрон. При этом, чем сильнее притягивает атом неметалла недостающий электрон, тем сильнее проявляются его неметаллические свойства (способность принимать электроны).
За счёт чего происходит притяжение электрона? За счёт положительного заряда ядра атома. Но в таком случае чем ближе электрон к ядру, тем сильнее их взаимное притяжение, тем активнее неметалл.
Сделаем вывод, у какого элемента сильнее выражены неметаллические свойства: у хлора или у йода? Очевидно, у хлора, так как его валентные электроны ближе к ядру.
Вывод. Активность неметаллов в подгруппах сверху вниз убывает, так как возрастает радиус атома и все труднее притянуть недостающие электроны.
Сравним свойства кремния и олова:
На внешнем уровне обоих атомов по четыре электрона. Тем не менее эти элементы в Периодической системе находятся по разные стороны от линии, соединяющей бор и астат (см. правило в уроке 2.1.). Поэтому:
- у кремния, символ которого находится выше линии В–At, сильнее проявляются неметаллические свойства;
- у олова, символ которого находится ниже линии В–At, сильнее проявляются металлические свойства;
Почему? Потому что в атоме олова четыре валентных электрона находятся так далеко от ядра, что присоединение недостающих четырех электронов затруднено, в то время как отдача электронов с пятого энергетического уровня происходит достаточно легко. Для кремния возможны оба процесса, причём первый (приём электронов) — преобладает.
Выводы:
- чем меньше электронов в атоме и чем дальше они от ядра, тем сильнее проявляются металлические свойства;
- чем больше внешних электронов в атоме, чем ближе они к ядру, тем сильнее проявляются неметаллические свойства.
Сравним строение атомов и свойства химических элементов одного периода:
Вопрос. О каком периоде и каких элементах идёт речь?
Видно, что металлические свойства убывают, так как увеличивается число внешних электронов, а неметаллические свойства — возрастают. Если речь идёт о большом периоде, где большинство элементов имеет 2 электрона на внешнем уровне (элементы побочных подгрупп), то в этом случае главной причиной убывания металлических свойств в периоде является уменьшение радиуса атома. Дело в том, что за счёт увеличения заряда ядра в периоде увеличивается сила притяжения электронов к нему и уменьшается радиус атома:
Сравните: r (Ca) = 0,197 нм и r (Zn) = 0,139 нм
Вопрос. Какой из металлов более активен?
Основываясь на этих и других выводах, сформулированных в этой главе, можно для любого химического элемента Периодической системы составить алгоритм описания свойств химического элемента по его положению в Периодической системе.
1. Составить схему строения атома, т. е. определить состав ядра, распределение электронов по энергетическим уровням и подуровням:
- определить общее число электронов в атоме (по порядковому номеру);
- определить число энергетических уровней (по номеру периода);
- определить число внешних электронов (по виду подгруппы и номеру группы);
- указать число электронов на всех энергетических уровнях, кроме предпоследнего;
- рассчитать число электронов на предпоследнем уровне.
2. Определить число валентных электронов и число внешних электронов.
3. Определить, какие свойства — металла или неметалла — сильнее проявляются у данного химического элемента (по положению в ПСХЭ).
4. Определить число отдаваемых (принимаемых) электронов.
5. Определить высшую и низшую степени окисления химического элемента.
6. Составить для этих степеней окисления химические формулы простейших соединений с кислородом и водородом.
7. Определить характер оксида (см. урок 2.1.) и составить уравнения его реакции с водой.
8. Для указанных (пункт 6) веществ составить уравнения характерных реакций (см. урок 2).
Задание 3.13. Составить по данной схеме описания атомов серы, селена, кальция и стронция и свойства этих химических элементов. Какие общие свойства имеют их оксиды? Гидроксиды?
Если вы выполнили упражнения 3.11 и 3.12, то легко заметить, что не только атомы элементов одной подгруппы, но и их соединения имеют общие свойства и похожий состав. Это отражено в Периодическом законе Менделеева: Свойства химических элементов, а также свойства простых и сложных веществ, образованных ими, находятся в периодической зависимости от ЗАРЯДА ЯДЕР ИХ АТОМОВ.
Физический смысл Периодического закона ясен: свойства химических элементов периодически повторяются потому, что периодически повторяются конфигурации валентных электронов (распределение электронов внешнего и предпоследнего уровней).
Так, у химических элементов одной и той же подгруппы одинаковое распределение валентных электронов и, значит, похожие свойства.
Выводы
Строение атома связано с положением элемента в Периодической системе. Зная строение атома, можно предсказать свойства элемента и его соединений. Эти свойства находятся в периодической зависимости от заряда ядер атомов элементов, в соответствии с Периодическим законом Менделеева.
На этой странице вы узнаете
- Какой паспорт у атомов?
- Что общего у электронов и студентов?
Всё, что окружает нас в повседневной жизни имеет сложное строение: от чайника на плите до улиц города. Не менее сложным строением обладает и крохотный атом. В этой статье поговорим о его электронных конфигурациях.
Общее об атоме
Вспомним самую важную информацию об атоме.
Долгое время ученые не могли выяснить, из чего состоит атом. Впоследствии было установлено, что атом состоит из элементарных частиц: протонов, нейтронов и электронов.
Чтобы объяснить расположение элементарных частиц была предложена планетарная модель атома. Она гласит следующее: вокруг каждого ядра находятся электроны, которые располагаются вокруг него определенным образом, как и планеты вокруг Солнца. Подробнее о строении атома можно почитать в статье «Строение атома и электронные конфигурации 1.0».
В это статье мы сфокусируемся на электронах в атоме.
Валентные и неспаренные электроны
Последний энергетический уровень называют внешним. На нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
Таким образом, можно сказать, что неспаренные и валентные электроны — близкие родственники: похожи, но не одинаковы.
Сравним, какая же связь существует между валентными и неспаренными электронами. При образовании химической связи возможны два механизма: обменный и донорно-акцепторный. Более распространен обменный механизм, благодаря которому атомы выделяют по одному электрону на внешнем электронном уровне и образуют “коннекшн” (общую электронную пару).
Из этого следует правило:
Все неспаренные электроны являются валентными, но не все валентные электроны должны быть неспаренными.

Какой паспорт у атомов?
У каждого атома или иона есть “паспорт” расположения электронов по энергетическим уровням. Такой паспорт называется электронной конфигурацией.
Электронная конфигурация — это формула, отражающая распределение электронов по электронным оболочкам атома.

Пусть электрон — это студент. А где обычно живут студенты? В общаге! Давайте нарисуем общежитие для электронов:
— В нём есть отдельные комнаты — максимум 2 электрона.
— Блоки с общей кухней, в которые эти комнаты собираются — их мы назовем энергетическими подуровнями.
— И целые этажи, в которые собираются отдельные блоки, которые являются энергетическими уровнями.

Более подробно про расположение электронов можно почитать в статье «Особенности строения электронных оболочек атомов элементов». .
Электронную конфигурацию ионов можно написать по тем же правилам, что и электронную конфигурацию атомов, только при этом нужно учитывать, какой заряд (положительный или отрицательный) у частицы.
Если атом принимает электроны, то он становится анионом, если отдаёт электроны – то катионом.

Атом может отдать или принять электроны таким образом, чтобы внешний энергетический уровень был максимально заполнен, так как это энергетически выгодно. Полностью заполненный подуровень является очень устойчивым — такую конфигурацию имеют все благородные газы, и к ней стремятся ионы.
Рассмотрим пример с образованием сульфид-аниона S2-.
- 3 энергетический уровень является внешним для атома серы, на нем располагается 6 электронов, 2 из которых являются неспаренными.
- К этим электронам могут добавиться два “соседа”, благодаря которым p-подуровень заполняется полностью и обретает стабильную конфигурацию.
- Так как каждый из электронов имеет заряд (-1), то суммарно после их присоединения к сере образуется сульфид-анион S2-

Фактчек
- Электроны заполняются определенным образом на энергетических уровнях вокруг атома.
- Электронная конфигурация помогает нам узнать, на каком уровне и подуровне располагается определенное число электронов.
- Если к нейтральному атому добавить электроны, то он превращается в анион, если же отобрать электроны — образуется катион.
- Атом стремится обладать наиболее устойчивой электронной конфигурацией, при которой энергетический уровень/подуровень является заполненным.
Проверь себя
Задание 1.
Внешним энергетическим уровнем называется :
- Первый энергетический уровень
- Последний энергетический уровень
- Энергетический уровень с наименьшей энергией
Задание 2.
Максимальное число электронов на внешнем энергетическом уровне равно:
- 5
- 6
- 7
- 8
Задание 3.
Количество валентных электронов, в большинстве случаев, равно:
- Номеру группы
- Номеру периода
- Порядковому номеру элемента
- Массовому числу элемента
Задание 4.
Сколько электронов необходимо для заполнения энергетического уровня атома углерода?
- 2
- 3
- 4
- 5
Задание 5.
Электронной конфигурации какого благородного газа будет соответствовать электронная конфигурация хлорид-иона?
- Аргона
- Неона
- Криптона
- Ксенона
Ответы: 1. — 2; 2. — 4; 3. — 1; 4. — 3; 5. — 1.
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Продолжение. Начало см. в № 13, 18, 23/2007
Глава 3. Элементарные сведения о
строении атома.
Периодический закон Д.И.Менделеева
В с п о м н и т е, что такое атом, из чего состоит
атом, изменяется ли атом в химических
реакциях.
Атом – это электронейтральная частица,
состоящая из положительно заряженного ядра и
отрицательно заряженных электронов.
Число электронов в ходе химических процессов
может изменяться, но заряд ядра всегда остается
неизменным. Зная распределение электронов в
атоме (строение атома), можно предсказать многие
свойства данного атома, а также свойства простых
и сложных веществ, в состав которых он входит.
Строение атома, т.е. состав ядра и распределение
электронов вокруг ядра, несложно определить по
положению элемента в периодической системе.
В периодической системе Д.И.Менделеева
химические элементы располагаются в
определенной последовательности. Эта
последовательность тесно связана со строением
атомов этих элементов. Каждому химическому
элементу в системе присвоен порядковый номер,
кроме того, для него можно указать номер периода,
номер группы, вид подгруппы.
Спонсор публикации статьи интернет-магазин “Мегамех”. В магазине Вы найдёте изделия из меха на любой вкус – куртки, жилетки и шубы из лисы, нутрии, кролика, норки, чернобурки, песца. Компания также предлагает Вам приобрести элитные меховые изделия и воспользоваться услугами индивидуального пошива. Меховые изделия оптом и в розницу – от бюджетной категории до класса люкс, скидки до 50%, гарантия 1 год, доставка по Украине, России, СНГ и странам Евросоюза, самовывоз из шоу-рума в г.Кривой Рог, товары от ведущих производителей Украины, России, Турции и Китая. Посмотреть каталог товаров, цены, контакты и получить консультацию Вы сможете на сайте, который располагается по адресу: “megameh.com”.
Зная точный «адрес» химического элемента –
группу, подгруппу и номер периода, можно
однозначно определить строение его атома.
Период – это горизонтальный ряд химических
элементов. В современной периодической
системе семь периодов. Первые три периода – малые,
т.к. они содержат 2 или 8 элементов:
1-й период – Н, Не – 2 элемента;
2-й период – Li … Nе – 8 элементов;
3-й период – Na … Аr – 8 элементов.
Остальные периоды – большие. Каждый из них
содержит 2–3 ряда элементов:
4-й период (2 ряда) – K … Kr – 18 элементов;
6-й период (3 ряда) – Сs … Rn – 32 элемента. В этот
период входит ряд лантаноидов.
Группа – вертикальный ряд химических
элементов. Всего групп восемь. Каждая группа
состоит из двух подгрупп: главной подгруппы и
побочной подгруппы. Например:
Главную подгруппу образуют химические
элементы малых периодов (например, N, P) и больших
периодов (например, As, Sb, Bi).
Побочную подгруппу образуют химические
элементы только больших периодов (например, V, Nb,
Ta).
Визуально эти подгруппы различить легко.
Главная подгруппа «высокая», она начинается с
1-го или 2-го периода. Побочная подгруппа –
«низкая», начинается с 4-го периода.
Итак, каждый химический элемент периодической
системы имеет свой адрес: период, группу,
подгруппу, порядковый номер.
Например, ванадий V – это химический элемент
4-го периода, V группы, побочной подгруппы,
порядковый номер 23.
Задание 3.1. Укажите период, группу и
подгруппу для химических элементов с
порядковыми номерами 8, 26, 31, 35, 54.
Задание 3.2. Укажите порядковый номер и
название химического элемента, если известно,
что он находится:
а) в 4-м периоде, VI группе, побочной подгруппе;
б) в 5-м периоде, IV группе, главной подгруппе.
Каким образом можно связать сведения о
положении элемента в периодической системе со
строением его атома?
Атом состоит из ядра (оно имеет положительный
заряд) и электронов (они имеют отрицательный
заряд). В целом атом электронейтрален.
Положительный заряд ядра атома равен
порядковому номеру химического элемента.
Ядро атома – сложная частица. В ядре
сосредоточена почти вся масса атома. Поскольку
химический элемент – совокупность атомов с
одинаковым зарядом ядра, то около символа
элемента указывают следующие его координаты:
По этим данным можно определить состав ядра.
Ядро состоит из протонов и нейтронов.
Протон p имеет массу 1 (1,0073 а. е. м.) и заряд +1.
Нейтрон n заряда не имеет (нейтрален), а масса
его приблизительно равна массе протона (1,0087 а. е.
м.).
Заряд ядра определяют протоны. Причем число
протонов равно (по величине) заряду ядра
атома, т.е. порядковому номеру.
Число нейтронов N определяют по разности
между величинами: «масса ядра» А и
«порядковый номер» Z. Так, для атома алюминия:
N = А – Z = 27 –13 = 14n,
Задание 3.3. Определите состав ядер атомов,
если химический элемент находится в:
а) 3-м периоде, VII группе, главной подгруппе;
б) 4-м периоде, IV группе, побочной подгруппе;
в) 5-м периоде, I группе, главной подгруппе.
Внимание! При определении массового числа ядра
атома приходится округлять атомную массу,
указанную в периодической системе. Так поступают
потому, что массы протона и нейтрона практически
целочисленны, а массой электронов можно
пренебречь.
Определим, какие из приведенных ниже ядер
принадлежат одному и тому же химическому
элементу:
А (20р + 20n),
Б (19р + 20n),
В (20р + 19n).
Атомам одного химического элемента
принадлежат ядра А и В, поскольку они
содержат одинаковое число протонов, т. е. заряды
этих ядер одинаковые. Исследования показывают,
что масса атома не оказывает существенного
влияния на его химические свойства.
Изотопами называют атомы одного и того же
химического элемента (одинаковое число
протонов), различающиеся массой (разное число
нейтронов).
Изотопы и их химические соединения отличаются
друг от друга по физическим свойствам, но
химические свойства у изотопов одного
химического элемента одинаковы. Так, изотопы
углерода-14 (14С) имеют такие же химические
свойства, как и углерода-12 (12С), которые
входят в ткани любого живого организма. Отличие
проявляется только в радиоактивности (изотоп 14С).
Поэтому изотопы применяют для диагностики и
лечения различных заболеваний, для научных
исследований.
Вернемся к описанию строения атома.
Как известно, ядро атома в химических
процессах не изменяется. А что изменяется?
Переменным оказывается общее число электронов в
атоме и распределение электронов. Общее число
электронов в нейтральном атоме определить
несложно – оно равно порядковому номеру, т.е.
заряду ядра атома:
Электроны имеют отрицательный заряд –1, а масса
их ничтожна: 1/1840 от массы протона.
Отрицательно заряженные электроны
отталкиваются друг от друга и находятся на
разных расстояниях от ядра. При этом электроны,
имеющие приблизительно равный запас энергии,
находятся на приблизительно равном расстоянии
от ядра и образуют энергетический уровень.
Число энергетических уровней в атоме равно
номеру периода, в котором находится химический
элемент. Энергетические уровни условно
обозначают так (например, для Al):
Задание 3.4. Определите число энергетических
уровней в атомах кислорода, магния, кальция,
свинца.
На каждом энергетическом уровне может
находиться ограниченное число электронов:
• на первом – не более двух электронов;
• на втором – не более восьми электронов;
• на третьем – не более восемнадцати
электронов.
Эти числа показывают, что, например, на втором
энергетическом уровне может находиться 2, 5 или 7
электронов, но не может быть 9 или 12 электронов.
Важно знать, что независимо от номера
энергетического уровня на внешнем уровне
(последнем) не может быть больше восьми
электронов. Внешний восьмиэлектронный
энергетический уровень является наиболее
устойчивым и называется завершенным. Такие
энергетические уровни имеются у самых
неактивных элементов – благородных газов.
Как определить число электронов на внешнем
уровне остальных атомов? Для этого существует
простое правило: число внешних электронов
равно:
• для элементов главных подгрупп – номеру
группы;• для элементов побочных подгрупп оно не может
быть больше двух.
Например (рис. 5):
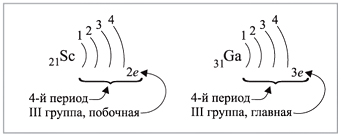 |
Рис. 5.
|
Задание 3.5. Укажите число внешних
электронов для химических элементов с
порядковыми номерами 15, 25, 30, 53.
Задание 3.6. Найдите в периодической системе
химические элементы, в атомах которых имеется
завершенный внешний уровень.
Очень важно правильно определять число внешних
электронов, т.к. именно с ними связаны важнейшие
свойства атома. Так, в химических реакциях атомы
стремятся приобрести устойчивый, завершенный
внешний уровень (8е). Поэтому атомы, на внешнем
уровне которых мало электронов, предпочитают их
отдать.
Химические элементы, атомы которых способны
только отдавать электроны, называют металлами.
Очевидно, что на внешнем уровне атома металла
должно быть мало электронов: 1, 2, 3.
Если на внешнем энергетическом уровне атома
много электронов, то такие атомы стремятся
принять электроны до завершения внешнего
энергетического уровня, т. е. до восьми
электронов. Такие элементы называют неметаллами.
В о п р о с. К металлам или неметаллам
относятся химические элементы побочных
подгрупп? Почему?
О т в е т. Металлы и неметаллы главных
подгрупп в таблице Менделеева отделяет линия,
которую можно провести от бора к астату. Выше
этой линии (и на линии) располагаются неметаллы,
ниже – металлы. Все элементы побочных подгрупп
оказываются ниже этой линии.
Задание 3.7. Определите, к металлам или
неметаллам относятся: фосфор, ванадий, кобальт,
селен, висмут. Используйте положение элемента в
периодической системе химических элементов и
число электронов на внешнем уровне.
Для того, чтобы составить распределение
электронов по остальным уровням и подуровням,
следует воспользоваться следующим а л г о р и т м
о м.
1. Определить общее число электронов в атоме (по
порядковому номеру).
2. Определить число энергетических уровней (по
номеру периода).
3. Определить число внешних электронов (по виду
подгруппы и номеру группы).
4. Указать число электронов на всех уровнях,
кроме предпоследнего.
5. Рассчитать число электронов на предпоследнем
уровне.
Например, согласно пунктам 1–4 для атома
марганца определено:
Всего 25е; распределили (2 + 8 + 2) = 12e;
значит, на третьем уровне находится: 25 – 12 = 13e.
Получили распределение электронов в атоме
марганца:
Задание 3.8. Отработайте алгоритм, составив
схемы строения атомов для элементов № 16, 26, 33, 37.
Укажите, металлы это или неметаллы. Ответ
поясните.
Составляя приведенные выше схемы строения
атома, мы не учитывали, что электроны в атоме
занимают не только уровни, но и определенные подуровни
каждого уровня. Виды подуровней обозначаются
латинскими буквами: s, p, d.
Число возможных подуровней равно номеру
уровня. Первый уровень состоит из одного
s-подуровня. Второй уровень состоит из двух
подуровней – s и р. Третий уровень – из
трех подуровней – s, p и d.
На каждом подуровне может находиться строго
ограниченное число электронов:
на s-подуровне – не больше 2е;
на р-подуровне – не больше 6е;
на d-подуровне – не больше 10е.
Подуровни одного уровня заполняются в строго
определенном порядке: s p
d.
Таким образом, р-подуровнь не может начать
заполняться, если не заполнен s-подуровень
данного энергетического уровня, и т.д. Исходя из
этого правила, несложно составить электронную
конфигурацию атома марганца:
В целом электронная конфигурация атома марганца
записывается так:
25Мn 1s22s22p63s23p63d54s2.
Здесь и далее приняты следующие обозначения:
Задание 3.9. Составьте электронные
конфигурации атомов для химических элементов №
16, 26, 33, 37.
Для чего необходимо составлять электронные
конфигурации атомов? Для того, чтобы
определять свойства этих химических элементов.
Следует помнить, что в химических процессах
участвуют только валентные электроны.
Валентные электроны находятся на внешнем
энергетическом уровне и незавершенном
d-подуровне предвнешнего уровня.
Определим число валентных электронов для
марганца:
или сокращенно: Мn … 3d54s2.
Что можно определить по формуле электронной
конфигурации атома?
1. Какой это элемент – металл или неметалл?
Марганец – металл, т.к. на внешнем (четвертом)
уровне находится два электрона.
2. Какой процесс характерен для металла?
Атомы марганца в реакциях всегда только отдают
электроны.
3. Какие электроны и сколько будет отдавать атом
марганца?
В реакциях атом марганца отдает два внешних
электрона (они дальше всех от ядра и слабее
притягиваются им), а также пять предвнешних d-электронов.
Общее число валентных электронов – семь (2 + 5).
В этом случае на третьем уровне атома
останется восемь электронов, т.е. образуется
завершенный внешний уровень.
Все эти рассуждения и заключения можно
отразить при помощи схемы (рис. 6):
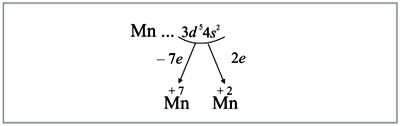 |
Рис. 6.
|
Полученные условные заряды атома
называют степенями окисления.
Рассматривая строение атома, аналогичным
способом можно показать, что типичными степенями
окисления для кислорода является –2, а для
водорода +1.
В о п р о с. С каким из химических
элементов может образовывать соединения
марганец, если учесть полученные выше степени
его окисления?
О т в е т. Только с кислородом, т.к. его атом
имеет противоположную по заряду степень
окисления. Формулы соответствующих оксидов
марганца (здесь степени окисления соответствуют
валентностям этих химических элементов):
Строение атома марганца подсказывает, что
большей степени окисления у марганца быть не
может, т.к. в этом случае пришлось бы
затрагивать устойчивый, теперь уже завершенный
предвнешний уровень. Поэтому степень окисления +7
является высшей, а соответствующий оксид Мn2О7
– высшим оксидом марганца.
Для закрепления всех этих понятий рассмотрим
строение атома теллура и некоторые его свойства:
Как неметалл, атом Te может принять 2 электрона
до завершения внешнего уровня и отдать «лишние» 6
электронов:
Задание 3.10. Изобразите электронные
конфигурации атомов Nа, Rb, Cl, I, Si, Sn. Определите
свойства этих химических элементов, формулы их
простейших соединений (с кислородом и водородом).
Практические выводы
1. В химических реакциях участвуют только
валентные электроны, которые могут находиться
только на двух последних уровнях.
2. Атомы металлов могут только отдавать
валентные электроны (все или несколько), принимая
положительные степени окисления.
3. Атомы неметаллов могут принимать электроны
(недостающие – до восьми), приобретая при этом
отрицательные степени окисления, и отдавать
валентные электроны (все или несколько), при этом
они приобретают положительные степени
окисления.
Сравним теперь свойства химических элементов
одной подгруппы, например натрия и рубидия:
Nа …3s1 и Rb …5s1.
Что общего в строении атомов этих элементов?
На внешнем уровне каждого атома по одному
электрону – это активные металлы. Металлическая
активность связана со способностью отдавать
электроны: чем легче атом отдает электроны, тем
сильнее выражены его металлические свойства.
Что удерживает электроны в атоме? Притяжение их
к ядру. Чем ближе электроны к ядру, тем сильнее
они притягиваются ядром атома, тем труднее их
«оторвать».
Исходя из этого, ответим на вопрос: какой
элемент – Nа или Rb – легче отдает внешний
электрон? Какой из элементов является более
активным металлом? Очевидно, рубидий, т.к. его
валентные электроны находятся дальше от ядра (и
слабее удерживаются ядром).
Вывод. В главных подгруппах сверху вниз
металлические свойства усиливаются, т.к.
возрастает радиус атома, и валентные электроны
слабее притягиваются к ядру.
Сравним свойства химических элементов VIIa
группы: Cl …3s23p5 и I …5s25p5.
Оба химических элемента – неметаллы, т.к. до
завершения внешнего уровня не хватает одного
электрона. Эти атомы будут активно притягивать
недостающий электрон. При этом чем сильнее
притягивает атом неметалла недостающий
электрон, тем сильнее проявляются его
неметаллические свойства (способность принимать
электроны).
За счет чего происходит притяжение электрона?
За счет положительного заряда ядра атома.
Кроме того, чем ближе электрон к ядру, тем сильнее
их взаимное притяжение, тем активнее неметалл.
В о п р о с. У какого элемента сильнее
выражены неметаллические свойства: у хлора или
йода?
О т в е т. Очевидно, у хлора, т.к. его валентные
электроны расположены ближе к ядру.
Вывод. Активность неметаллов в подгруппах
сверху вниз убывает, т.к. возрастает радиус
атома и ядру все труднее притянуть недостающие
электроны.
Сравним свойства кремния и олова: Si …3s23p2
и Sn …5s25p2.
На внешнем уровне обоих атомов по четыре
электрона. Тем не менее эти элементы в
периодической системе находятся по разные
стороны от линии, соединяющей бор и астат.
Поэтому у кремния, символ которого находится
выше линии В–At, сильнее проявляются
неметаллические свойства. Напротив, у олова,
символ которого находится ниже линии В–At,
сильнее проявляются металлические свойства. Это
объясняется тем, что в атоме олова четыре
валентных электрона удалены от ядра. Поэтому
присоединение недостающих четырех электронов
затруднено. В то же время отдача электронов
с пятого энергетического уровня происходит
достаточно легко. Для кремния возможны оба
процесса, причем первый (прием электронов)
преобладает.
Выводы по главе 3. Чем меньше внешних
электронов в атоме и чем дальше они от ядра, тем
сильнее проявляются металлические свойства.
Чем больше внешних электронов в атоме и чем
ближе они к ядру, тем сильнее проявляются
неметаллические свойства.
Основываясь на выводах, сформулированных в
этой главе, для любого химического элемента
периодической системы можно составить
«характеристику».
Алгоритм описания свойств
химического элемента по его положению
в периодической системе
1. Составить схему строения атома, т.е.
определить состав ядра и распределение
электронов по энергетическим уровням и
подуровням:
• определить общее число протонов, электронов
и нейтронов в атоме (по порядковому номеру и
относительной атомной массе);• определить число энергетических уровней (по
номеру периода);• определить число внешних электронов (по виду
подгруппы и номеру группы);• указать число электронов на всех
энергетических уровнях, кроме предпоследнего;• рассчитать число электронов на
предпоследнем уровне.
2. Определить число валентных электронов.
3. Определить, какие свойства – металла или
неметалла – сильнее проявляются у данного
химического элемента.
4. Определить число отдаваемых (принимаемых)
электронов.
5. Определить высшую и низшую степени окисления
химического элемента.
6. Составить для этих степеней окисления
химические формулы простейших соединений с
кислородом и водородом.
7. Определить характер оксида и составить
уравнение его реакции с водой.
8. Для указанных в пункте 6 веществ составить
уравнения характерных реакций (см. главу 2).
Задание 3.11. По приведенной выше схеме
составить описания атомов серы, селена, кальция и
стронция и свойства этих химических элементов.
Какие общие свойства проявляют их оксиды и
гидроксиды?
Если вы выполнили упражнения 3.10 и 3.11, то
легко заметить, что не только атомы элементов
одной подгруппы, но и их соединения имеют общие
свойства и похожий состав.
Периодический закон Д.И.Менделеева:
свойства химических элементов, а также свойства
простых и сложных веществ, образованных ими,
находятся в периодической зависимости от заряда
ядер их атомов.
Физический смысл периодического закона: свойства
химических элементов периодически повторяются
потому, что периодически повторяются
конфигурации валентных электронов
(распределение электронов внешнего и
предпоследнего уровней).
Так, у химических элементов одной и той же
подгруппы одинаковое распределение валентных
электронов и, значит, похожие свойства.
Например, у химических элементов пятой группы
пять валентных электронов. При этом в атомах
химических элементов главных подгрупп – все
валентные электроны находятся на внешнем уровне:
… ns2np3, где n – номер
периода.
У атомов элементов побочных подгрупп на
внешнем уровне находятся только 1 или 2 электрона,
остальные – на d-подуровне предвнешнего
уровня: … (n – 1)d3ns2, где n
– номер периода.
Задание 3.12. Составьте краткие электронные
формулы для атомов химических элементов № 35 и 42,
а затем составьте распределение электронов в
этих атомах по алгоритму. Убедитесь, что ваше
предсказание сбылось.
Упражнения к главе 3
1. Сформулируйте определения понятий
«период», «группа», «подгруппа». Что общего у
химических элементов, которые составляют: а)
период; б) группу; в) подгруппу?
2. Что такое изотопы? Какие свойства –
физические или химические – совпадают у
изотопов? Почему?
3. Сформулируйте периодический закон
Д.И.Менделеева. Поясните его физический смысл и
проиллюстрируйте примерами.
4. В чем проявляются металлические
свойства химических элементов? Как они
изменяются в группе и в периоде? Почему?
5. В чем проявляются неметаллические
свойства химических элементов? Как они
изменяются в группе и в периоде? Почему?
6. Составьте краткие электронные формулы
химических элементов № 43, 51, 38. Подтвердите свои
предположения описанием строения атомов этих
элементов по приведенному выше алгоритму.
Укажите свойства этих элементов.
7. По кратким электронным формулам
а) …4s24p1;
б) …4d15s2;
в) …3d54s1
определите положение соответствующих
химических элементов в периодической системе
Д.И.Менделеева. Назовите эти химические элементы.
Свои предположения подтвердите описанием
строения атомов этих химических элементов по
алгоритму. Укажите свойства этих химических
элементов.
Продолжение следует