Здравствуйте дорогие читатели моего канала. Сегодня я хочу разобрать 19 тему или 19 вопрос из ОГЭ по химии. И 19 тема по которой будет вопрос в ЛГЭ по химии называется “Вычисления массы элемента по его массовой доле в веществе”.
Я эту тему разберу на разборе нескольких задач.
Задача: Сколько граммов сульфата железа(II) нужно внести в реакционную смесь, если для проведения реакции необходимо 18 г железа(II)?
Решение: Молярная масса сульфата железа(II) равна M(FeSO4) = 56+32+16 * 4 = 152 г/моль. Доля железа(II) в нём равна w(Fe) = 56 : 152 = 0,37. Тогда необходимая масса сульфата железа(II) составит m(FeSO4) = 18 : 0,37 = 49 г.
Для того чтобы решить такие задачи надо сперва найти молярную массу вещества, а после найти массовую долю того химического элемента в веществе чья масса данна в задаче. Когда мы нашли массовую долю заданного химического элемента, мы ту массу химического элемента которая дана в задаче мы делим на его массовую долю. И это будет та масса вещества которую над найти в задаче. Дополнительное действие появляется если дана определенная площадь изделия которую надо покрыть заданным веществом из задачи. Тогда мы найденную массу вещества еще умножаем на заданную площадь.
Разберу еще одну задачу где кроме массы появляется еще и площадь. Например: Для золочения одного квадратного сантиметра изделия нужно 0,3 г золота. Сколько граммов хлорида золота(III) нужно взять, чтобы покрыть золотом изделие, площадью 150 см2? Ответ запишите с точностью до десятых.
Решение: Молярная масса хлорида золота(III) равна M (AuCl3) = 197 + 35,5 * 3 = 303,5 г/моль. Доля золота в нем равна w(Au) = 197 : 303,5 = 0,65. Тогда необходимая масса хлорида золота(III) составит m(AuCl3) = 0,3 : 0.65 * 150 = 69,2 г.
Таким образом можно сделать вывод о том что данная тема отличается от темы по нахождению массовой доли химического элемента тем что кроме нахождения массовой доли химического элемента нужно найти массу вещества которую нужно использовать для реакции. Таким образом необходимую массу химического элемента которую нужно использовать мы делим на массовую долю химического элемента и находим массу вещества которую надо взять.
В следующей своей статье я вам расскажу про тему нахождения массовой доли растворенного вещества в ОГЭ по химии. Если есть вопросы или желание более подробно подготовиться к ОГЭ по химии то пишите в комментариях.
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% – 21% – 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л | |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} |
large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} | |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | ||||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} |
= | |||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | ||||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | ||||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.
Раствор – однородная система, состоящая из растворителя и растворенного в нем вещества (или нескольких). Количественная характеристика определяется концентрацией веществ, входящих в их состав.
Массовая доля
Массовая доля – это отношение массы растворённого вещества к массе всего раствора.
ω(%)=mxmX×100%omega left(% right)= frac{m_{x}}{m_{X}} times 100%
Сколько калия хлорида (в граммах) содержится в 100г 10% раствора?
Решение:
Масса калия хлорида (молярная масса MM для KClKCl 75г/моль):
mKCl=ω×M100%=10%×75100%=7,5m_{KCl}=frac{omega times M}{100%}=frac{10% times 75}{100%}=7,5г
Ответ: 7,5г.
Сколько необходимо добавить натрия гидроксида к 120г 3% раствора этой же соли, что бы концентрация увеличилась в три раза?
Решение:
Масса натрия гироксида исходная (MNaOH=40M_{NaOH}=40 г/моль:
m1NaOH=ω×M100%=3%×40100%=1,2m_{1NaOH}=frac{omega times M}{100%}=frac{3%times 40}{100%}=1,2г
Массовая доля натрия гидроксида в необходимом растворе:
ω2%=ω%×3=3%×3=9%omega _{2}%=omega%times3=3%times3=9%
Масса NaOH в необходимом растворе:
m2NaOH=9%×40100%=3,6m_{2NaOH}=frac{9%times 40}{100%}=3,6г
Необходимое количество рассчитываем как разность:
mNaOH=m2NaOH−m1NaOH=3,6−1,2=2,4m_{NaOH}=m_{2NaOH}-m_{1NaOH}=3,6-1,2=2,4г
Ответ: 2,4г.
Молярная концентрация
Молярная концентрация – количество вещества (в молях) в объеме раствора.
Количество растворенного вещества (в молях) выражается как масса вещества (в граммах), деленная на молярную массу (г/моль).
η=mxMeta =frac{m_{x}}{M}
Молярная концентрация выражается в формуле:
Cx=ηV=η=mxM×VC_{x} = frac{eta }{V} = eta =frac{m_{x}}{M}times V
Определите молярную концентрацию калия иодида. В 120мл воды содержится 15г KI.
Решение:
Выражаем молярную концентрацию (моль/л) KI по формуле ($M_(KI)=$166г/моль):
CKI=mKIMKI×VC_{KI} =frac{m_{KI}}{M_{KI}}times V=15166×0,12=0,01=frac{15}{166}times 0,12=0,01моль/л
Т.к. молярная концентрация выражается в моль/л миллилитры переводим в литры.
Ответ: 3,61 моль/л.
Какая масса лития хлорида содержится в 200мл 3М раствора?
Решение:
Находим количество растворенного лития хлорида (моль):
η=CLiCl×V=3×0,2=0,6eta =C_{LiCl}times V=3times 0,2=0,6г
Выражаем массу M(LiCl)=M_ (LiCl)= 42,3г/моль):
mLiCl=ηLiCl×MLiCl=0,6×42.3=25,4m_{LiCl}=eta_{LiCl} times M_{LiCl}=0,6times 42.3=25,4г
Ответ: 25,4г.
Молярная (мольная) доля
Молярная (мольная) доля – отношения количества вещества в растворе к количеству всех веществ, образующих раствор.
Nx%=nx∑n×100%N_{x}%=frac{n_{x}}{sum{n}}times 100%
Концентрация бария хлорида в 100мл водного раствора равна 20%. Определите его мольную долю.
MBaCl2=208M_{BaCl_{2}}=208моль/л, MH2O=18M_{H_{2}O}=18моль/л.
Решение:
Находим содержание воды:
ωH2O=100%−ωBaCl2=100%−20%=80%omega _{H_{2}O}=100%-omega BaCl_{2}=100%-20%=80%
Т.к. объем раствора равен 100мл, то массы каждого компонента равны значениям массовой доли. Следовательно:
mBaCl2=20m_{BaCl_{2}}=20г
mH2O=80m_{H_{2}O}=80г
Определим количество ηeta для бария хлорида и воды:
ηBaCl2=mBaCl2MBaCl2=20208=0,01eta_{BaCl_{2}}=frac{m_{BaCl_{2}}}{M_{BaCl_{2}}}=frac{20}{208}=0,01моль
ηH2O=mH2OMH2O=2018=1,1eta_{H_{2}O}=frac{m_{H_{2}O}}{M_{H_{2}O}}=frac{20}{18}=1,1моль
Определяем мольную долю NBaCl2N_{BaCl_{2}}:
NBaCl2=ηBaCl2ηBaCl2+ηH2O×100%=0,010,01+0,1×100%=9%N_{BaCl_{2}}=frac{eta BaCl_{2}}{eta BaCl_{2}+eta H_{2}O}times 100%=frac{0,01}{0,01+0,1}times 100%=9%
Ответ: 9%
Молярная концентрация эквивалента
Молярная концентрация эквивалента (нормальность) – число моль эквивалентов в объеме раствора.
C1/z=mxM1/z×VC_{1/z} = frac{m_{x}}{M_{1/z}times V}моль*экв/литр
Фактор эквивалентности f1/zf_{1/z} – показывает часть реальной частицы, составляющую эквивалент.
Молярная масса эквивалента M1/zM_{1/z} – произведение молярной массы и фактора эквивалентности:
M1/z=M×f1/zM_{1/z} = M times f_{1/z}г/моль
Определите молярную концентрацию эквивалента 4.6г серной кислоты, нейтрализованной раствором гидроксида натрия. В результате реакции общий объём составил 100мл.
Решение:
MH2SO4=98M_{H_{2}SO_{4}}=98г/моль, f1/z=1/2f_{1/z=1/2}.
Находим молярную массу эквивалента для серной кислоты:
M1/zH2SO4=MH2SO4×f1/zM_{1/z H_{2}SO_{4}} = M _{H_{2}SO_{4}}times f_{1/z} = 98times 1/2=49$г/моль
Находим нормальность:
C1/zH2SO4=mH2SO4M1/zH2SO4×V=4,649×0,1=0,94C_{1/z H_{2}SO_{4}} = frac{m_{H_{2}SO_{4}}}{M_{1/z H_{2}SO_{4}}times V}=frac{4,6}{49times
0,1}=0,94моль*экв/л
Ответ: 0,94моль*экв/л.
Моляльность
Моляльность – количество вещества в килограмме растворителя.
Сm=ηxmС_{m}=frac{eta _{x}}{m}моль/кг
В 300г воды растворили 20г калия гидроксида. Определите моляльную концентрацию раствора.
Решение:
MKOH=98M_{KOH}=98г/моль.
Находим количество калия гидроксида:
ηKOH=mKOHM=2056=0,36eta _{KOH} = frac{m_{KOH}}{M}=frac{20}{56}=0,36моль
Находим моляльность (граммы переводим в килограммы):
CKOH=ηKOHm=0,360,3=1,2C_{KOH}=frac{eta _{KOH}}{m}=frac{0,36}{0,3}=1,2моль/кг
Ответ: 1,2 моль/кг.
Смесь, состоящая из
двух и более компонентов, характеризуется
свойствами и содержанием этих компонентов.
Состав смеси может быть задан массой,
объемом, количеством (числом молей или
килограмм-молей) отдельных компонентов,
а также значениями их концентраций.
Концентрацию компонента в смеси можно
выразить в весовых, мольных и объемных
долях или процентах, а также в других
единицах.
Массовая
доля i
какого-либо компонента определяется
отношением массы mi
данного компонента к массе всей смеси
mсм:
![]()
![]()
![]()
Учитывая,
что суммарная масса смеси равна сумме
масс отдельных компонентов, т.е.
![]()
можно написать:
![]()
или сокращенно:
![]()
Пример
4. Смесь
состоит из двух компонентов: m1
= 500 кг, m2
= 1500 кг. Определить массовую долю каждого
компонента в смеси.
Решение.
Массовая
доля первого компонента:
![]()
mсм=
m1
+ m2
= 500 + 1500 = 2000 кг
Массовая доля второго компонента:
![]()
Массовую
долю второго компонента можно определить
также, используя равенство:
1
+ 2
= 1
2
= 1 – 1
= 1 – 0,25 = 0,75
Объемная
доля i
компонента в смеси равна отношению
объема Vi
данного компонента к объему всей смеси
V:
![]()
![]()
![]()
Учитывая, что:
![]()
можно написать:
![]()
Пример
5.
Газ состоит из двух компонентов: V1
= 15,2 м3
метана и V2
= 9,8 м3
этана. Подсчитать объемный состав смеси.
Решение.
Общий объем смеси равен:
V
= V1
+ V2
= 15,2 + 9,8 = 25 м3
Объемная доля в смеси:
метана
![]()
этана
v2
= 1 – v1
= 1 – 0,60 = 0,40
Мольная
доля ni
какого-либо компонента смеси определяется
как отношение числа киломолей Ni
данного компонента к общему числу
киломолей N
смеси:
![]()
![]()
![]()
Учитывая,
что:![]()
получим:![]()
Пересчет мольных
долей в массовые можно проводить по
формуле:
![]()
Пример
6. Смесь
состоит из 500 кг бензола и 250 кг толуола.
Определить мольный состав смеси.
Решение.
Молекулярный
вес бензола (С6Н6)
равен 78, толуола (С7Н8)
– 92. Число килограмм-молей равно:
бензола
![]()
толуола
![]()
общее число
килограмм-молей:
N
= N1
+ N2
= 6,41 + 2,72 = 9,13
Мольная доля
бензола равна:
![]()
Для толуола мольная
доля может быть найдена из равенства:
n1
+ n2
= 1
откуда: n2= 1 –n1= 1 – 0,70 = 0,30
Среднюю молекулярную
массу смеси можно определить, зная
мольную долю и молекулярную массу
каждого компонента смеси:
![]() (21)
(21)
где
ni
— содержание
компонентов в смеси, мол. доли; Mi
— молекулярная
масса компонента смеси.
Молекулярную массу смеси нескольких
нефтяных фракций можно определить по
формуле
 (22)
(22)
или
![]() (23)
(23)
где
m1,
m2,…,
mn
— масса
компонентов смеси, кг; M1,
М2,….,.Мп
– молекулярная масса компонентов смеси;
![]() – % масс. компонента.
– % масс. компонента.
Молекулярную
массу нефтепродукта можно определить
также по формуле Крэга
 (24)
(24)
Пример
7.
Определить среднюю молекулярную массу
смеси бензола с изооктаном, если мольная
доля бензола составляет 0,51, изооктана
0,49.
Решение.
Молекулярная масса бензола 78, изооктана
114. Подставляя эти значения в формулу
(21), получаем
Мср
= 0,51
78 + 0,48114
= 95,7
Пример
8. Смесь
состоит из 1500кг бензола и 2500кг н-октана.
Определить среднюю молекулярную массу
смеси.
Решение.
Используем формулу (22)

Объемный
молярный состав пересчитывают в массовый
следующим образом. Данный объемный
(молярный) состав в процентах принимают
за 100 молей. Тогда концентрация каждого
компонента в процентах будет выражать
число его молей. Затем число молей
каждого компонента умножают на его
молекулярную массу и получают массу
каждого компонента в смеси. Разделив
массу каждого компонента на общую массу,
получают его массовую концентрацию.
Массовый
состав пересчитывают в объемный
(молярный) следующим образом. Принимают,
что смеси взято 100 (г, кг, т) (если массовый
состав выражен в процентах), массу
каждого компонента делят на его
молекулярную массу. Получают число
молей. Делением числа молей каждого
компонента на их общее число получают
объемные (молярные) концентрации каждого
компонента.
Средняя плотность
газа определяется по формуле:
![]() кг/м3;
кг/м3;
г/см3
или, исходя из
объемного состава:
![]() ,
,
или, исходя из
массового состава смеси:
 .
.
Относительную плотность определяют по
формуле:
![]()
Пример 9.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
массовый % масс. |
mi |
Число
|
Объемный |
|
|
доли единицы |
% об. |
|||||
|
Метан |
16 |
40 |
40 |
40:16=2,50 |
0,669 |
66,9 |
|
Этан |
30 |
10 |
10 |
10:30=0,33 |
0,088 |
8,8 |
|
Пропан |
44 |
15 |
15 |
15:44=0,34 |
0,091 |
9,1 |
|
Бутан |
58 |
25 |
25 |
25:58=0,43 |
0,115 |
11,5 |
|
Пентан + высшие |
72 |
10 |
10 |
10:72=0,14 |
0,037 |
3,7 |
|
100 |
100 |
3,74 |
1,000 |
100,0 |
Для
простоты расчета примем массу смеси за
100 г, тогда масса каждого компонента
будет численно совпадать с процентным
составом. Найдем число молей ni
каждого компонента. Для этого массу
каждого компонента mi
разделим на мольную массу:
![]()
Находим объемный
состав смеси в долях единицы
i(CH4)
= 2,50 : 3,74 = 0,669;
![]() (C2H6)
(C2H6)
= 0,33 : 3,74 = 0,088;
![]()
![]() (C5H8)
(C5H8)
= 0,34 : 3,74 = 0,091;
![]() (C4H10)
(C4H10)
= 0,43 : 3,74 = 0,115;
![]()
![]() (C5H12)
(C5H12)
= 0,14 : 3,74 = 0,037.
Находим
объемный состав смеси в процентах,
умножив данные в долях единицы на 100%.
Все полученные данные заносим в таблицу.
Рассчитываем
среднюю массу смеси.
![]()
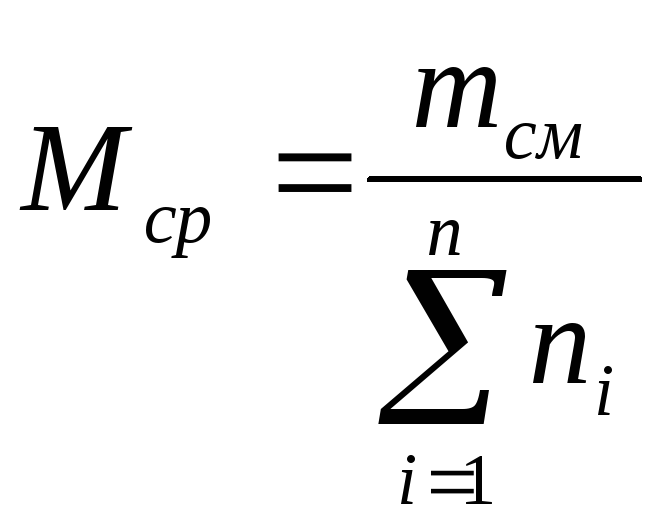
Мср
= 100 : 3,74 =
26,8 г/моль
Находим
плотность смеси
![]()
Находим относительную
плотность:
![]()
Пример 10.Пересчитать объемный
состав в массовый и определить его
молекулярную массу, его плотность и
относительную плотность.
|
Компоненты |
М г/моль |
Объемный % об. |
число |
Масса г. |
Весовой |
|
|
доли единицы |
% масс. |
|||||
|
Метан |
16 |
30 |
30 |
3016=480 |
0,117 |
11,7 |
|
Этан |
30 |
15 |
15 |
15·30=450 |
0,109 |
10,9 |
|
Пропан |
44 |
20 |
20 |
20·44=880 |
0,214 |
21,4 |
|
Бутан |
58 |
15 |
15 |
15·58=870 |
0,211 |
21,1 |
|
Пентан + высшие |
72 |
20 |
20 |
20·72=1440 |
0,349 |
34,9 |
|
100 |
100 |
4120 |
1,000 |
100,0 |
![]() (CH4)
(CH4)
= 480 : 4120 = 0,117;
![]() (C2H6)
(C2H6)
= 450 : 4120 = 0,109;
![]()
![]() (C3H8)
(C3H8)
= 880 : 4120 = 0,214;
![]() (C4H10)
(C4H10)
= 870 : 4120 = 0,211;
![]()
![]() (C5H12)
(C5H12)
= 1440 : 4120 = 0,349.
Мср
= 4120 : 100 =
41,2 г/моль.
![]() г/л
г/л
![]()
![]()
Задача 15. Смесь состоит из пяти
компонентов. Определить массовую,
объемную и мольную долю каждого компонента
в смеси, среднюю молекулярную массу
смеси.
|
Компоненты смеси |
Вариант |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
mi |
mi |
mi |
||||||||
|
метан |
5 |
30 |
55 |
80 |
100 |
75 |
50 |
25 |
5 |
30 |
|
этан |
10 |
35 |
60 |
85 |
95 |
70 |
45 |
20 |
10 |
35 |
|
пропан |
15 |
40 |
65 |
90 |
90 |
65 |
40 |
15 |
15 |
40 |
|
н-бутан |
20 |
45 |
70 |
95 |
85 |
60 |
35 |
10 |
20 |
45 |
|
изобутан |
25 |
50 |
75 |
100 |
80 |
55 |
30 |
5 |
25 |
50 |
Задача 16.Пересчитать массовый
состав газа в объемный и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
ω% массовый |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
|
этан |
50 |
45 |
40 |
35 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пропан |
5 |
10 |
20 |
10 |
5 |
10 |
15 |
20 |
25 |
30 |
|
бутан |
10 |
10 |
20 |
15 |
30 |
25 |
20 |
15 |
10 |
5 |
|
пентан |
30 |
25 |
5 |
20 |
10 |
20 |
10 |
10 |
10 |
10 |
Задача 17. Пересчитать объемный
состав газа в массовый и определить его
молекулярную массу, плотность и
относительную плотность по воздуху.
|
Компоненты смеси |
объемный состав |
|||||||||
|
Варианты |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
метан |
10 |
5 |
20 |
5 |
20 |
10 |
10 |
35 |
40 |
10 |
|
этан |
45 |
50 |
15 |
20 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пропан |
10 |
5 |
10 |
20 |
10 |
5 |
25 |
15 |
20 |
30 |
|
бутан |
10 |
10 |
35 |
40 |
25 |
30 |
10 |
20 |
15 |
5 |
|
пентан |
15 |
30 |
20 |
15 |
30 |
25 |
45 |
10 |
10 |
50 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
В этой статье мы собираемся проанализировать, как найти молярную массу из молярности.
Есть много способов найти молярную массу из молярности, но мы будем работать с одним уравнением, из которого, перестроив его, мы можем получить требуемый продукт. Для этого мы должны знать другие величины, кроме интересующей нас.
Чтобы понять, как найти молярную массу из молярности, мы должны сначала понять взаимосвязь между двумя терминами.
Нас интересует следующая формула:
M = w/( mv ) … уравнение 1
В которой,
M = молярность (в молях/л)
w = вес растворенного вещества (в граммах)
m = молярная масса растворенного вещества (г/моль)
V = объем конечного раствора после полного растворения (в литрах).
Мы можем найти молярная масса от молярности путем перестановки уравнения 1
m = w/ Mv … уравнение 2
Таким образом, мы можем найти три величины: вес растворенного вещества (w), молярность (M) и объем раствора (V).
Нахождение молярности:
Есть много способов, которыми мы можем найти или рассчитать молярность, но самый простой, который мы используем в настоящее время, это:
Молярность = моли растворенного вещества / литры раствора или объем раствора.
Используя приведенное выше соотношение, мы можем рассчитать молярность.
Нахождение объема:
Предоставленный объем убедитесь, что перед заменой он должен быть в литрах.
Зная три величины, мы можем подставить их в уравнение 2 и получить молярную массу. Таким образом, используя приведенное выше соотношение, мы можем узнать молярную массу из молярности.

Изображение кредита: Википедия
Как найти молярность по молярной массе и плотности?
Чтобы найти молярность по молярной массе и плотности, мы должны иметь отношение между тремя терминами.
Я имею в виду, что если мы знаем два термина, мы можем найти третий. Мы можем понимать молярность простыми словами как количество любого вещества, присутствующего в данном объеме раствора (тот, который рассматривается). Другим термином, используемым для описания молярности, является молярная концентрация (данного решения).
Обозначение, используемое для обозначения молярности, – M, а его стандартная единица – моль м.-3. Плотность, которую также называют удельной массой, представляет собой массу на единицу объема, и для ее обозначения используется обозначение ро (греческая буква). Его стандартная единица – кг/м.3. Величина, такая как давление, прямо пропорциональна плотности, что означает, что по мере увеличения давления (сохраняя постоянную температуру) плотность будет увеличиваться.
Температура обратно пропорциональна плотности, что означает, что при повышении температуры (при сохранении постоянного давления) плотность будет уменьшаться. Молярная масса соединения (химического) представляет собой массу соединения (рассматриваемого), деленную на вещество (количество) в образце рассматриваемого соединения.
Иногда его также называют молекулярной массой. Стандартной единицей, используемой для описания молярной массы, является кг/моль. Итак, теперь мы знаем совершенное значение этих трех терминов. Таким образом, отношение можно представить как
Молярность = плотность/молярная масса × 1000
Итак, если мы знаем плотность и молярную массу вещества, мы можем легко вычислить его молярность.
Как найти моли по молярной массе?
Мы знаем, что 1 моль равен 6.022 × 1023. Мы можем найти моли по молярной массе используя приведенную ниже формулу:
п = м / м
n = количество молей
m = заданная масса
M = молярная масса
Для лучшего понимания рассмотрим несколько примеров:
- Найдите количество молей в 70 г СН4.
Решения
Во-первых, мы должны рассчитать молярную массу (просто добавляя вес атомов в формуле CH4), и мы получаем массу = 70 г (м)
Молярная масса = CH4 = 12 + 4 = 16 г/моль.
n = m/M = 70/16 = 4.36 моль
2. Определить количество молей в 10 г NaOH..
Молярная масса (М) = NaOH = 23 + 16 + 1 = 40g / моль
м = 10g
n = m/M = 10/40 = 0.25 моль
3.Определить количество молей в 35 г глюкозы
Молярная масса (М) = C6H6O12 = 6×12 + 12×1 + 6×16 = 180g / моль
м = 35g
n = m/M = 35/180 = 0.194 моль
4.Определить количество молей в 96 г NaCl.
Молярная масса = NaCl = 23 + 35 = 58g / моль
м = 96g
n = m/M = 96/58 = 1.65 моль
Узнайте больше о: Как найти молярную массу по объему: подробные пояснения
Как найти молярную долю по молярности?
Теперь посмотрим, какова связь между мольная доля и молярность.
Рассматривать,
XA = мольная доля растворителя
XB = мольная доля растворенного вещества
MA = молекулярная масса растворителя
MB = молекулярная масса растворенного вещества
nA = количество молей растворителя
nB = количество молей растворенного вещества
WA = масса растворителя
WB = масса массы растворенного вещества
Итак, молярная доля растворителя:
XB = nA / nA + nB … уравнение 1
И молярная доля растворителя:
XA = nA / nA + nB … уравнение 2
Разделив уравнение 1 на уравнение 2, получим
XB × 1000 / XA × MA = WB × 1000 / WA × MB = m = Молярность
Следовательно, молярность = XB × 1000 / (1-XB) × MA
Переставляя приведенное выше уравнение в порядке наших требований, мы можем рассчитать мольную долю.
Узнайте больше о: Водородная связь прочнее ковалентной: почему, как и подробные факты
Как найти массу мольной доли?
Мы можем понять взаимное преобразование двух величин из следующего примера:
масса → моль
36 С
16 часов
20 О
28 Н
Примем за основу 100г
Изменить массу на моли
36 г C / 12 г / моль = 3 моля
16 г H / 1 г / моль = 16 молей
20 г О / 16 г / моль = 1.25 моль
28 г N / 14 г / моль = 2 моля
Сложите все моли вместе = 22.25 моля.
Найдите крота дробь: моли / общее количество молей
Тогда молярная доля будет
С : 3 / 22.25 = 0.135
Н : 16 / 22.25 = 0.719
О: 1.25/22.25 = 0.056
N : 2 / 22.25 = 0.090
Суммарная молярная доля получается равной 1.0.
моль → массовая доля
36 C
16 H
20 О
28 N
Примите за основу 100 молей
Изменить родинки на массу
C : 36 моль × 12 г / моль = 432 г
H : 16 моль × 1 г / моль = 16 г
O : 20 моль × 16 г моль = 320 г
N : 28 моль × 14 г / моль = 392 г
При сложении всех масс получаем 1160г.
Найти массовую долю: масса / общая масса
С : 432 / 1160 = 0.372
Н : 16 / 1160 = 0.014
О: 320/1160 = 0.276
N : 392 / 1160 = 0.338
Таким образом, мы можем найти массу мольной доли.
Узнайте больше о: 12+ примеров гидратов: подробные пояснения
Пример расчета молярной массы?
Расчет молярной массы очень прост, просто нужно добавить веса атомов, давайте разберемся на примере ниже:
1. Рассчитайте молярную массу карбоната натрия.
решение:
Мы знаем, что химическая формула карбонат натрия это Na2CO3
Na (натрий) : 23 × 2 = 46
С: 12×1 = 12
О: 16×3 = 48
После добавления всех масс:
46 + 12 + 48 = 106g / моль
Таким образом, молярная масса бикарбоната натрия составляет 106 г/моль.
