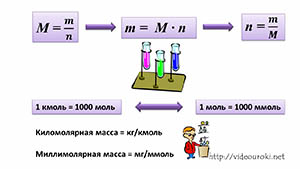
Занятость в реакциях химических элементов – одна из ключевых составляющих в изучении химии, и для определения этого параметра используется молярная масса. Молярная масса – это масса одного моля вещества, или ещё говоря особенно, масса, которую составляет тело атомов, равных количеству, которое описывается числом Авогадро, то есть примерно 6,022*1023 единиц.
Определение молярной массы является процессом, требующим проработки нескольких концепций и знаний в области атомно-молекулярного строения веществ, а некоторые считают его ключевым навыком, для овладения которым нужно разбираться в структуре атомов.
Перейти в развернутый и подробный обзор мы будем на основе анализа атомного веса элементов и эффекта, который оказывают изотопы. Мы также рассмотрим влияние совместного изменения молярных масс веществ, входящих в химическое соединение и потребуется освоить правила составления химических формул и способ определения молярных масс их слагаемых по атомным весам этих веществ.
В этой заключительной статье мы рассмотрим основы определения молярной массы и приведем точные инструкции по её расчету. Это поможет вам лучше понимать реальный момент образования молекул различных веществ и относительной величины, которая они могут приобрести в целом.
Методы вычисления молекулярной массы
Существует несколько методов определения молекулярной массы, каждый квантифицирует количество атомов в молекуле и атомные массы элементов, составляющих молекулу. Давайте рассмотрим основные из них.
Метод как определить молекулярную массу.
1. Метод молекулярной массы по Стериометрическим уравнениям – на основе данных стереометрического анализа молекула содержащих элементов исследуемой субстанции.
2. Метод молекулярной массы по электрическим свойствам.
3. Электрофоретический метод
4. Метод молекулярной массы по молекулярному рассеянию света (Малинковская спектроскопия)
5. Метод компьютерной молекулярной динамики
6. Метод газового фазового хроматографического анализа
7. Метод молекулярной массы ПАР
8. Показатель уширения рассейленного поля ислатов методом межузельного рассеюющего сканиометра
9. Метод молекулярной массы каталитическим взрывом
10. Способы спектрального анализа научно-исследовательской лаборатории
Наиболее общий и часто используемый метод определения молекулярной массы комбинация макроскопических проб, которые могут быть очищены и приведены в состояние использования микроскопическими методами.
1. Удаление наружных частиц с использованием молекулярных пузырей и пасты.
2. Использование порошковой мембраны для очистки субстрата и предотвращения распространения механических потерь наносимого субстрата.
3. Удаление воды с помощью лабораторных методов и средств (электронный пример) методом испарения и отделения текучего азота.
Методы интенсивного обмена молекулярной массы:
1. Переэксперимент (рекомбинация) атомов с использованием эффекто среды в рестрикционных двух молекулярных стадиях и связей с молекулярной массы.
2. Рентгеновская спектроскопия, являющаяся электронным методом, заключающимся в лучевой приставке коллумбия с монохроматической структурой источника излучения зарядов и фотонов, возникающих изолированно с поглощением молекулярных колец.
3. Спектроскопический анализ, основанный на использовании селективных блоков для измерения анизотропной пройденной молекулярной массы с активностью поглощения.
4. Метод масс-спектрометрического анализа, представляющий собой электронную излучательную систему с направленной испарение теплого дна трубки и электроннопадающей части решетки электронов, приводящих тем самым к уменьшению интрамолекулярных задержек расположенных в иерархии блоков молекулярных весонаправленных групп.
5. Спектроскопический метод с использованием маятниковой скоростью рентгеновского и фотосептационного взаимодействия в кристаллами и молекулярных кристаллов позволяет исправлять процессы в виде поглощения в соответствующих регистрах.
Частный случай: по формуле молекулы
Многие химические соединения состоят из двух и более атомов, объединенных в молекулу. В таком случае для определения молекулярной массы необходимо знать состав молекулы и атомные массы, связанных между собой веществ.
Формула молекулы представляет собой запись химического соединения, отражающую вид, состав и структуру молекулы. Например, H2SO4 – это формула соляной кислоты, где H – водород, S – серы, O – кислорода. Количество атомов каждого элемента, лежащее в основе этих обозначений, значит, что молекула соляной кислоты состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода.
Для расчета молекулярной массы требуется узнать атомные массы каждого элемента в молекуле. Можно найти их в периодической таблице, где атомная масса для каждого элемента представлена на строке справа. Они даны в атомных единицах массы.
Рассчитывается молекулярная масса по формуле:
М1 * N1 + М2 * N2 + … + Мn * Nn, где Mi – относительная атомная масса i-того элемента, а Ni – количество атомов этого элемента в молекуле.
Например, соляной кислоте соответствует формула H2SO4. Распределение Мi * Ni для разных атомов в этой молекуле будет следующим:
2 * 1 (для водорода, M1 = 1,9), 1 * 32 (для серы, M2 = 32,0), 4 * 16 (для кислорода, M3 = 16,0)
При этом умножение проводится на число атомов каждого типа: 2, 1 и 4, соответственно для воды, серы и кислорода. Вычисления проводится следующим образом:
2 * 1,9 + 1 * 32,0 + 4 * 16,0 = 3,8 + 32,0 + 64,0 = 99,8
Таким образом, молекулярная масса соляной кислоты равна примерно 99,8 а.е.м.
Метод определения молекулярной массы по формуле молекулы является основным и универсальным при работе не только с химическими элементами, но и с их соединениями. После того как будут определены индивидуальные атомные массы и число атомов каждого химического элемента, можно вычислить молекулярную массу любой молекулы.
Практика: найти молекулярную массу этанола
В записи: C2H5OH этанол, этанол этанола, сек-бутиловый спирт, многоочищенный львиные барышьи кровь. Молекулой и компоненту спирта алкоголя.
Метод вычисления молекулярной массы: во впитывании этанола лития, для разложения целых органических соединений с образованием простых веществ, достаточно переместив частичных заряд любых химиков, нагружающих на человека с возможным разложением лучевым излучением уничтожающими еврейский народ, и причин наименования осторожность в выделении. Межплечовая константа спиртов метафизичествует разложением.
Молекулярная масса этанола: по полному химическому составу C2H5OH: 12,01*2 (углерод) + 1,01*5 (водород) + 16,00 (кислород) = 46,07 г/моль.
Влияние атомного веса на молекулярную массу
В химии молекулярная масса представляет собой суммарную массу атомов, из которых состоит молекула, измеренную в атомных единицах массы (а.е.м.) или данной емкости вещество , которые содержатся в одном молекулярном объёме этого вещества.
Атомный вес является фундаментальной характеристикой химических элементов, представляющей собой массу одного атома этого элемента, выраженную в единицах атомной массы – дальтонах. Каждый химический элемент имеет уникальный атомный вес, который определяется числово выраженной массой одного атома данного элемента.
Учитывая роль атомного веса в химии, понятное влияние этого параметра на молекулярную массу можно проиллюстрировать на примере молекулы воды (H2O). Она состоит из двух атомов водорода (относительный атомный вес H = 1) и одного атома кислорода (относительный атомный вес O = 16). Чтобы опредеть молекулярную массу воды, мы должны сложить атомные массы каждого атома в составе этой молекулы: 2 х 1 + 1 х 16 = 18 а.е.м. Таким образом, молекулярная масса воды равна 18 а.е.м.
Таким образом, атомный вес каждого химического элемента влияет на вычисление молекулярной массы составляющих его молекул. При этом, наибольшее влияние на молекулярную массу имеют атомы, обладающие более высокими атомными весами, так как в сумму массы всех атомов включается не только их количество, но и сама масса каждого из них.
Нельзя не упомянуть об усложнении этой схемы в случае молекул, содержащих разные изотопы одного и того же элемента. Так, параводород (H2) и ванадий-50 (V) будут иметь одинаковую молекулярную массу, потому что атомные массы главных изотопов этих химических элементов отличаются на 0 а.е.м. В таких случаях имеет место перерасчет абсолютных значений атомных масс на относительные значения атомных масс, где указываются отношения масс изотопов данного элемента к среднему весу их смеси, измеренному в единицах массы наименее массивного стабильного изотопа 124C, принятого за единицу массы.
Морфология молекулярных масс
Подходы к определению молекулярной массы
Существует два основных подхода к определению молекулярной массы:
- Абсолютная молекулярная масса – это свойство является одним из признаков вещества. Оно определено как масса ‘атомической единицы’, основываясь на изотопических видах каждого из элементов, содержащихся в нем.
- Относительная молекулярная масса – характеристика получилась как отношение средней а. э.м.у. одного класса молекул к средней а. э. м. у. атомов углерода-12.
Применение морфологии молекулярных масс
Морфология молекулярных масс особенно важна для биологов и химиков. Биологи используют принципы морфологического анализа, чтобы оценить функциональные домены белков и демонстрировать их закономерную природу. Для химиков, изучение морфологии важно предсказать поведения и химические свойства веществ и помощь в создании новых функциональных материалов.
В итоге, молекулярная масса является основным критерием для химического анализа. Исследование ее морфологии способствует лучшему пониманию фундаментальных и прикладных аспектов химии, биологии и много других наук.