массовая доля кислорода
ZUMA ZUMA
Ученик
(103),
закрыт
2 года назад
Вячек
Высший разум
(391245)
10 лет назад
Если в воздухе, то следует считать так: объёмная и молярная доля кислорода – 21%, молярная масса воздуха (средняя) – 29 г/моль.
Масса 0,21 моль кислорода: m(O2) = n*M = 6,72 г
Массовая доля кислорода: w(O2) = m(O2)/m(возд) = 6,72/29 = 0,232, или 23,2%
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% – 21% – 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л | |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} |
large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} | |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | ||||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} |
= | |||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | ||||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | ||||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.
Формула воздуха
ОПРЕДЕЛЕНИЕ
Воздух – это естественная смесь газов (главным образом азота и кислорода), которая образует атмосферу земли.
Газовый состав воздуха
От уровня моря до высоты около 11 000 м (слой тропосферы) газовый состав воздуха остается практически неизменным и выглядит следующим образом:
(
begin{array}{|c|c|c|c|}
hline
Вещество& Формула&Объемная,доля&Массовая,доля\ hline
Азот&mathrm{N}_{2}&78,08&75,5\ hline
Кислород&mathrm{O}_{2}&20,95&23,1\ hline
Аргон&text { Ar }&0,93&1,29\ hline
Углекислый, газ&mathrm{CO}_{2}&0,034&0,046\ hline
Неон&text { Ne }&0,0018&0,0014\ hline
Гелий&text { He }&0,000524&0,000073\ hline
Метан&mathrm{CH}_{4}&0,0002&0,000084\ hline
Криптон&mathrm{Kr}&0,0001&0,003\ hline
Водород&mathrm{H}_{2}&0,00005&0,00008\ hline
Ксенон&text { Xe }&0,000008&0,00004\ hline
end{array}
)
Средняя молярная масса воздуха: 29,16 г / моль
Воздух в тропосфере почти всегда содержит несколько водяных паров. Влажность воздуха зависит от его температуры и высоты над уровнем моря.
Состав воздуха может незначительно варьироваться в зависимости от географического положения, времени года, времени суток. В крупных городах, как правило, высокий уровень углекислого газа. В горах наблюдается более низкое содержание кислорода из-за того, что кислород тяжелее азота, поэтому его плотность уменьшается с высотой быстрее.
В нижних слоях атмосферы могут быть приостановлены определенные количества мелких частиц пыли и золы, которые образуются в процессе сжигания различных видов топлива или в результате вулканических извержений. Присутствие этих мелких частиц в воздухе связано с цветом восходов и закатов из-за рассеяния солнечного света на них.
Примеры решения задач по «воздушной формуле»
ПРИМЕР 1
Плотность некоторого газа в воздухе равна 2. Какова масса этого газа с объемом 5,6 литра (ну)?
Раствор Молекулярная масса воздуха составляет 29 г / моль.
Рассчитайте молекулярную массу этого газа:
(
M(газ) = M(воздух)cdot D(газ) =29 cdot 2=58 г/моль
)
Согласно результату закона Авогадро молярный объем газа в нормальных условиях составляет 22,4 л.
Составьте пропорцию и рассчитайте массу 5,6 литров газа:
58 г газа занимает 22,4 литра
xg-газ занимает 5,6 литров
Отсюда
(
x=58 cdot 5,6 / 22,4=14,5g
)
Масса 5,6 литров газа будет равна 14,5 г.
ПРИМЕР 2
Во время сгорания 5.36 г определенного гомолога бензола потреблялось 56,7 литра воздуха (NU). Определите формулу исходного соединения.
Напишите уравнение для реакции горения:
(
C_{n} H_{2 n-6}+left(frac{3 n-3}{2}right) O_{2}=n C O_{2}+(n-3) H_{2} O
)
Содержание кислорода в воздухе составляет 21%. Рассчитайте объем потребляемого в процессе сгорания кислорода:
(
Vleft(O_{2}right)=V(воздух) cdotomegaleft(O_{2}right) / 100=56,7 cdot 21 / 100=11,9л
)
Количество кислородного вещества будет равно:
(
nleft(O_{2}right)=Vleft(O_{2}right) / V_{M}=11,9 / 22,4=0,531моль
)
Согласно уравнению реакции
(
1моль mathrm{CnH} 2 mathrm{n}-6-(3 mathrm{n}-3) / 2 моль O2
)
(
x моль mathrm{CnH} 2 mathrm{n}-6-0.531 моль O2
)
Следовательно, количество вещества бензольного гомолога, входящего в реакцию, будет равно:
(
x=nleft(C_{n} H_{2 pi-6}right)=frac{2 cdot 0,531}{3 n-3}
)
Молярная масса (
mathrm{CnH} 2 mathrm{n}-6
) равна:
(
Mleft(C_{n} H_{2 n-6}right)=12 n+2 n-6=14 n-6
)
(
nleft(C_{n} H_{2 n-6}right)=frac{mleft(C_{n} H_{2 n-6}right)}{Mleft(C_{n} H_{2 n-6}right)}=frac{5,36}{14 n-6}=frac{2 cdot 0,531}{3 n-3}
)
(
1,062(14 n-6)=5,36(3 n-3)
)
(
1,212 n=9,708
)
(
n=8
)
Следовательно, формула вещества (
mathrm{C} 8 mathrm{H} 10
)
составная формула – (
mathrm{C} 8 mathrm{H} 10
)
Рябов Химия 8 Решение задач Кислород
Рябов Химия 8 Решение задач Кислород — это цитаты (задачи) из Главы 2 «Кислород. Горение» пособия Сборник задач и упражнений по химии: 8-9 классы: к учебникам Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия. 8 кл.», «Химия. 9 кл». ФГОС (к новым учебникам) / М.А. Рябов. — М. : Издательство «Экзамен», 2016. А также ответы и решения задач из указанного сборника.
Цитаты из вышеуказанного учебного пособия использованы на сайте в незначительных объемах, исключительно в учебных и информационных целях (пп. 1 п. 1 ст. 1274 ГК РФ), при этом цитаты переработаны в удобный для пользователя формат. При постоянном использовании задач по химии в 8 классе необходимо купить книгу: Михаил Рябов: Химия. 8-9 классы. Сборник задач и упражнений. ФГОС / М.: Экзамен, 2018. Ответы и решения расчетных задач помогут родителям проверить правильность выполнения домашних заданий.
Ответы на расчетные задачи
2.5.
Определите массу: а) 3 моль газообразного кислорода, б) 14 моль газообразного кислорода.
РЕШЕНИЕ:

Ответ: а) 96 г, б) 448 г.
2.39.
Определите массовую долю кислорода: а) в оксиде углерода(II), б) в оксиде азота(I), в) в оксиде фосфора(III), г) в оксиде кремния(IV).
РЕШЕНИЕ:

Ответ: а) 0,571, б) 0,364, в) 0,436, г) 0,533.
2.40.
Определите массовую долю кислорода: а) в серной кислоте H2SO4, б) в пероксиде водорода Н2O2, в) в карбонате кальция СаСО3, г) в сульфате меди CuSO4.
РЕШЕНИЕ:

Ответ: а) 0,653, б) 0,941, в) 0,48, г) 0,40.
2.53.
Определите массу кислорода, необходимую для окисления: а) 2 моль глюкозы, б) 45 г глюкозы.
РЕШЕНИЕ:

Ответ: а) 384 г, б) 48 г.
2.55.
Определите массу кислорода, необходимую для сжигания: а) 1 кг ацетилена, б) 3 моль ацетилена.
РЕШЕНИЕ:

Ответ: а) 3,08 кг, б) 240 г.
2.56.
Сколько (в кг) кислорода необходимо для полного сгорания: а) 80 кг метана СН4, б) 16 кг серы, в) 60 кг угля, г) 100 кг гептана С7Н16?
РЕШЕНИЕ:

Ответ: а) 320 кг, б) 16 кг, в) 160 кг, г) 176 кг.
2.59.
Какая масса кислорода была получена в ходе реакции фотосинтеза, если при этом: а) образовалось 90 г глюкозы, б) поглотилось 5 моль углекислого газа?
РЕШЕНИЕ:

Ответ: а) 96 г, б) 160 г.
2.60.
Какая масса углекислого газа поглотилась в ходе фотосинтеза, если: а) выделилось 160 г кислорода, б) образовалось 2 моль глюкозы?
РЕШЕНИЕ:

Ответ: а) 220 г, б) 528 г.
2.92.
Массовая доля кислорода в воздухе равна 0,231. Определите массу кислорода, который можно получить: а) из 1000 кг воздуха, б) из 600 г воздуха.
РЕШЕНИЕ:
![]()
Ответ: а) 231 кг, б) 139 г.
2.93.
Массовая доля кислорода в воздухе равна 0,231. Определите массу воздуха, необходимого для получения: а) 100 кг кислорода, б) 200 г кислорода.
РЕШЕНИЕ:
![]()
Ответ: а) 433 кг, б) 866 г.
2.94.
Определите массу воздуха с массовой долей кислорода, равной 0,231, необходимого для полного сгорания: а) 23 кг этилового спирта С2Н5ОН, б) 62 кг фосфора, в) 12 кг магния, г) 29 кг бутана С4Н10.
РЕШЕНИЕ:
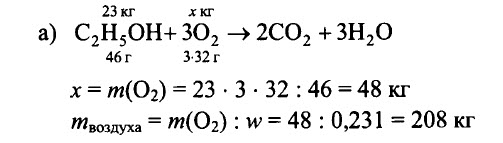
Ответ: а) 208 кг, б) 346 кг, в) 34,6 кг, г) 442 кг.
Рябов Химия 8 Решение задач Кислород
Следующий раздел «Рябов Химия 8 Решение задач Водород»

Pipyka2280
+10
Ответ дан
2 года назад
Химия
5 – 9 классы
какова массовая доля кислорода в воздухе
Ответ проверен экспертом
0/5
(0 оценок)
1

Alexei78
2 года назад
Светило науки – 6498 ответов – 16626 раз оказано помощи
Ответ:
массовая доля кислорода в воздухе – 21%
Объяснение:
Оцените пользу ответа

Мозг
Отвечающий
Остались вопросы?
Задать вопрос
