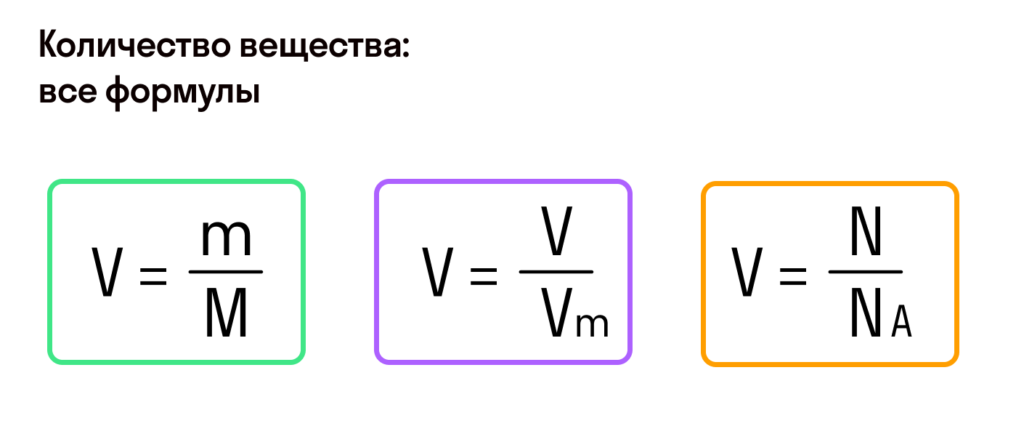
Моль — условное количество вещества
Добавлено: 3 октября 2021 в 12:58

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию».
Школьный курс химии включает понятия «моль» и «молярной массы». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
- O2 + 2H2 = 2H2O
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода.
Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше.
Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅1023 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ.
В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅1023 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
- N = ν⋅ NA =2 ⋅ 6,022⋅1023 = 12,044⋅1023 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅1023 молекул воды?
- ν⋅ = N / NA = 24,088⋅1023 / 6,022⋅1023 = 4 моля.
Что называется молярной массой
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц.
Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — 1 моль вещества или 6,022⋅1023 структурных единиц этого вещества.
Итак, масса вещества равна массе порции вещества m к количеству молекул ν в его порции:
- М = m / ν.
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
- m = М ⋅ ν
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
- M (H2O) = 2 ⋅M (H) + M (O)
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
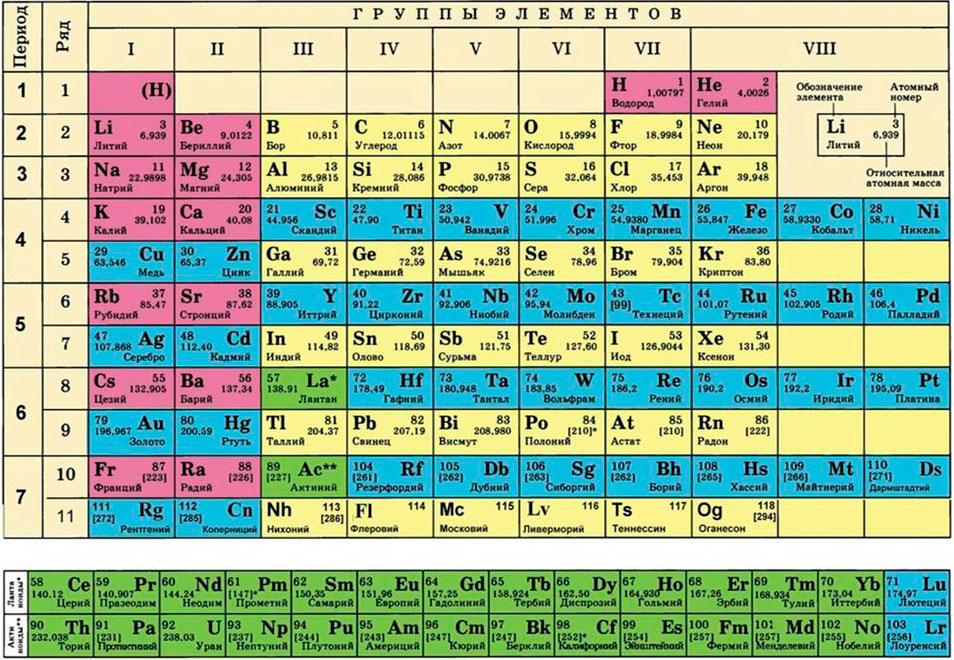
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16.
Подставим соответствующие значения в исходную формулу и получим:
- M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть вес 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
- m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
- ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
Моль, молярная масса и граммы – эти понятия как-то связаны? Давайте-ка в этом разберёмся и порешаем задачи на молярную массу. Для начала вспоминаем, что моль – это количество вещества, в котором содержится 6,02*10 в двадцать третьей степени части (это число Авогадро).
Молярная масса показывает, сколько весит 1 моль того или иного вещества в граммах.
Молярная масса совпадает с атомной (если речь о простых вещества) или молекулярной (если речь о веществах сложных и газах, молекулы которых состоят из двух атомов, например, О2).
Это была теория. Но любую теорию нужно применять на практике, иначе зачем она нужна? Вот и займёмся этим.
У нас есть химическая реакция:
Н2 + F2 = 2HF
Из уравнения мы видим, что для неё нам нужна 1 молекула водорода и одна молекула фтора. Мы может взять, например, 10 молекул водорода, сколько нам в таком случае понадобится молекул фтора? Тоже 10. Мы можем взять и 100 молекул водорода, тогда потребуется и 100 молекул фтора. Кстати, заодно давайте уж узнаем, сколько молекул фторида водорода мы получим.
Из 1 молекулы водорода и 1 молекулы фтора получается две молекулы фторида водорода
(коэффициент в уравнении перед HF – 2). А если мы берём по 10 молекул водорода и фтора, то сколько получим HF? 20. Ну и взяв по 100 молекул водорода и фтора, мы получим 200 молекул фторида водорода.
Проблема в том, что молекулы настолько малы, что взять даже миллион молекул у человека не получится, это слишком маленькое количество вещества, которое на весах не взвесить. Вот тут и пришёл на помощь моль. Ещё раз запомните: в одном моле любого вещества содержится одно и то же число частиц!
Это очень важно для любых расчётов в химии. В 1 моле водорода содержится число Авогадро частиц, в 1 моле железа содержится число Авогадро частиц, в 1 моле воды содержится число Авогадро частиц, в 1 моле серной кислоты содержится число Авогадро частиц. Но! По массе моли веществ различаются, об это мы говорили раньше. И это обязательно нужно понять.
Теперь вернёмся к нашей реакции:
Н2 + F2 = 2HF
1 молекула Н2 + 1 молекула F2 = 2 молекулы HF
2 молекулы Н2 + 2 молекулы F2 = 4 молекулы HF
100 молекул Н2 + 100 молекул F2 = 200 молекул HF
Всё верно, ведь так?
А теперь вот так:
Н2 + F2 = 2HF
число Авогадро молекул Н2 + число Авогадро молекул F2 = число Авогадро молекул HF
или
1 моль Н2 + 1 моль F2 = 2 моль HF
И как же нам наконец перейти к граммам? Для этого вспоминаем, что молярная масса – это масса 1 моля вещества, совпадающая с атомной или молекулярной. Атомную или молекулярную массу мы определяем по таблице Менделеева: 1 моль водорода весит 2 г (атомная масса водорода 1, формула газообразного водорода Н2, поэтому его молекулярная масса 1*2=2), 1 моль фтора весит 38 г (атомная масса фтора 1, формула газообразного фтора F2, поэтому его молекулярная масса 19*2=38). Таким образом, для того, чтобы произошла реакция, нам нужно взять 2 г водорода и 38 граммов фтора. В этом случае оба вещества прореагируют полностью, образовав 40 граммов фторида водорода.
Теперь ещё пара задач на молярную массу с решениями.
Пример 1.
Сколько граммов оксида кальция и углекислого газа нужно взять, чтобы получить 50 граммов оксида кальция в реакции СаО + СО2 = СаСОз?
Решение.
Первое, что нужно сделать, рассчитать молярные массы всех веществ. Используем периодическую таблицу, чтобы узнать атомные массы:
· молярная масса оксида кальция СаО 40+16=56 г/моль
· молярная масса углекислого газа СО2 12+2*16=44 г/ моль
· молярная масса карбоната кальция СаСО3 40+12+3*16=100 г/моль.
Давайте подумаем, сколько моль карбоната кальция СаСО3 составляют 50 г? 1 моль СаСО3 весит 100 г (см. выше на молярную массу). Следовательно 50г весят 0,5 моль. Это означает, что при проведении реакции в условиях задачи получится 0,5 моль карбоната кальция.
Второе, что нужно сделать, – понять в каком соотношении взяты вещества. Об этом нам говорят коэффициенты в уравнение:
СаО + СО2 = СаСОз
1 моль + 1 моль = 1 моль
Но мы уже выяснили, что в нашем случае мы получим всего 0,5 моль СаСОз. То есть и исходных веществ СаО и СО2 нужно взять по 0,5 моль. Переводя в граммы, получим, что оксида кальция требуется 56 г/моль*0,5 моль=28 г, а углекислого газа – 44 г/моль*0,5 моль=22 г. Это и есть ответ.
Пример 2.
Этот пример не из учебника химии, он сложный, но если вы его поймёте, вас никакой репетитор по химии уже не запугает. Пробуем!
Задача звучит так. Алюминий прореагировал с кислородом с образованием оксида алюминия. Известно, что в реакцию вступило 9 граммов алюминия. Определите, сколько получилось оксида алюминия в граммах.
Решение.
Для начала запишем уравнение 4Al + 3O2 = 2Al2O3 и сразу увидим, что 4 моля алюминия, сгорев, образуют 2 моля оксида алюминия.
Теперь смотрим в таблицу Менделеева и определяемся с молярными массами:
· молярная масса алюминия 27 г/моль, с этим всё просто
· молярная масса оксида алюминия Al2O3 102 г/моль (помните, как мы считаем? 2*27 (это алюминий)+3*16 (это кислород)=54+48=102).
Из условия задачи мы узнали, что в реакцию вступило 9 г алюминия. 1 моль алюминия весит 27 г (это молярная масса). Следовательно, в реакцию вступило 9/27 моль алюминия, или 0,3 моль алюминия. Вернёмся к реакции:
4Al + 3O2 = 2Al2O3
4 моля алюминия при сгорании образуют 2 моля оксида алюминия
0,3 моля алюминия при сгорании образуют Х моля оксида алюминия
Находим Х=0,3*2/4=0,15 моль. Таким образом, если в реакции участвовало 9 г алюминия (или 0,3 моль), то получилось 0,15 моль оксида алюминия. Теперь самое простое – ищем массу в граммах. Припоминаем, что молярная масса оксида алюминия 102 г/моль. То есть 102 г весит 1 моль. А у нас всего 0,15 моль, и весит это количество вещества 102*0,15=15,3 г. Ответ на задачу: при сгорании 9 граммов алюминия получается 15,3 граммов оксида алюминия.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.

Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.

Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!

Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Молярная масса алюминия
Молярная масса алюминия
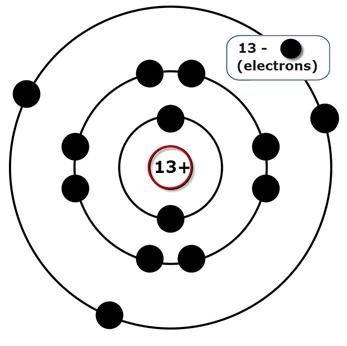
Порядковый номер – 13. Строение атома показано на рис. 1. Металл p-семейства.
Рис. 1. Схема строения атома алюминия.
В обычных условиях представляет собой вещество серебристо-белого цвета. Легко вытягивается в проволоку и прокатывается в тонкие листы. Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводимостью и теплопроводностью. На воздухе быстро покрывается тонким слоем оксида.
Молярная масса алюминия равна 26,9815 г/моль. Эта величина представляет собой массу 1 моль алюминия и выражается в граммах на моль. Расчет молярной массы производят по формуле:
M = m / n.
Молярная масса вещества, выраженная в граммах, численно равна его молекулярной (атомной) массе, выраженной в атомных единицах массы:
M = Ar.
По причине того, что алюминий не может быть переведен в газообразное состояние, для нахождения значения его молярной массы нельзя использовать величину молярного объема или производить расчеты по формуле Менделеева-Клапейрона.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
← Молярная и молекулярная масса
- Относительная молекулярная масса Al: 26.9815386
- Молярная масса Al: 26.9815386 г/моль (0.02698 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| Al (алюминий) | 1 | 26.9815386 | 26.9815386 |
| 26.9815386 |
Расчёт молярной и относительной молекулярной массы Al
- Mr[Al] = Ar[Al] = 26.9815386 = 26.9815386
- Молярная масса (в кг/моль) = Mr[Al] : 1000 = 26.9815386 : 1000 = 0.02698 кг/моль
Электронная конфигурация атома алюминия
Калькулятор массы
Химическая формула соединения
Рассчитать
Поделитесь информацией с друзьями
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
CH2I2 [267.83552]
C11H10 [142.1971]
Калькулятор молекулярной массы

сколько грамм алюминия в одном молле?
Хочу на море!
Мастер
(1692),
закрыт
12 лет назад
Валентина Вавилова(Серкова)
Гений
(62183)
12 лет назад
Количество вещества ( число молей) = массу разделить на молярную массу.
v=m / M . ( v (ню) – число молей=1моль, М – молярная масса алюминия ( из таблицы Менделеева ) =0,027кг/моль, m – масса). , выразим массу:
m=v*M . m=1*0,027=0,027кг. ( 27грамм) .
Можно проще молярная масса это масса одного моля, значит если молярная масса=0,027кг/моль, то масса 1 моля = 0,027кг.