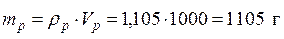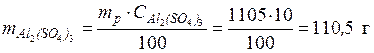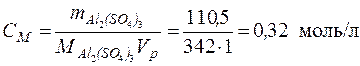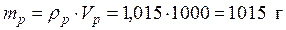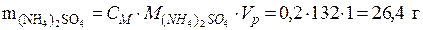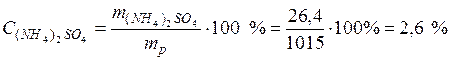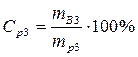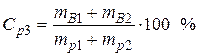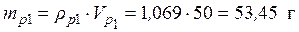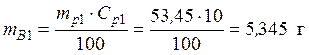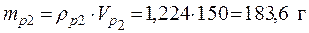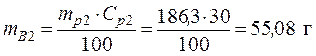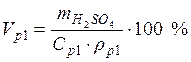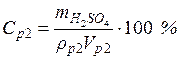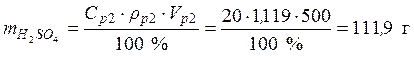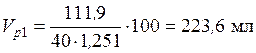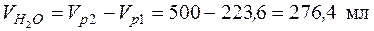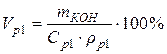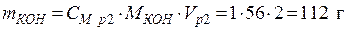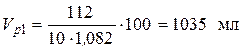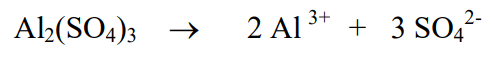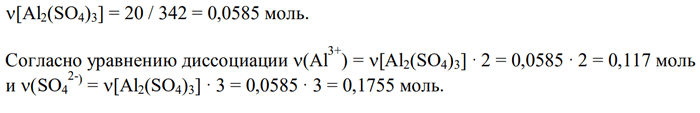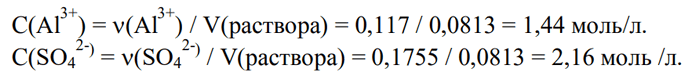Пусть нам дан раствор объемом 1 литр
V(р-ра) = 1 л = 1000 мл
Масса раствора
m(р-ра) = V(р-ра) *ρ(р-ра) = 1000*1,105 = 1105 г
Масса чистого вещества сульфата алюминия в растворе
m(Al2(SO4)3) = w(Al2(SO4)3)*m(р-ра) = 0,1*1105 = 110,5 г
Количество вещества сульфата алюминия в растворе
n(Al2(SO4)3) = m(Al2(SO4)3)/M(Al2(SO4)3) = 110,5/342 = 0,32 моль
Молярная концентрация сульфата алюминия в растворе
См = n(Al2(SO4)3)/V(р-ра) = 0,32/1 = 0,32 моль/л = 0,32 М
Эквивалентное число сульфата алюминия
z(Al2(SO4)3 = z(Al)*x(Al) = 3*2= 6, где
z(Al) = 3 – валентность алюминия в сульфате алюминия
x(Al) = 2 – число атомов алюминия в сульфате алюминия
Нормальная концентрация сульфата алюминия в растворе
Сн = См*z(Al2(SO4)3) = 0,32*6 = 1,92 моль-экв/л = 1,92 н
Можно вывести формулу для определения молярной концентрации раствора
См = n/V(р-ра) = m(вещества) /[М (вещества) *V(р-ра) ] =[m(р-ра) *w(вещества)] / [М (вещества) *V(р-ра) ] = [V(р-ра) *ρ(р-ра) *w(вещества)] /[М (вещества) *V(р-ра) ] = [ρ(р-ра) *w(вещества)] /М (вещества)
В полученную формулу массовая доля подставляется не в процентах, а в сотых долях, а плотность должна иметь размерность г/л, если используешь плотность в г/мл, то в формулу добавляешь поправочный коэффициент
См = [ρ(р-ра) *1000*w(вещества)] /М (вещества)
Подставим в полученную формулу численные значения
См = [1,105*1000*0,1]/342 = 0,32 моль/л
Содержание
- Молярная масса сульфата алюминия
- Молярная масса сульфата алюминия
- Примеры решения задач
- Al2(SO4)3 молярная масса и структурная формула
- Расчет показателя
- Следующий показатель
- Молярная масса эквивалента
- Примеры решения заданий. Пример 1. Какова молярная концентрация раствора сульфата алюминия с массовой долей 10 % и плотностью 1,105 г/см3?;
Молярная масса сульфата алюминия
Молярная масса сульфата алюминия
Хорошо растворим в воде (гидролизуется по катиону). Полностью разлагается щелочами в растворе и при спекании.
Рис. 1. Сульфат алюминия. Внешний вид и строение молекулы.
Брутто-формула сульфата алюминия – Al2(SO4)3. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Mr(Al2(SO4)3) = 2×27 + 3×32 + 12×16 = 54 + 96 + 192 =342.
Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
Это означает, что молярная масса сульфата алюминия 342 г/моль.
Примеры решения задач
| Задание | Составьте формулу соединения магния, серы и кислорода, если соотношение масс элементов в нём m(Mg):m(S):m(O) = 3:4:8. |
| Решение | Для того, чтобы узнать, в каких отношениях находятся химические элементы в составе молекулы необходимо найти их количество вещества. Известно, что для нахождения количества вещества следует использовать формулу: |
Найдем молярные массы магния, серы и кислорода (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева округлим до целых чисел). Известно, что M = Mr, значит (Mg) = 24 г/моль, M(S) = 32 г/моль, а М(O) = 16 г/моль.
Тогда, количество вещества этих элементов равно:
n (Mg) = m (Mg) / M (Mg);
n (Mg) = 3 / 24 = 0,125 моль.
n (S) = 4 / 32 = 0,125 моль.
n (О) = 8 / 16 = 0,5 моль.
Найдем мольное отношение:
n(Mg) :n(S): n(О) = 0,125:0,125:0,5 = 1:1:4.
т.е. формула соединения магния, серы и кислорода имеет вид MgSO4. Это сульфат магния.
Ответ MgSO4
| Задание | Вычислите, какая масса оксида серебра (I) разложилась, если в ходе реакции образовалось металлическое серебро и выделился кислород объемом 5,6 л кислорода (н.у.)? |
| Решение | Запишем уравнение реакции разложения оксида серебра (I): |
Вычислим количество вещества кислорода по формуле:
n (O2) = 5,6 / 22,4 = 0,25 моль.
Согласно уравнению реакции n(O2) :n(Ag2O) = 1 : 2, значит:
n(Ag2O) = 2 × n(O2) = 2 × 0,25 = 0,5 моль.
Найдем молярную массу оксида серебра (I)(значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(Ag2O) = 2×Ar(Ag) + Ar(O) = 2×108 + 16 = 216 + 16 = 232 г/моль.
Источник
Al2(SO4)3 молярная масса и структурная формула
Al2(SO4)3 — сульфат алюминия, неорганическое вещество из класса солей. Встречается в виде кристаллов или порошка белого цвета, хорошо растворяется в воде. Химически активное вещество, хорошо реагирует со многими компонентами, поэтому часто используется в опытах и задачах по химии, но для их решения нужно знать молярную массу Al2(SO4)3.
Расчет показателя
Относительная молекулярная масса сульфата алюминия — это объем одной отдельной молекулы этого вещества. Рассмотрим подробнее.
Показатель выражают в атомных единицах массы (а.е.м.). Ее легко высчитать при помощи периодической системы элементов Менделеева, зная формулу вещества.

Для этого нужно найти в таблице элементы, из которых состоит интересующее нас вещество, — алюминий, серу и кислород. Относительная масса одного атома алюминия составляет 26,992 а.е.м. (округляем до 27), атома серы 32,064 (округляем до 32), атома кислорода 15,999 (округляем до 16).
Формула молекулы сульфата алюминия на рисунке ниже. На нем виден состав молекулы, и сколько атомов каждого элемента участвует в образовании одной условной молекулы вещества.
Дальше нужно умножить массу одного атома алюминия на количество этих частиц в молекуле Al2(SO4)3. Это число указано нижним индексом справа от символа алюминия — 2. Умножаем 2 на 27, получаем 54 а.е.м.
Далее повторим действия с атомом серы. В состав молекулы сульфата алюминия входит три частицы (SO4), а значит три атома серы. Умножаем 32 на 3, получаем 96 а.е.м.
Такой же расчет производим с атомами кислорода. Сначала подсчитаем, сколько их входит в состав молекулы. В ней содержатся три частицы (SO4), то есть 12 атомов кислорода. Умножаем массу на количество атомов — 16 на 12, получаем 192 а.е.м.
Последнее действие — нужно сложить массы всех составных частей молекулы:
54 + 96 + 192 = 342 а.е.м.
Итак, молекулярная масса алюминия сульфата составляет 342 а.е.м.
Следующий показатель
Молярная масса al2 so4 3 — это объем одного моля сульфата алюминия. Его очень легко узнать, так как он численно равен молекулярной массе, но выражается в других единицах измерения — г/моль.
Итак, молярная масса al2 so4 3 составляет 342 г/моль. Эта величина часто требуется для решения задач.
Молярная масса эквивалента
Для расчета этой величины нужно знать фактор эквивалентности. Он определяется по-разному для классов веществ.
Сульфат алюминия относят к группе средних солей. Для таких соединений фактор эквивалентности считается так:
Чтобы найти молярную массу эквивалента сульфата алюминия, умножим его молярную массу на фактор эквивалентности:
342 * 1 / 6 = 57 г/моль.
Итак, молярная масса эквивалента Al2 (SO4) 3 равна 57 г/моль.
Расчеты окончены, искомая величина определена.
Источник
Примеры решения заданий. Пример 1. Какова молярная концентрация раствора сульфата алюминия с массовой долей 10 % и плотностью 1,105 г/см3?;
Пример 1. Какова молярная концентрация раствора сульфата алюминия с массовой долей 10 % и плотностью 1,105 г/см 3 ?

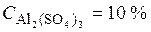

CM –? • Рассчитаем массу Al2(SO4)3 в 1105 г раствора, исходя из формулы (1):
• Молярная масса 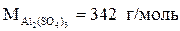
Пример 2. Чему равна массовая доля 0,2 М раствора (NH4)2SO4 с плотностью 1,015 г/мл?

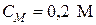

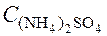
используя формулу (4) (молярная масса 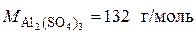
• Массовая доля сульфата алюминия в растворе по формуле (1) :
Пример 3. Смешали 50 мл 10 %-го раствора серной кислоты плотностью 1,069 г/мл и 150 мл 30 %-го раствора той же кислоты, плотностью 1,224 г/мл. Чему равна массовая доля кислоты в конечном растворе?
Условная схема приготовления конечного раствора:
раствор 1 (10 %) + раствор 2 (30 %) = раствор 3 (? %)

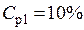
ρp1=1,069 г/мл
Vp1= 50 мл • Исходя из того, что масса конечного раствора складывается
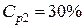
ρp2=1,224 г/мл кислоты – из масс кислоты в исходных растворах, получаем:

• Найдем массовую долю серной кислоты в конечном растворе:
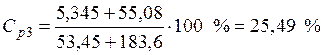
Пример 4. Какой объем 40 %-го раствора азотной кислоты плотностью 1,251 г/мл и воды потребуется для приготовления 500 мл 20 %-ой кислоты плотностью 1,119 г/мл?
Условная схема приготовления раствора:
раствор 1 (40 %) + вода = раствор 2 (20 %)
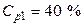
ρp1=1,251 г/мл
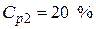
ρp2=1,119 г/мл разбавлении исходного раствора водой масса растворенной

Vp1– ? мл выражения массовой доли раствора 2:
• Рассчитаем объем исходного раствора:
• Исходя из схемы получения конечного раствора:
Пример 5. Какой объем 10 %-го раствора КОН плотностью 1,082 г/мл потребуется для приготовления 2 л 1 М раствора?
Условная схема приготовления раствора:
раствор 1 (10 %) + вода = раствор 2 (1 М)
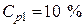
ρp1=1,082 г/мл
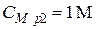

Vp1– ? мл щелочи не изменяется, поэтому ее можно вывести из
выражения молярной концентрации раствора 2:
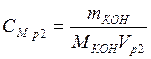
• Рассчитаем объем исходного раствора:
5.2. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПОДГОТОВКИ
1. Какой объем 20 %-го раствора соляной кислоты (ρ = 1,1 г/мл) требуется для приготовления 2 л 5 %-го раствора той же кислоты (ρ = 1,02 г/мл)?
2. Определить молярную концентрацию концентрированной соляной кислоты
(ρ = 1,183 г/мл), содержащей 36 % хлороводорода.
3. Какой объем 50 %-го раствора KOH (ρ = 1,538 г/мл) требуется для приготовления 3 л 10 %-го раствора (ρ = 1,082 г/мл)?
4. Плотность 32 %-го раствора KOH равна 1,31 г/мл. Сколько моль KOH находится в 3 л раствора?
5. Какой объем 28 %-го раствора серной кислоты (ρ = 1,21 г/мл) можно приготовить из 100 г 92 %-го раствора?
6. К 1 л 6 %-го раствора серной кислоты (ρ = 1,04 г/мл) добавили 1 л воды. Вычислить молярную концентрацию полученного раствора.
7. Какой объем 50 %-го раствора H2SO4 (ρ = 1,4 г/мл) требуется для приготовления 2 л 1 М раствора?
8. Смешали 50 мл 20 %-го раствора соляной кислоты (ρ = 1,1 г/мл) и 150 мл 30 %-го раствора той же кислоты (ρ = 1,152 г/мл). Какова массовая доля HCl в полученном растворе?
9. Сколько граммов K2SO4 необходимо для приготовления 500 мл 0,1 М раствора?
10. Какой объем 20 %-го раствора NaОН плотностью 1,225 г/мл потребуется для приготовления 1 л 2 М раствора?
11. Смешали 500 г 10 %-го раствора и 300 г 30 %-го раствора H2SO4. Какова процентная концентрация полученного раствора?
12. Смешали 50 мл 30 %-го раствора азотной кислоты плотностью 1,286 г/мл и 50 мл 50 %-го раствора той же кислоты плотностью 1,316 г/мл. Чему равна массовая доля кислоты в конечном растворе?
13. Какой объем 1 М раствора хлорида натрия можно приготовить из 20 г безводного NaCl?
14. Какой объем 50 %-го раствора азотной кислоты (ρ = 1,316 г/мл) необходим для приготовления 3 л 1,5 М раствора?
15. К 1 л 10 %-го раствора NaOH (ρ = 1,115 г/мл) прибавили 3 л воды. Какова процентная концентрация полученного раствора?
16. Какая масса сульфата натрия требуется для приготовления 500 мл 0,2 М
17. 100 мл 2 М раствора разбавили водой до 400 мл. Какова молярная концентрация раствора?
18. Из 600 г 5 %-го раствора соды (Na2CO3) выпариванием удалили 100 г воды. Какова массовая доля Na2CO3 в полученном растворе?
19. Вычислить объем 10 %-го раствора NaOH (ρ = 1,115 г/мл), который требуется для приготовления 1 л 1 М раствора.
20. В каком объеме 0,2 М раствора содержится 10 г NiSO4?
21. Смешали 20 мл 20 %-го раствора азотной кислоты (ρ = 1,119 г/мл) и 100 мл 30 %-го раствора той же кислоты (ρ = 1,184 г/мл). Вычислить процентную концентрацию полученного раствора.
22. Какая масса хлорида натрия содержится в 100 мл 1 М раствора?
23. Какой объем 10 %-го раствора карбоната натрия (ρ = 1,105 г/мл) требуется для приготовления 3 л 5 %-го раствора (ρ = 1,05 г/мл)?
24. Вычислить молярную концентрацию 25 %-го раствора сульфата цинка
25. Какой объем 30 %-й соляной кислоты (ρ = 1,152 г/мл) нужно взять для приготовления 1 л 2 М раствора?
26. Какой объем воды надо прибавить к 100 мл 50 %-го раствора азотной кислоты (ρ = 1,316 г/мл) для получения 20 %-го раствора?
27. Какая масса KNO3 должна быть растворена в 500 мл воды для получения 5 %-го раствора?
28. К 2 л 10 %-го раствора азотной кислоты (ρ = 1,054 г/мл) добавили 3 л
4 %-го раствора той же кислоты (ρ = 1,022 г/мл). Вычислить процентную концентрацию полученного раствора.
29. Вычислить молярную концентрацию 20 %-го раствора сульфата железа (II) (ρ = 1,21 г/мл).
30. К 50 мл 96 %-го раствора азотной кислоты (ρ = 1,5 г/мл) прилили 30 мл 9,9 М раствора той же кислоты (ρ = 1, 3 г/мл). Какова процентная концентрация полученного раствора?
Источник
Определите молярные концентрации ионов в растворе сульфата…
Задание:
Определите молярные концентрации ионов в растворе сульфата алюминия с массовой долей соли 0,2 и плотностью 1,23 г/мл.
Решение:
1) Сульфат алюминия, как и подавляющее большинство солей, является сильным электролитом и диссоциирует в водном растворе полностью:
2) Пусть имеется 100 г раствора, тогда m(Al2(SO4)3) = 100 · 0,2 = 20 г, а V(раствора) = 100 / 1,23 = 81,3 мл = 0,0813 л.
3) Вычисляем концентрации ионов в растворе:
Ответ: С(Al3+) = 1,44 моль/л; С(SO42-) = 2,16 моль /л.