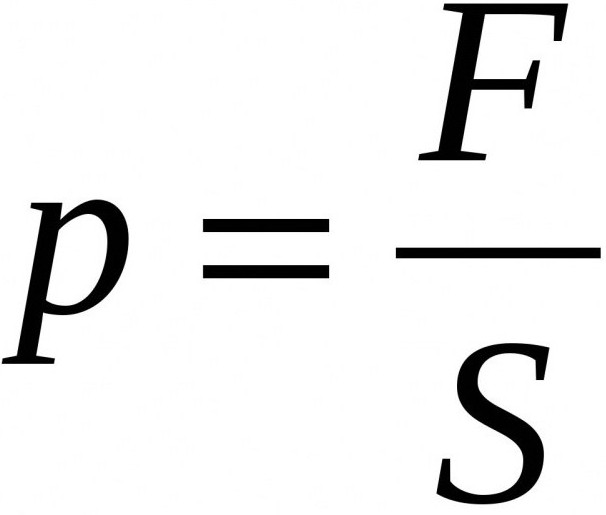Содержание
- Что это за параметр, в чем измеряется?
- От чего зависит?
- Абсолютное и относительное
- Как называется значение, при котором наступает конденсация пара?
- В чем разница в давлении пара?
- Высокого и низкого
- Насыщенного и ненасыщенного
- Чистой и загрязненной воды
- Как меняется от изменения температуры?
- Таблица зависимости
- Как определить?
- Формула и правила расчета
- Несколько примеров
- Где используют знания в жизни?
- Видео по теме статьи
- Заключение
Что это за параметр, в чем измеряется?
Давлением пара является физическая величина, которая показывает величину нагрузки, оказываемой паром, находящимся в замкнутом состоянии. При этом давление оказывается на стенки предмета, в котором пар находится.
Для расчета берется показатель, при котором пар находится в термодинамическом равновесии с жидкостью. Также учитывается температура кипения жидкости на единицу времени.
Единицей измерения этой величины является Паскаль (Па). Его часто сопоставляют с атмосферным: 760 мм.рт.ст = 101 кПа=1,01 Бар=1 атм. В расчетных формулах и документации давление пара обозначается буквой «P».
От чего зависит?
На величину давления влияют следующие факторы:
-
Температура кипения. Чем выше температура кипения, тем выше давление пара.
Также учитывается интенсивность испарения, которая различна для всех жидкостей и твердых тел.
-
Интенсивность. Чем быстрее вода или иная жидкость испаряется, тем быстрее растет давление.
Это применимо только при испарении в закрытых сосудах. На открытом воздухе интенсивность испарения не влияет на величину давления.
- Высота. На большой высоте давление пара всегда меньше, так как на него не оказывает влияние атмосферное давление. Также стоит учитывать, что атмосферное давление влияет на температуру кипения жидкости. Она значительно ниже на высоте, а, значит, процесс испарения происходит быстрее.
- Площадь. Чем меньше площадь, тем выше давление. В емкостях этот параметр всегда выше, чем на открытой местности.
- Насыщение. Давление насыщенного пара выше, так как в нем содержится больше воды. Но этот параметр может быстро измениться с началом конденсации. Также существует зависимость давления от типа пара. Давление ненасыщенного или перегретого пара всегда ниже.
Все эти параметры влияют на давление пара. Для различных химических или твердых элементов степень воздействия может быть разной.
Абсолютное и относительное
Существует 2 основных типа величины давления, которые применимы для расчета пара:
-
Абсолютное. Этой величиной является любое давление, которое выше эталонной точки отсчета от абсолютного нулевого вакуума. Согласно этому, даже давление небольшого испарения с поверхности естественного источника может быть рассчитано как абсолютное.
Данный параметр обозначается как «ABS». Если пар находится в закрытом сосуде, то абсолютное давление рассчитывается из суммы атмосферного и избыточного давления, с учетом чтобы результат был больше величины атмосферного.
- Относительное или избыточное давление является величиной, которая отличается от актуального атмосферного давления. Например, атмосферное давление 0,75 мм. рт. ст=100 Па.
Абсолютное и относительное давление используется для контроля работы паровых установок различного типа.
Как называется значение, при котором наступает конденсация пара?
Конденсация — это процесс возврата молекул жидкости из пара обратно в воду. Данный процесс характерен для насыщенного пара. Давление, при котором наступает процесс конденсации воды, является давлением насыщенного пара.
Этот параметр характеризуется образованием термодинамического равновесия между водой и паром. Иными словами, это давление одинаковой температуры пара и жидкости.
Этот тип давления используется в паровых установках, имеющих датчики конденсата и его слив. Таким образом контролируется образование конденсата и время его обратного испарения. Для паров ненасыщенного или перегретого типа эта характеристика не применима.
В чем разница в давлении пара?
Давление может быть различным при одинаковой температуре. Все зависит от качества исходной жидкости и типа самого пара.
Высокого и низкого
Пар низкого давления образуется при температуре кипения от 100 до 140 градуса. Его давление варьируется в пределах 2-3 атмосфер. Его часто применяют в теплоносителях.
Пар высокого давления является перегретым. В его структуре нет молекул воды. Он образуется при температуре от 180 градусов. Точка отсчета давления такого пара начинается от 10 атм. Такой пар используют в качестве энергии движения или для нагрева вязких жидкостей.
Насыщенного и ненасыщенного
Давление насыщенного пара не имеет прямой зависимости от его объема. При температуре кипения 100 градусов, при сохранении нормальных значений атмосферного давления, давление насыщенного пара приблизительно равняется 100 кПа.
Между насыщенным и ненасыщенным паром всегда есть разница в давлении. Давление ненасыщенного всегда на порядок меньше.
Это связано с тем, что при одинаковой температуре кипения, ненасыщенный пар не входит в термодинамическое равновесие и испаряется. Это приводит к потере давления и повторному парообразованию.
Чистой и загрязненной воды

Связано это с процессом кипения. Чистая вода закипает быстрее, так как на нее затрачивается меньше энергии.
Грязная вода прогревается значительно дольше, по причине затраты энергии на выпаривание загрязнений. Также большую роль играет испарение загрязнений (характерно для химических веществ).
Чужеродные химические элементы нарушают термодинамическое равновесие, что приводит к испарению и потере давления.
Также стоит учитывать свойства некоторых растворителей к выпариванию без осадка. Это значит, что пар насыщается долей инородных веществ, значительно увеличивающих плотность пара.
Как меняется от изменения температуры?
При повышении температуры давление пара увеличивается. Это происходит по причине перенасыщения молекулами воды. Из-за этого плотность пара возрастает, и начинается процесс конденсации.
При продолжительном росте температуры нарушается термодинамическое равновесие, повышается температура самого пара. Это приводит к выпариванию молекул воды и образованию перегретого пара.
При снижении температуры нагревания заметно снижается давление пара. Это происходит по причине снижения плотности пара. Образованный конденсат больше не меняет свое агрегатное состояние, а, значит, не происходит образование нового пара. При этом падает плотность.
Таблица зависимости
Пар отличается от идеальных газов. Его давление зависит от температуры и чем быстрее температура растет, тем сильнее давление. Это можно проследить по графику насыщенного водяного пара:
| T — °С | p-кПа |
| 5 | 0,88 |
| 10 | 1,23 |
| при 14 | 1,6 |
| 15 | 1,71 |
| 20 | 2,33 |
| при 22 градусах | 2,56 |
| 25 | 3,17 |
| при 27 | 3,4 |
| 30 | 4,6 |
| 35 | 5,62 |
| 40 | 7,38 |
| 45 | 9,5 |
| 50 | 12,3 |
| 75 | 38,2 |
| 100 | 101,3 |
Из таблицы хорошо видно, что с ростом температуры происходит увеличение давления, вследствие увеличения скорости парообразования. Значения, выше описанных в таблице, могут способствовать снижению давления по причине выпаривания и перегрева пара.
Как определить?
Рассмотрим, как произвести расчеты.
Формула и правила расчета

- «n» — величина концентрации пара.
- «k» — постоянная Больцмана.
- «t» — температура среды.
При расчете учитываются свойства: давление зависит от температуры и не зависит от объема.
Несколько примеров
Простой расчет давления пара над растворителем делается по формуле P=P0*N. Выражение состоит:
- P0 – давление пара раствора.
- N – доля растворителя (моль).
Также стоит учесть долю уже растворенной части растворителя. Например:
- Масса электролита 28,5 г.
- Объем воды 785 г.
- Понижение давления пара 52,37 Па.
- Температура 40 градусов.
Это уравнение имеет зависимость от табличных величин молекулярных масс растворов.
Для жидкости и пара, находящихся в емкости, расчет делается так:
- Объем емкости 0,5 м3.
- Масса воды 0,5 кг.
- Температура 147 градусов.
- Давление пара неизвестно.
0,5*0,5*147=367,5 кПа.
Где используют знания в жизни?
Самым известным измерительным устройством контроля давления является манометр. Давление пара используется во многих сферах:
- Отопление. Паровые котельные применяют пар для обогрева помещений. При этом контроль давления помогает поддерживать работоспособность всей системы. Данная характеристика указывает на переизбыток или недостаток давления, что приводит к нарушению подачи пара или разгерметизации.
- Пар применяется в установках в качестве движущей силы. Например, в паровозах. Тут контроль давления помогает рассчитать не только расход воды и энергии, но и поддерживать стабильность хода.
- Давление пара используется также синоптиками. Эта характеристика указывает влажность воздуха или уровень его сухости.
Давление пара несет множество полезных функций. Но недостаточный его контроль может быть губительным как для человека, так и для промышленного оборудования.
Видео по теме статьи
О давлении водяного пара расскажет видео:
Заключение
В статье была раскрыта тема давления пара. Эта величина является основной, как при расчетах, так и при регулировке температуры теплоносителей. Этот параметр помогает людям контролировать работу оборудования, работающего на энергии пара.
Загрузить PDF
Загрузить PDF
Вы когда-нибудь оставляли бутылку воды на несколько часов под палящим солнцем и слышали «шипящий» звук, открывая ее? Этот звук вызван давлением пара. В химии давление пара – это давление, оказываемое парами жидкости, которая испаряется в герметично закрытом сосуде.[1]
Чтобы найти давление пара при данной температуре, воспользуйтесь уравнением Клапейрона-Клаузиуса: ln(P1/P2) = (ΔHvap/R)((1/T2) – (1/T1)).
-
1
Запишите уравнение Клапейрона-Клаузиуса, которое используется для расчета давления пара при его изменении с течением времени.[2]
Эту формулу можно использовать в большинстве физических и химических задач. Уравнение выглядит следующим образом: ln(P1/P2) = (ΔHvap/R)((1/T2) – (1/T1)), где:- ΔHvap – энтальпия испарения жидкости. Ее, как правило, можно найти в таблице в учебниках по химии.
- R – газовая постоянная, равная 8,314 Дж/(K×моль)[3]
- T1 – начальная температура (при которой давление пара известно).
- T2 – конечная температура (при которой давление пара неизвестно).
- P1 и P2 – давление пара при температуре T1 и T2, соответственно.
-
2
Подставьте в уравнение Клапейрона-Клаузиуса данные вам значения величин. В большинстве задач даются два значения температуры и значение давления или два значения давления и значение температуры.
- Например, в сосуде находится жидкость при температуре 295 К, а давление ее паров равно 1 атмосфере (1 атм). Найдите давление паров при температуре 393 K. Здесь вам даны два значения температуры и значение давления, поэтому вы можете найти другое значение давления при помощи уравнения Клапейрона-Клаузиуса. Подставив данные вам значения в формулу, вы получите: ln(1/P2) = (ΔHvap/R)((1/393) – (1/295)).
- Обратите внимание, что в уравнении Клапейрона-Клаузиуса температура всегда измеряется в кельвинах, а давление в любых единицах измерения (но они должны быть одинаковыми для Р1 и Р2).
-
3
Подставьте константы. Уравнение Клапейрона-Клаузиуса содержит две константы: R и ΔHvap. R всегда равна 8,314 Дж/(К×моль). Значение ΔHvap (энтальпия испарения) зависит от вещества, давление паров которого вы пытаетесь найти; эту константу, как правило, можно найти в таблице в учебниках по химии или на сайтах (например, здесь).[4]
- В нашем примере допустим, что в сосуде находится вода. ΔHvap воды равна 40,65 кДж/моль или равна 40650 Дж/моль.
- Подставьте константы в формулу и получите: ln(1/P2) = (40650/8314)((1/393) – (1/295)).
-
4
Решите уравнение при помощи алгебраических операций.
- В нашем примере неизвестная переменная находится под знаком натурального логарифма (ln). Для избавления от натурального логарифма превратите обе стороны уравнения в степень математической константы «е». Другими словами, ln(x) = 2 → eln(x) = e2 → x = e2.
- Теперь решите уравнение:
- ln(1/P2) = (40650/8,314)((1/393) – (1/295))
- ln(1/P2) = (4889,34)(-0,00084)
- (1/P2) = e(-4,107)
- 1/P2 = 0,0165
- P2 = 0.0165-1 = 60,76 атм. Это имеет смысл, так как повышение температуры в герметично закрытом сосуде на 100 градусов приведет к увеличению парообразования, что значительно увеличит давление пара.
Реклама
-
1
Запишите закон Рауля. В реальной жизни чистые жидкости встречаются редко; зачастую мы имеем дело с растворами. Раствор получается при добавлении небольшого количества определенного химического вещества, называемого «растворенное вещество», в большее количество другого химического вещества, называемого «растворитель». В случаях растворов пользуйтесь законом Рауля:[5]
Pраствор = PрастворительXрастворитель, где:- Pраствор – давление паров раствора.
- Pрастворитель – давление паров растворителя.
- Xрастворитель – мольная доля растворителя.
- Если вы не знаете, что такое «мольная доля», читайте дальше.
-
2
Определите, какое вещество будет растворителем, а какое – растворенным веществом. Напомним, что растворенное вещество – это вещество, растворяемое в растворителе, а растворитель – это вещество, растворяющее растворенное вещество.
- Рассмотрим пример сиропа. Для получения сиропа одну часть сахара растворяют в одной части воды, поэтому сахар – это растворенное вещество, а вода – это растворитель.[6]
- Обратите внимание, что химическая формула сахарозы (обыкновенного сахара): C12H22O11. Она понадобится нам в дальнейшем.
- Рассмотрим пример сиропа. Для получения сиропа одну часть сахара растворяют в одной части воды, поэтому сахар – это растворенное вещество, а вода – это растворитель.[6]
-
3
Найдите температуру раствора, так как она будет влиять на давление его пара. Чем выше температура, тем выше давление паров, так как с ростом температуры растет парообразование.
- В нашем примере допустим, что температура сиропа равна 298 K (около 25˚С).
-
4
Найдите давление паров растворителя. В справочниках по химии приводятся значения давления паров многих распространенных химических веществ, но, как правило, такие значения даны при температуре веществ в 25°С/298 К или при их температурах кипения. Если в задаче вам даны такие температуры, используйте значения из справочников; в противном случае вам необходимо вычислить давление паров при данной температуре вещества.
- Для этого воспользуйтесь уравнением Клапейрона-Клаузиуса, подставив в него давление паров и температуру 298 К (25˚С) вместо P1 и T1, соответственно.
- В нашем примере температура раствора равна 25°С, поэтому пользуйтесь значением из справочных таблиц – давление паров воды при 25°С равно 23,8 мм ртутного столба.[7]
-
5
Найдите мольную долю растворителя. Для этого найдите отношение числа молей вещества к общему числу молей всех веществ, имеющихся в растворе. Другими словами, мольная доля каждого вещества равна (число молей вещества)/(общее число молей всех веществ).
- Допустим, что для приготовления сиропа вы использовали 1 л воды и 1 л сахарозы (сахара). В этом случае необходимо найти число молей каждого вещества. Для этого нужно найти массу каждого вещества, а затем использовать молярные массы этих веществ, чтобы получить моли.
- Масса 1 л воды = 1000 г
- Масса 1 л сахара = 1056,7г[8]
- Моль (вода): 1000 г×1 моль/18,015 г = 55,51 моль
- Моль (сахароза): 1056,7 г×1 моль/342,2965 г = 3,08 моль (обратите внимание, что вы можете найти молярную массу сахарозы из ее химической формулы C12H22O11).
- Общее число молей: 55,51 + 3,08 = 58,59 моль
- Мольная доля воды: 55,51/58,59 = 0,947.
-
6
Теперь подставьте данные и найденные значения величин в уравнение Рауля, приведенное в начале этого раздела (Pраствор = PрастворительXрастворитель).
- В нашем примере:
- Pраствор = (23,8 мм рт. ст.)(0,947)
- Pраствор = 22,54 мм рт. ст. Это имеет смысл, так как в большом количестве воды растворено небольшое количество сахара (если измерять в молях; в литрах их количество одинаково), поэтому давление паров незначительно уменьшится.
Реклама
-
1
Определение стандартных условий. Зачастую в химии используются значения температуры и давления как своего рода значения «по умолчанию». Такие значения называются стандартными температурой и давлением (или стандартными условиями). В задачах на давление пара часто упоминаются стандартные условия, поэтому лучше запомнить стандартные значения:[9]
- Температура: 273,15 K/0˚C/32 F
- Давление: 760 мм рт.ст./1 атм./101,325 кПа
-
2
Перепишите уравнение Клапейрона-Клаузиуса так, чтобы найти другие переменные. В первом разделе этой статьи было показано, как вычислять давления паров чистых веществ. Однако не во всех задачах требуется найти давление P1 или P2; во многих задачах нужно вычислить температуру или значение ΔHvap. В таких случаях перепишите уравнение Клапейрона-Клаузиуса, обособив неизвестную величину на одной стороне уравнения.
- Например, дана неизвестная жидкость, давление пара которой равно 25 торр при 273 К и 150 Торр при 325 К. Нужно найти энтальпию испарения этой жидкости (то есть ΔHvap). Решение этой задачи:
- ln(P1/P2) = (ΔHvap/R)((1/T2) – (1/T1))
- (ln(P1/P2))/((1/T2) – (1/T1)) = (ΔHvap/R)
- R × (ln(P1/P2))/((1/T2) – (1/T1)) = ΔHvap Теперь подставьте данные вам значения:
- 8,314 Дж/(K × моль) × (-1,79)/(-0,00059) = ΔHvap
- 8,314 Дж/(K × моль) × 3033,90 = ΔHvap = 25223,83 Дж/моль
-
3
Учтите давления пара растворенного вещества. В нашем примере из второго раздела этой статьи растворенное вещество – сахар – не испаряется, но если растворенное вещество производит пар (испаряется), давление такого пара следует учесть. Для этого воспользуйтесь модифицированным видом уравнения Рауля: Pраствор = Σ(PвеществоXвещество), где символ Σ (сигма) означает, что необходимо сложить значения давлений паров всех веществ, из которых состоит раствор.
- Например, рассмотрим раствор, состоящий из двух химических веществ: бензола и толуола. Общий объем раствора 120 миллилитров (мл); 60 мл бензола и 60 мл толуола. Температура раствора равна 25°С, а давление паров при 25°С равно 95,1 мм рт.ст. для бензола и 28,4 мм рт.ст. для толуола. Необходимо вычислить давление паров раствора. Мы можем сделать это при помощи плотностей веществ, их молекулярных масс и значений давления паров:
- Масса (бензол): 60 мл = 0,06 л × 876,50 кг/1000 л = 0,053 кг = 53 г
- Масса (толуол): 0,06 л × 866,90 кг/1000 л = 0,052 кг = 52 г
- Моль (бензол): 53 г × 1 моль/78,11 г = 0,679 моль
- Моль (толуол): 52 г × 1 моль/92,14 г = 0,564 моль
- Общее число молей: 0,679 + 0,564 = 1,243
- Мольная доля (бензол): 0,679/1,243 = 0,546
- Мольная доля (толуол): 0,564/1,243 = 0,454
- Решение: Pраствор = PбензолXбензол + PтолуолXтолуол
- Pраствор = (95,1 мм рт. ст.)(0,546) + (28,4 мм рт. ст.)(0,454)
- Pраствор = 51,92 мм рт. ст. + 12,89 мм рт. ст. = 64,81 мм рт. ст.
Реклама
Советы
- Для использования уравнения Клапейрона Клаузиуса температура должна быть указана в градусах Кельвина (обозначается К). Если у вас дана температура по Цельсию, необходимо конвертировать ее при помощи следующей формулы: Tk = 273 + Tc
- Описанный выше метод работает, потому что энергия прямо пропорциональна количеству тепла. Температура жидкости является единственным фактором окружающей среды, от которой зависит давление паров.
Реклама
Об этой статье
Эту страницу просматривали 27 725 раз.
Была ли эта статья полезной?
From Wikipedia, the free encyclopedia
The microscopic process of evaporation and condensation at the liquid surface.
The pistol test tube experiment. The tube contains alcohol and is closed with a piece of cork. By heating the alcohol, the vapors fill in the space, increasing the pressure in the tube to the point of the cork popping out.
Vapor pressure (or vapour pressure in Commonwealth English; see spelling differences and equilibrium vapor pressure) is defined as the pressure exerted by a vapor in thermodynamic equilibrium with its condensed phases (solid or liquid) at a given temperature in a closed system. The equilibrium vapor pressure is an indication of a liquid’s thermodynamic tendency to evaporate. It relates to the balance of particles escaping from the liquid (or solid) in equilibrium with those in a coexisting vapor phase. A substance with a high vapor pressure at normal temperatures is often referred to as volatile. The pressure exhibited by vapor present above a liquid surface is known as vapor pressure. As the temperature of a liquid increases, the attractive interactions between liquid molecules become less significant in comparison to the entropy of those molecules in the gas phase, increasing the vapor pressure. Thus, liquids with strong intermolecular interactions are likely to have smaller vapor pressures, with the reverse true for weaker interactions.
The vapor pressure of any substance increases non-linearly with temperature, often described by the Clausius–Clapeyron relation. The atmospheric pressure boiling point of a liquid (also known as the normal boiling point) is the temperature at which the vapor pressure equals the ambient atmospheric pressure. With any incremental increase in that temperature, the vapor pressure becomes sufficient to overcome atmospheric pressure and cause the liquid to form vapor bubbles. Bubble formation in high liquid depths requires a slightly higher temperature due to the higher fluid pressure, due to hydrostatic pressure of the fluid mass above. More important at shallow depths is the higher temperature required to start bubble formation. The surface tension of the bubble wall leads to an overpressure in the very small, initial bubbles.
The vapor pressure that a single component in a mixture contributes to the total pressure in the system is called partial pressure. For example, air at sea level, and saturated with water vapor at 20 °C, has partial pressures of about 2.3 kPa of water, 78 kPa of nitrogen, 21 kPa of oxygen and 0.9 kPa of argon, totaling 102.2 kPa, making the basis for standard atmospheric pressure.
Measurement and units[edit]
Vapor pressure is measured in the standard units of pressure. The International System of Units (SI) recognizes pressure as a derived unit with the dimension of force per area and designates the pascal (Pa) as its standard unit. One pascal is one newton per square meter (N·m−2 or kg·m−1·s−2).
Experimental measurement of vapor pressure is a simple procedure for common pressures between 1 and 200 kPa.[1] Most accurate results are obtained near the boiling point of substances and large errors result for measurements smaller than 1kPa. Procedures often consist of purifying the test substance, isolating it in a container, evacuating any foreign gas, then measuring the equilibrium pressure of the gaseous phase of the substance in the container at different temperatures. Better accuracy is achieved when care is taken to ensure that the entire substance and its vapor are at the prescribed temperature. This is often done, as with the use of an isoteniscope, by submerging the containment area in a liquid bath.
Very low vapor pressures of solids can be measured using the Knudsen effusion cell method.
In a medical context, vapor pressure is sometimes expressed in other units, specifically millimeters of mercury (mmHg). This is important for volatile inhalational anesthetics, most of which are liquids at body temperature, but with a relatively high vapor pressure.
Estimating vapor pressures with Antoine equation[edit]
The Antoine equation[2][3] is a pragmatic mathematical expression of the relation between the vapor pressure and the temperature of pure liquid or solid substances. It is obtained by curve-fitting and is adapted to the fact that vapor pressure is usually increasing and concave as a function of temperature. The basic form of the equation is:
and it can be transformed into this temperature-explicit form:
where:
A simpler form of the equation with only two coefficients is sometimes used:
which can be transformed to:
Sublimations and vaporizations of the same substance have separate sets of Antoine coefficients, as do components in mixtures.[2] Each parameter set for a specific compound is only applicable over a specified temperature range. Generally, temperature ranges are chosen to maintain the equation’s accuracy of a few up to 8–10 percent. For many volatile substances, several different sets of parameters are available and used for different temperature ranges. The Antoine equation has poor accuracy with any single parameter set when used from a compound’s melting point to its critical temperature. Accuracy is also usually poor when vapor pressure is under 10 Torr because of the limitations of the apparatus[citation needed] used to establish the Antoine parameter values.
The Wagner equation[4] gives “one of the best”[5] fits to experimental data but is quite complex. It expresses reduced vapor pressure as a function of reduced temperature.
Relation to boiling point of liquids[edit]
A log-lin vapor pressure chart for various liquids
As a general trend, vapor pressures of liquids at ambient temperatures increase with decreasing boiling points. This is illustrated in the vapor pressure chart (see right) that shows graphs of the vapor pressures versus temperatures for a variety of liquids.[6] At the normal boiling point of a liquid, the vapor pressure is equal to the standard atmospheric pressure defined as 1 atmosphere,[7] 760 Torr, 101.325 kPa, or 14.69595 psi.
For example, at any given temperature, methyl chloride has the highest vapor pressure of any of the liquids in the chart. It also has the lowest normal boiling point at −24.2 °C (−11.6 °F), which is where the vapor pressure curve of methyl chloride (the blue line) intersects the horizontal pressure line of one atmosphere (atm) of absolute vapor pressure.
Although the relation between vapor pressure and temperature is non-linear, the chart uses a logarithmic vertical axis to produce slightly curved lines, so one chart can graph many liquids. A nearly straight line is obtained when the logarithm of the vapor pressure is plotted against 1/(T + 230)[8] where T is the temperature in degrees Celsius. The vapor pressure of a liquid at its boiling point equals the pressure of its surrounding environment.
Liquid mixtures: Raoult’s law[edit]
Raoult’s law gives an approximation to the vapor pressure of mixtures of liquids. It states that the activity (pressure or fugacity) of a single-phase mixture is equal to the mole-fraction-weighted sum of the components’ vapor pressures:
where 






Systems that have vapor pressures higher than indicated by the above formula are said to have positive deviations. Such a deviation suggests weaker intermolecular attraction than in the pure components, so that the molecules can be thought of as being “held in” the liquid phase less strongly than in the pure liquid. An example is the azeotrope of approximately 95% ethanol and water. Because the azeotrope’s vapor pressure is higher than predicted by Raoult’s law, it boils at a temperature below that of either pure component.
There are also systems with negative deviations that have vapor pressures that are lower than expected. Such a deviation is evidence for stronger intermolecular attraction between the constituents of the mixture than exists in the pure components. Thus, the molecules are “held in” the liquid more strongly when a second molecule is present. An example is a mixture of trichloromethane (chloroform) and 2-propanone (acetone), which boils above the boiling point of either pure component.
The negative and positive deviations can be used to determine thermodynamic activity coefficients of the components of mixtures.
Solids[edit]
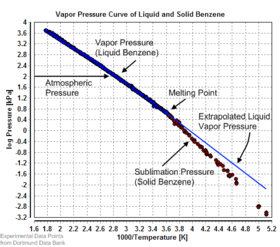
Vapor pressure of liquid and solid benzene
Equilibrium vapor pressure can be defined as the pressure reached when a condensed phase is in equilibrium with its own vapor. In the case of an equilibrium solid, such as a crystal, this can be defined as the pressure when the rate of sublimation of a solid matches the rate of deposition of its vapor phase. For most solids this pressure is very low, but some notable exceptions are naphthalene, dry ice (the vapor pressure of dry ice is 5.73 MPa (831 psi, 56.5 atm) at 20 °C, which causes most sealed containers to rupture), and ice. All solid materials have a vapor pressure. However, due to their often extremely low values, measurement can be rather difficult. Typical techniques include the use of thermogravimetry and gas transpiration.
There are a number of methods for calculating the sublimation pressure (i.e., the vapor pressure) of a solid. One method is to estimate the sublimation pressure from extrapolated liquid vapor pressures (of the supercooled liquid), if the heat of fusion is known, by using this particular form of the Clausius–Clapeyron relation:[9]
where:
This method assumes that the heat of fusion is temperature-independent, ignores additional transition temperatures between different solid phases, and it gives a fair estimation for temperatures not too far from the melting point. It also shows that the sublimation pressure is lower than the extrapolated liquid vapor pressure (ΔfusH > 0) and the difference grows with increased distance from the melting point.
Boiling point of water[edit]
Graph of water vapor pressure versus temperature. At the normal boiling point of 100 °C, it equals the standard atmospheric pressure of 760 torr or 101.325 kPa.
Like all liquids, water boils when its vapor pressure reaches its surrounding pressure. In nature, the atmospheric pressure is lower at higher elevations and water boils at a lower temperature. The boiling temperature of water for atmospheric pressures can be approximated by the Antoine equation:
or transformed into this temperature-explicit form:
where the temperature 

Dühring’s rule[edit]
Dühring’s rule states that a linear relationship exists between the temperatures at which two solutions exert the same vapor pressure.
Examples[edit]
The following table is a list of a variety of substances ordered by increasing vapor pressure (in absolute units).
| Substance | Vapor pressure | Temperature (°C) |
||
|---|---|---|---|---|
| (Pa) | (bar) | (mmHg) | ||
| Octaethylene glycol[10] | 9.2×10−8 Pa | 9.2×10−13 | 6.9×10−10 | 89.85 |
| Glycerol | 0.4 Pa | 0.000004 | 0.003 | 50 |
| Mercury | 1 Pa | 0.00001 | 0.0075 | 41.85 |
| Tungsten | 1 Pa | 0.00001 | 0.0075 | 3203 |
| Xenon difluoride | 600 Pa | 0.006 | 4.50 | 25 |
| Water (H2O) | 2.3 kPa | 0.023 | 17.5 | 20 |
| Propanol | 2.4 kPa | 0.024 | 18.0 | 20 |
| Methyl isobutyl ketone | 2.66 kPa | 0.0266 | 19.95 | 25 |
| Iron pentacarbonyl | 2.80 kPa | 0.028 | 21 | 20 |
| Ethanol | 5.83 kPa | 0.0583 | 43.7 | 20 |
| Freon 113 | 37.9 kPa | 0.379 | 284 | 20 |
| Acetaldehyde | 98.7 kPa | 0.987 | 740 | 20 |
| Butane | 220 kPa | 2.2 | 1650 | 20 |
| Formaldehyde | 435.7 kPa | 4.357 | 3268 | 20 |
| Propane[11] | 997.8 kPa | 9.978 | 7584 | 26.85 |
| Carbonyl sulfide | 1.255 MPa | 12.55 | 9412 | 25 |
| Nitrous oxide[12] | 5.660 MPa | 56.60 | 42453 | 25 |
| Carbon dioxide | 5.7 MPa | 57 | 42753 | 20 |
Estimating vapor pressure from molecular structure[edit]
Several empirical methods exist to estimate the vapor pressure from molecular structure for organic molecules. Some examples are SIMPOL.1 method,[13] the method of Moller et al.,[9] and EVAPORATION (Estimation of VApour Pressure of ORganics, Accounting for Temperature, Intramolecular, and Non-additivity effects).[14][15]
Meaning in meteorology[edit]
In meteorology, the term vapor pressure means the partial pressure of water vapor in the atmosphere, even if it is not in equilibrium.[16] This differs from its meaning in other sciences.[16]
According to the American Meteorological Society Glossary of Meteorology, saturation vapor pressure properly refers to the equilibrium vapor pressure of water above a flat surface of liquid water or solid ice, and is a function only of temperature and whether the condensed phase is liquid or solid.[17]
Relative humidity is defined relative to saturation vapor pressure.[18]
Equilibrium vapor pressure does not require the condensed phase to be a flat surface; it might consist of tiny droplets possibly containing solutes (impurities), such as a cloud.[19][18] Equilibrium vapor pressure may differ significantly from saturation vapor pressure depending on the size of droplets and presence of other particles which act as cloud condensation nuclei.[19][18]
However, these terms are used inconsistently, and some authors use “saturation vapor pressure” outside the narrow meaning given by the AMS Glossary. For example, a text on atmospheric convection states, “The Kelvin effect causes the saturation vapor pressure over the curved surface of the droplet to be greater than that over a flat water surface” (emphasis added).[20]
The still-current term saturation vapor pressure derives from the obsolete theory that water vapor dissolves into air, and that air at a given temperature can only hold a certain amount of water before becoming “saturated”.[18] Actually, as stated by Dalton’s law (known since 1802), the partial pressure of water vapor or any substance does not depend on air at all, and the relevant temperature is that of the liquid.[18] Nevertheless, the erroneous belief persists among the public and even meteorologists, aided by the misleading terms saturation pressure and supersaturation and the related definition of relative humidity.[18]
See also[edit]
- Absolute humidity
- Antoine equation
- Lee–Kesler method
- Osmotic coefficient
- Raoult’s law: vapor pressure lowering in solution
- Reid vapor pressure
- Relative humidity
- Relative volatility
- Saturation vapor density
- Triple point
- True vapor pressure
- Vapor–liquid equilibrium
- Vapor pressures of the elements (data page)
- Vapour pressure of water
References[edit]
- ^ Růžička, K.; Fulem, M. & Růžička, V. “Vapor Pressure of Organic Compounds. Measurement and Correlation” (PDF). Archived from the original (PDF) on 2010-12-26. Retrieved 2009-10-18.
- ^ a b What is the Antoine Equation? (Chemistry Department, Frostburg State University, Maryland)
- ^ a b Sinnot, R.K. (2005). Chemical Engineering Design] (4th ed.). Butterworth-Heinemann. p. 331. ISBN 978-0-7506-6538-4.
- ^ Wagner, W. (1973), “New vapour pressure measurements for argon and nitrogen and a new method for establishing rational vapour pressure equations”, Cryogenics, 13 (8): 470–482, Bibcode:1973Cryo…13..470W, doi:10.1016/0011-2275(73)90003-9
- ^ Perry’s Chemical Engineers’ Handbook, 7th Ed. pp. 4–15
- ^ Perry, R.H.; Green, D.W., eds. (1997). Perry’s Chemical Engineers’ Handbook (7th ed.). McGraw-Hill. ISBN 978-0-07-049841-9.
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F.Geoffrey (2002). General Chemistry (8th ed.). Prentice Hall. p. 484. ISBN 978-0-13-014329-7.
- ^ Dreisbach, R. R. & Spencer, R. S. (1949). “Infinite Points of Cox Chart Families and dt/dP Values at any Pressure”. Industrial and Engineering Chemistry. 41 (1): 176. doi:10.1021/ie50469a040.
- ^ a b Moller B.; Rarey J.; Ramjugernath D. (2008). “Estimation of the vapour pressure of non-electrolyte organic compounds via group contributions and group interactions”. Journal of Molecular Liquids. 143: 52–63. doi:10.1016/j.molliq.2008.04.020.
- ^ Krieger, Ulrich K.; Siegrist, Franziska; Marcolli, Claudia; Emanuelsson, Eva U.; Gøbel, Freya M.; Bilde, Merete (8 January 2018). “A reference data set for validating vapor pressure measurement techniques: homologous series of polyethylene glycols” (PDF). Atmospheric Measurement Techniques. Copernicus Publications. 11 (1): 49–63. Bibcode:2018AMT….11…49K. doi:10.5194/amt-11-49-2018. ISSN 1867-1381. S2CID 41910898. Archived (PDF) from the original on 2022-10-09. Retrieved 7 April 2022.
- ^ “Thermophysical Properties Of Fluids II – Methane, Ethane, Propane, Isobutane, And Normal Butane” Archived 2016-12-21 at the Wayback Machine (page 110 of PDF, page 686 of original document), BA Younglove and JF Ely.
- ^ “Thermophysical Properties Of Nitrous Oxide” (page 14 of PDF, page 10 of original document), ESDU.
- ^ Pankow, J. F.; et al. (2008). “SIMPOL.1: a simple group contribution method for predicting vapor pressures and enthalpies of vaporization of multifunctional organic compounds”. Atmos. Chem. Phys. 8 (10): 2773–2796. Bibcode:2008ACP…..8.2773P. doi:10.5194/acp-8-2773-2008.
- ^ “Vapour pressure of Pure Liquid Organic Compounds: Estimation by EVAPORATION”. Tropospheric Chemistry Modelling at BIRA-IASB. 11 June 2014. Retrieved 2018-11-26.
- ^ Compernolle, S.; et al. (2011). “EVAPORATION: a new vapour pressure estimation method for organic molecules including non-additivity and intramolecular interactions”. Atmos. Chem. Phys. 11 (18): 9431–9450. Bibcode:2011ACP….11.9431C. doi:10.5194/acp-11-9431-2011.
- ^ a b
American Meteorological Society (2012). “vapor pressure”. Glossary of Meteorology. Retrieved 2022-11-28. - ^ American Meteorological Society (2020). “saturation vapor pressure”. Glossary of Meteorology. Retrieved 2022-11-28.
- ^ a b c d e f
Babin, Steven M. (1998). “Relative Humidity & Saturation Vapor Pressure: A Brief Tutorial”. Johns Hopkins University Applied Physics Laboratory. Archived from the original on 1998-07-13. Retrieved 2022-11-28. (Alternate title: “Water Vapor Myths: A Brief Tutorial”.) - ^ a b American Meteorological Society (2012). “equilibrium vapor pressure”. Glossary of Meteorology. Retrieved 2022-11-28.
- ^ Raymond, David J. (2011-05-12). “Chapter 5: Cloud Microphysics” (PDF). Atmospheric Convection. New Mexico Institute of Mining and Technology. p. 73. Archived (PDF) from the original on 2017-03-29. Retrieved 2022-11-28.
External links[edit]
- Fluid Characteristics Chart, Engineer’s Edge
- Vapor Pressure, Hyperphysics
- Vapor Pressure, The MSDS HyperGlossary
- Online vapor pressure calculation tool (Requires Registration)
- Prediction of Vapor Pressures of Pure Liquid Organic Compounds
Давление. Единицы давления.
По рыхлому снегу человек идёт с большим трудом, глубоко проваливаясь при каждом шаге. Но, надев лыжи, он может идти, почти не проваливаясь в него. Почему? На лыжах или без лыж человек действует на снег с одной и той же силой, равной своему весу. Однако действие этой силы в обоих случаях различно, потому что различна площадь поверхности, на которую давит человек, с лыжами и без лыж. Площадь поверхности лыж почти в 20 раз больше площади подошвы. Поэтому, стоя на лыжах, человек действует на каждый квадратный сантиметр площади поверхности снега с силой, в 20 раз меньшей, чем стоя на снегу без лыж.
Ученик, прикалывая кнопками газету к доске, действует на каждую кнопку с одинаковой силой. Однако кнопка, имеющая более острый конец, легче входит в дерево.
Значит, результат действия силы зависит не только от её модуля, направления и точки приложения, но и от площади той поверхности, к которой она приложена (перпендикулярно которой она действует).
Этот вывод подтверждают физические опыты.
По углам небольшой доски надо вбить гвозди. Сначала гвозди, вбитые в доску, установим на песке остриями вверх и положим на доску гирю. В этом случае шляпки гвоздей лишь незначительно вдавливаются в песок. Затем доску перевернем и поставим гвозди на острие. В этом случае площадь опоры меньше, и под действием той же силы гвозди значительно углубляются в песок.
От того, какая сила действует на каждую единицу площади поверхности, зависит результат действия этой силы.
В рассмотренных примерах силы действовали перпендикулярно поверхности тела. Вес человека был перпендикулярен поверхности снега; сила, действовавшая на кнопку, перпендикулярна поверхности доски.
Величина, равная отношению силы, действующей перпендикулярно поверхности, к площади этой поверхности, называется давлением.
Чтобы определить давление, надо силу, действующую перпендикулярно поверхности, разделить на площадь поверхности:
давление = сила / площадь.
Обозначим величины, входящие в это выражение: давление – p, сила, действующая на поверхность, – F и площадь поверхности – S.
Тогда получим формулу:
p = F/S
Понятно, что бóльшая по значению сила, действующую на ту же площадь, будет производить большее давление.
За единицу давления принимается такое давление, которое производит сила в 1 Н, действующая на поверхность площадью 1 м2 перпендикулярно этой поверхности.
Единица давления – ньютон на квадратный метр ( 1 Н / м2 ). В честь французского ученого Блеза Паскаля она называется паскалем (Па). Таким образом,
1 Па = 1 Н / м2 .
Используется также другие единицы давления: гектопаскаль (гПа) и килопаскаль (кПа).
1 кПа = 1000 Па;
1 гПа = 100 Па;
1 Па = 0,001 кПа;
1 Па = 0,01 гПа.
Пример. Рассчитать давление, производимое на пол мальчиком, масса которого 45 кг, а площадь подошв его ботинок, соприкасающихся с полом, равна 300 см2.
Запишем условие задачи и решим её.
Дано: m = 45 кг, S = 300 см2; p = ?
В единицах СИ: S = 0,03 м2
Решение:
p = F/S,
F = P,
P = g·m,
P = 9,8 Н · 45 кг ≈ 450 Н,
p = 450/0,03 Н / м2 = 15000 Па = 15 кПа
‘Ответ’: p = 15000 Па = 15 кПа
Способы уменьшения и увеличения давления.
Тяжелый гусеничный трактор производит на почву давление равное 40 – 50 кПа, т. е. всего в 2 – 3 раза больше, чем давление мальчика массой 45 кг. Это объясняется тем, что вес трактора распределяется на бóльшую площадь за счёт гусеничной передачи. А мы установили, что чем больше площадь опоры, тем меньше давление, производимое одной и той же силой на эту опору.
В зависимости от того, нужно ли получить малое или большое давление, площадь опоры увеличивается или уменьшается. Например, для того, чтобы грунт мог выдержать давление возводимого здания, увеличивают площадь нижней части фундамента.
Шины грузовых автомобилей и шасси самолетов делают значительно шире, чем легковых. Особенно широкими делают шины у автомобилей, предназначенных для передвижения в пустынях.
Тяжелые машины, как трактор, танк или болотоход, имея большую опорную площадь гусениц, проходят по болотистой местности, по которой не пройдет человек.
С другой стороны, при малой площади поверхности можно небольшой силой произвести большое давление. Например, вдавливая кнопку в доску, мы действуем на нее с силой около 50 Н. Так как площадь острия кнопки примерно 1 мм2, то давление, производимое ею, равно:
p = 50 Н/ 0, 000 001 м2 = 50 000 000 Па = 50 000 кПа.
Для сравнения, это давление в 1000 раз больше давления, производимого гусеничным трактором на почву. Можно найти еще много таких примеров.
Лезвие режущих и острие колющих инструментов (ножей, ножниц, резцов, пил, игл и др.) специально остро оттачивается. Заточенный край острого лезвия имеет маленькую площадь, поэтому при помощи даже малой силы создается большое давление, и таким инструментом легко работать.
Режущие и колющие приспособления встречаются и в живой природе: это зубы, когти, клювы, шипы и др. – все они из твердого материала, гладкие и очень острые.
Давление
Мы уже знаем, что газы, в отличие от твердых тел и жидкостей, заполняют весь сосуд, в котором находятся. Например, стальной баллон для хранения газов, камера автомобильной шины или волейбольный мяч. При этом газ оказывает давление на стенки, дно и крышку баллона, камеры или любого другого тела, в котором он находится. Давление газа обусловлено иными причинами, чем давление твердого тела на опору.
Известно, что молекулы газа беспорядочно движутся. При своем движении они сталкиваются друг с другом, а также со стенками сосуда, в котором находится газ. Молекул в газе много, поэтому и число их ударов очень велико. Например, число ударов молекул воздуха, находящегося в комнате, о поверхность площадью 1 см2 за 1 с выражается двадцатитрехзначным числом. Хотя сила удара отдельной молекулы мала, но действие всех молекул на стенки сосуда значительно, — оно и создает давление газа.
Итак, давление газа на стенки сосуда (и на помещенное в газ тело) вызывается ударами молекул газа.
Рассмотрим следующий опыт. Под колокол воздушного насоса поместим резиновый шарик. Он содержит небольшое количество воздуха и имеет неправильную форму. Затем насосом откачиваем воздух из-под колокола. Оболочка шарика, вокруг которой воздух становится все более разреженным, постепенно раздувается и принимает форму правильного шара.
Как объяснить этот опыт?
В нашем опыте движущиеся молекулы газа непрерывно ударяют о стенки шарика внутри и снаружи. При откачивании воздуха число молекул в колоколе вокруг оболочки шарика уменьшается. Но внутри шарика их число не изменяется. Поэтому число ударов молекул о внешние стенки оболочки становится меньше, чем число ударов о внутренние стенки. Шарик раздувается до тех пор, пока сила упругости его резиновой оболочки не станет равной силе давления газа. Оболочка шарика принимает форму шара. Это показывает, что газ давит на ее стенки по всем направлениям одинаково. Иначе говоря, число ударов молекул, приходящихся на каждый квадратный сантиметр площади поверхности, по всем направлениям одинаково. Одинаковое давление по всем направлениям характерно для газа и является следствием беспорядочного движения огромного числа молекул.
Попытаемся уменьшить объем газа, но так, чтобы масса его осталась неизменной. Это значит, что в каждом кубическом сантиметре газа молекул станет больше, плотность газа увеличится. Тогда число ударов молекул о стенки увеличится, т. е. возрастет давление газа. Это можно подтвердить опытом.
На рисунке а изображена стеклянная трубка, один конец которой закрыт тонкой резиновой пленкой. В трубку вставлен поршень. При вдвигании поршня объем воздуха в трубке уменьшается, т. е. газ сжимается. Резиновая пленка при этом выгибается наружу, указывая на то, что давление воздуха в трубке увеличилось.
Наоборот, при увеличении объема этой же массы газа, число молекул в каждом кубическом сантиметре уменьшается. От этого уменьшится число ударов о стенки сосуда – давление газа станет меньше. Действительно, при вытягивании поршня из трубки объем воздуха увеличивается, пленка прогибается внутрь сосуда. Это указывает на уменьшение давления воздуха в трубке. Такие же явления наблюдались бы, если бы вместо воздуха в трубке находился бы любой другой газ.
Итак, при уменьшении объема газа его давление увеличивается, а при увеличении объема давление уменьшается при условии, что масса и температура газа остаются неизменными.
А как изменится давление газа, если нагреть его при постоянном объеме? Известно, что скорость движения молекул газа при нагревании увеличивается. Двигаясь быстрее, молекулы будут ударять о стенки сосуда чаще. Кроме того, каждый удар молекулы о стенку будет сильнее. Вследствие этого, стенки сосуда будут испытывать большее давление.
Следовательно, давление газа в закрытом сосуде тем больше, чем выше температура газа, при условии, что масса газа и объем не изменяются.
Из этих опытов можно сделать общий вывод, что давление газа тем больше, чем чаще и сильнее молекулы ударяют о стенки сосуда.
Для хранения и перевозки газов их сильно сжимают. При этом давление их возрастает, газы необходимо заключать в специальные, очень прочные баллоны. В таких баллонах, например, содержат сжатый воздух в подводных лодках, кислород, используемый при сварке металлов. Конечно же, мы должны навсегда запомнить, что газовые баллоны нельзя нагревать, тем более, когда они заполнены газом. Потому что, как мы уже понимаем, может произойти взрыв с очень неприятными последствиями.
Закон Паскаля.
В отличие от твердых тел отдельные слои и мелкие частицы жидкости и газа могут свободно перемещаться относительно друг друга по всем направлениям. Достаточно, например, слегка подуть на поверхность воды в стакане, чтобы вызвать движение воды. На реке или озере при малейшем ветерке появляется рябь.
Подвижностью частиц газа и жидкости объясняется, что давление, производимое на них, передается не только в направлении действия силы, а в каждую точку. Рассмотрим это явление подробнее.
На рисунке, а изображен сосуд, в котором содержится газ (или жидкость). Частицы равномерно распределены по всему сосуду. Сосуд закрыт поршнем, который может перемещаться вверх и вниз.
Прилагая некоторую силу, заставим поршень немного переместиться внутрь и сжать газ (жидкость), находящийся непосредственно под ним. Тогда частицы (молекулы) расположатся в этом месте более плотно, чем прежде(рис, б). Благодаря подвижности частицы газа будут перемещаться по всем направлениям. Вследствие этого их расположение опять станет равномерным, но более плотным, чем раньше (рис, в). Поэтому давление газа всюду возрастет. Значит, добавочное давление передается всем частицам газа или жидкости. Так, если давление на газ (жидкость) около самого поршня увеличится на 1 Па, то во всех точках внутри газа или жидкости давление станет больше прежнего на столько же. На 1 Па увеличится давление и на стенки сосуда, и на дно, и на поршень.
Давление, производимое на жидкость или газ, передается на любую точку одинаково во всех направлениях.
Это утверждение называется законом Паскаля.
На основе закона Паскаля легко объяснить следующие опыты.
На рисунке изображен полый шар, имеющий в различных местах небольшие отверстия. К шару присоединена трубка, в которую вставлен поршень. Если набрать воды в шар и вдвинуть в трубку поршень, то вода польется из всех отверстий шара. В этом опыте поршень давит на поверхность воды в трубке. Частицы воды, находящиеся под поршнем, уплотняясь, передают его давление другим слоям, лежащим глубже. Таким образом, давление поршня передается в каждую точку жидкости, заполняющей шар. В результате часть воды выталкивается из шара в виде одинаковых струек, вытекающих из всех отверстий.
Если шар заполнить дымом, то при вдвигании поршня в трубку из всех отверстий шара начнут выходить одинаковые струйки дыма. Это подтверждает, что и газы передают производимое на них давление во все стороны одинаково.
Давление в жидкости и газе.
На жидкости, как и на все тела на Земле, действует сила тяжести. Поэтому, каждый слой жидкости, налитой в сосуд, своим весом создает давление, которое по закону Паскаля передается по всем направлениям. Следовательно, внутри жидкости существует давление. В этом можно убедиться на опыте.
В стеклянную трубку, нижнее отверстие которой закрыто тонкой резиновой пленкой, нальем воду. Под действием веса жидкости дно трубки прогнется.
Опыт показывает, что, чем выше столб воды над резиновой пленкой, тем больше она прогибается. Но всякий раз после того, как резиновое дно прогнулось, вода в трубке приходит в равновесие (останавливается), так как, кроме силы тяжести, на воду действует сила упругости растянутой резиновой пленки.
Опустим трубку с резиновым дном, в которую налита вода, в другой, более широкий сосуд с водой. Мы увидим, что по мере опускания трубки резиновая пленка постепенно выпрямляется. Полное выпрямление пленки показывает, что силы, действующие на нее сверху и снизу, равны. Наступает полное выпрямление пленки тогда, когда уровни воды в трубке и сосуде совпадают.
Такой же опыт можно провести с трубкой, в которой резиновая пленка закрывает боковое отверстие, как это показано на рисунке, а. Погрузим эту трубку с водой в другой сосуд с водой, как это изображено на рисунке, б. Мы заметим, что пленка снова выпрямится, как только уровни воды в трубке и сосуде сравняются. Это означает, что силы, действующие на резиновую пленку, одинаковы со всех сторон.
Возьмем сосуд, дно которого может отпадать. Опустим его в банку с водой. Дно при этом окажется плотно прижатым к краю сосуда и не отпадет. Его прижимает сила давления воды, направленная снизу вверх.
Будем осторожно наливать воду в сосуд и следить за его дном. Как только уровень воды в сосуде совпадет с уровнем воды в банке, оно отпадет от сосуда.
В момент отрыва на дно давит сверху вниз столб жидкости в сосуде, а снизу вверх на дно передается давление такого же по высоте столба жидкости, но находящейся в банке. Оба эти давления одинаковы, дно же отходит от цилиндра вследствие действия на него собственной силы тяжести.
Выше были описаны опыты с водой, но если взять вместо воды любую другую жидкость, результаты опыта будут те же.
Итак, опыты показывают, что внутри жидкости существует давление, и на одном и том же уровне оно одинаково по всем направлениям. С глубиной давление увеличивается.
Газы в этом отношении не отличаются от жидкостей, ведь они тоже имеют вес. Но надо помнить, что плотность газа в сотни раз меньше плотности жидкости. Вес газа, находящегося в сосуде, мал, и его “весовое” давление во многих случаях можно не учитывать.
Расчет давления жидкости на дно и стенки сосуда.
Рассмотрим, как можно рассчитывать давление жидкости на дно и стенки сосуда. Решим сначала задачу для сосуда, имеющего форму прямоугольного параллелепипеда.
Сила F, с которой жидкость, налитая в этот сосуд, давит на его дно, равна весу P жидкости, находящейся в сосуде. Вес жидкости можно определить, зная ее массу m. Массу, как известно, можно вычислить по формуле: m = ρ·V. Объем жидкости, налитой в выбранный нами сосуд, легко рассчитать. Если высоту столба жидкости, находящейся в сосуде, обозначить буквой h, а площадь дна сосуда S, то V = S·h.
Масса жидкости m = ρ·V, или m = ρ·S·h .
Вес этой жидкости P = g·m, или P = g·ρ·S·h.
Так как вес столба жидкости равен силе, с которой жидкость давит на дно сосуда, то, разделив вес P на площадь S, получим давление жидкости p:
p = P/S , или p = g·ρ·S·h/S,
то есть
p = g·ρ·h.
Мы получили формулу для расчета давления жидкости на дно сосуда. Из этой формулы видно, что давление жидкости на дно сосуда зависит только от плотности и высоты столба жидкости.
Следовательно, по выведенной формуле можно рассчитывать давление жидкости, налитой в сосуд любой формы (строго говоря, наш расчет годится только для сосудов, имеющих форму прямой призмы и цилиндра. В курсах физики для института доказано, что формула верна и для сосуда произвольной формы). Кроме того, по ней можно вычислить и давление на стенки сосуда. Давление внутри жидкости, в том числе давление снизу вверх, также рассчитывается по этой формуле, так как давление на одной и той же глубине одинаково по всем направлениям.
При расчете давления по формуле p = gρh надо плотность ρ выражать в килограммах на кубический метр (кг/м3), а высоту столба жидкости h – в метрах (м), g = 9,8 Н/кг, тогда давление будет выражено в паскалях (Па).
Пример. Определите давление нефти на дно цистерны, если высота столба нефти 10 м, а плотность ее 800 кг/м3 .
Запишем условие задачи и запишем ее.
Дано:
h = 10 м
ρ = 800 кг/м3
P = ?
Решение:
p = gρh,
p = 9.8 Н/кг · 800 кг/м3 · 10 м ≈ 80 000 Па ≈ 80 кПа.
Ответ: p ≈ 80 кПа.
Сообщающиеся сосуды.
На рисунке изображены два сосуда, соединённые между собой резиновой трубкой. Такие сосуды называются сообщающимися. Лейка, чайник, кофейник – примеры сообщающихся сосудов. Из опыта мы знаем, что вода, налитая, например, в лейку, стоит всегда на одном уровне в носике и внутри.
С сообщающимися сосудами можно проделать следующий простой опыт. В начале опыта резиновую трубку зажимаем в середине, и в одну из трубок наливаем воду. Затем зажим открываем, и вода вмиг перетекает в другую трубку, пока поверхности воды в обеих трубках не установятся на одном уровне. Можно закрепить одну из трубок в штативе, а другую поднимать, опускать или наклонять в разные стороны. И в этом случае, как только жидкость успокоится, ее уровни в обеих трубках уравняются.
В сообщающихся сосудах любой формы и сечения поверхности однородной жидкости устанавливаются на одном уровне (при условии, что давление воздуха над жидкостью одинаково) (рис. 109).
Это можно обосновать следующим образом. Жидкость покоится, не перемещаясь из одного сосуда в другой. Значит, давления в обоих сосудах на любом уровне одинаковы. Жидкость в обоих сосудах одна и та же, т. е. имеет одинаковую плотность. Следовательно, должны быть одинаковы и ее высоты. Когда мы поднимаем один сосуд или доливаем в него жидкость, давление в нем увеличивается и жидкость перемещается в другой сосуд до тех пор, пока давления не уравновесятся.
Если в один из сообщающихся сосудов налить жидкость одной плотности, а во второй – другой плотности, то при равновесии уровни этих жидкостей не будут одинаковыми. И это понятно. Мы ведь знаем, что давление жидкости на дно сосуда прямо пропорционально высоте столба и плотности жидкости. А в этом случае плотности жидкостей будут различны.
При равенстве давлений высота столба жидкости с большей плотностью будет меньше высоты столба жидкости с меньшей плотностью (рис.).
Вес воздуха. Атмосферное давление.
На воздух, как и на всякое тело, находящееся на Земле, действует сила тяжести, и, значит, воздух обладает весом. Вес воздуха легко вычислить, зная его массу.
На опыте покажем, как вычислить массу воздуха. Для этого нужно взять прочный стеклянный шар с пробкой и резиновой трубкой с зажимом. Выкачаем из него насосом воздух, зажмем трубку зажимом и уравновесим на весах. Затем, открыв зажим на резиновой трубке, впустим в него воздух. Равновесие весов при этом нарушится. Для его восстановления на другую чашку весов придется положить гири, масса которых будет равна массе воздуха в объеме шара.
Опытами установлено, что при температуре 0 °С и нормальном атмосферном давлении масса воздуха объемом 1 м3 равна 1,29 кг. Вес этого воздуха легко вычислить:
P = g·m, P = 9,8 Н/кг · 1,29 кг ≈ 13 Н.
Воздушная оболочка, окружающая Землю, называется атмосфера (от греч. атмос – пар, воздух, и сфера – шар).
Атмосфера, как показали наблюдения за полетом искусственных спутников Земли, простирается на высоту нескольких тысяч километров.
Вследствие действия силы тяжести верхние слои атмосферы, подобно воде океана, сжимают нижние слои. Воздушный слой, прилегающий непосредственно к Земле, сжат больше всего и, согласно закону Паскаля, передает производимое на него давление по всем направлениям.
В результате этого земная поверхность и телá, находящиеся на ней, испытывают давление всей толщи воздуха, или, как обычно говорится в таких случаях, испытывают атмосферное давление.
Существованием атмосферного давления могут быть объяснены многие явления, с которыми мы встречаемся в жизни. Рассмотрим некоторые из них.
На рисунке изображена стеклянная трубка, внутри которой находится поршень, плотно прилегающий к стенкам трубки. Конец трубки опущен воду. Если поднимать поршень, то за ним будет подниматься и вода.
Это явление используется в водяных насосах и некоторых других устройствах.
На рисунке показан цилиндрический сосуд. Он закрыт пробкой, в которую вставлена трубка с краном. Из сосуда насосом откачивается воздух. Затем конец трубки помещается в воду. Если теперь открыть кран, то вода фонтаном брызнет в внутрь сосуда. Вода поступает в сосуд потому, что атмосферное давление больше давления разреженного воздуха в сосуде.
Почему существует воздушная оболочка Земли.
Как и все тела, молекулы газов, входящих в состав воздушной оболочки Земли, притягиваются к Земле.
Но почему же тогда все они не упадут на поверхность Земли? Каким образом сохраняется воздушная оболочка Земли, ее атмосфера? Чтобы понять это, надо учесть, что молекулы газов находятся в непрерывном и беспорядочном движении. Но тогда возникает другой вопрос: почему эти молекулы не улетают в мировое пространство, то есть в космос.
Для того, чтобы совсем покинуть Землю, молекула, как и космический корабль или ракета, должна иметь очень большую скорость (не меньше 11,2 км/с). Это так называемая вторая космическая скорость. Скорость большинства молекул воздушной оболочки Земли значительно меньше этой космической скорости. Поэтому большинство их привязано к Земле силой тяжести, лишь ничтожно малое количество молекул улетает за пределы Земли в космос.
Беспорядочное движение молекул и действие на них силы тяжести приводят в результате к тому, что молекулы газов “парят” в пространстве около Земли, образуя воздушную оболочку, или известную нам атмосферу.
Измерения показывают, что плотность воздуха быстро уменьшается с высотой. Так, на высоте 5,5 км над Землей плотность воздуха в 2 раза меньше его плотность у поверхности Земли, на высоте 11 км – в 4 раза меньше, и т. д. Чем выше, тем воздух разреженнее. И наконец, в самых верхних слоях (сотни и тысячи километров над Землей) атмосфера постепенно переходит в безвоздушное пространство. Четкой границы воздушная оболочка Земли не имеет.
Строго говоря, вследствие действия силы тяжести плотность газа в любом закрытом сосуде неодинакова по всему объему сосуда. Внизу сосуда плотность газа больше, чем в верхних его частях, поэтому и давление в сосуде неодинаково. На дне сосуда оно больше, чем вверху.
Однако для газа, содержащегося в сосуде, это различие в плотности и давлении столь мало, что его можно во многих случаях совсем не учитывать, просто знать об этом. Но для атмосферы, простирающейся на несколько тысяч километров, различие это существенно.
Измерение атмосферного давления. Опыт Торричелли.
Рассчитать атмосферное давление по формуле для вычисления давления столба жидкости (§ 38) нельзя. Для такого расчета надо знать высоту атмосферы и плотность воздуха. Но определенной границы у атмосферы нет, а плотность воздуха на разной высоте различна. Однако измерить атмосферное давление можно с помощью опыта, предложенного в 17 веке итальянским ученым Эванджелиста Торричелли, учеником Галилея.
Опыт Торричелли состоит в следующем: стеклянную трубку длиной около 1 м, запаянную с одного конца, наполняют ртутью. Затем, плотно закрыв второй конец трубки, ее переворачивают и опускают в чашку с ртутью, где под уровнем ртути открывают этот конец трубки. Как и в любом опыте с жидкостью, часть ртути при этом выливается в чашку, а часть ее остается в трубке. Высота столба ртути, оставшейся в трубке, равна примерно 760 мм. Над ртутью внутри трубки воздуха нет, там безвоздушное пространство, поэтому никакой газ не оказывает давления сверху на столб ртути внутри этой трубки и не влияет на измерения.
Торричелли, предложивший описанный выше опыт, дал и его объяснение. Атмосфера давит на поверхность ртути в чашке. Ртуть находится в равновесии. Значит, давление в трубке на уровне аа1 (см. рис) равно атмосферному давлению. При изменении атмосферного давления меняется и высота столба ртути в трубке. При увеличении давления столбик удлиняется. При уменьшении давления — столб ртути уменьшает свою высоту.
Давление в трубке на уровне аа1 создается весом столба ртути в трубке, так как в верхней части трубки над ртутью воздуха нет. Отсюда следует, что атмосферное давление равно давлению столба ртути в трубке, т. е.
pатм = pртути .
Измерив высоту столба ртути, можно рассчитать давление, которое производит ртуть. Оно и будет равно атмосферному давлению. Если атмосферное давление уменьшится, то столб ртути в трубке Торричелли понизится.
Чем больше атмосферное давление, тем выше столб ртути в опыте Торричелли. Поэтому на практике атмосферное давление можно измерить высотой ртутного столба (в миллиметрах или сантиметрах). Если, например, атмосферное давление равно 780 мм рт. ст. (говорят “миллиметров ртутного столба”), то это значит, что воздух производит такое же давление, какое производит вертикальный столб ртути высотой 780 мм.
Следовательно, в этом случае за единицу измерения атмосферного давления принимается 1 миллиметр ртутного столба (1 мм рт. ст.). Найдем соотношение между этой единицей и известной нам единицей – паскалем (Па).
Давление столба ртути ρртути высотой 1 мм равно:
p = g·ρ·h, p = 9,8 Н/кг · 13 600 кг/ м3 · 0,001 м ≈ 133,3 Па.
Итак, 1 мм рт. ст. = 133,3 Па.
В настоящее время атмосферное давление принято измерять в гектопаскалях ( 1 гПа = 100 Па). Например, в сводках погоды может быть объявлено, что давление равно 1013 гПа, это то же самое, что 760 мм рт. ст.
Наблюдая ежедневно за высотой ртутного столба в трубке, Торричелли обнаружил, что эта высота меняется, т. е. атмосферное давление непостоянно, оно может увеличиваться и уменьшаться. Торричелли заметил также, что атмосферное давление связано с изменением погоды.
Если к трубке с ртутью, использовавшейся в опыте Торричелли, прикрепить вертикальную шкалу, то получится простейший прибор – ртутный барометр (от греч. барос – тяжесть, метрео – измеряю). Он служит для измерения атмосферного давления.
Барометр – анероид.
В практике для измерения атмосферного давления используют металлический барометр, называемый анероидом (в переводе с греческого – безжидкостный). Так барометр называют потому, что в нем нет ртути.
Внешний вид анероида изображен на рисунке. Главная часть его – металлическая коробочка 1 с волнистой (гофрированной) поверхностью (см. др. рис.). Из этой коробочки выкачан воздух, а чтобы атмосферное давление не раздавило коробочку, ее крышка 2 пружиной оттягивается вверх. При увеличении атмосферного давления крышка прогибается вниз и натягивает пружину. При уменьшении давления пружина выпрямляет крышку. К пружине с помощью передаточного механизма 3 прикреплена стрелка-указатель 4, которая продвигается вправо или влево при изменении давления. Под стрелкой укреплена шкала, деления которой нанесены по показаниям ртутного барометра. Так, число 750, против которого стоит стрелка анероида (см. рис.), показывает, что в данный момент в ртутном барометре высота ртутного столба 750 мм.
Следовательно, атмосферное давление равно 750 мм рт. ст. или ≈ 1000 гПа.
Значение атмосферного давления весьма важно для предвидения погоды на ближайшие дни, так как изменение атмосферного давления связано с изменением погоды. Барометр – необходимый прибор для метеорологических наблюдений.
Атмосферное давление на различных высотах.
В жидкости давление, как мы знаем, зависит от плотности жидкости и высоты ее столба. Вследствие малой сжимаемости плотность жидкости на различных глубинах почти одинакова. Поэтому, вычисляя давление, мы считаем ее плотность постоянной и учитываем только изменение высоты.
Сложнее дело обстоит с газами. Газы сильно сжимаемы. А чем сильнее газ сжат, тем больше его плотность, и тем большее давление он производит. Ведь давление газа создается ударами его молекул о поверхность тела.
Слои воздуха у поверхности Земли сжаты всеми вышележащими слоями воздуха, находящимися над ними. Но чем выше от поверхности слой воздуха, тем слабее он сжат, тем меньше его плотность. Следовательно, тем меньшее давление он производит. Если, например, воздушный шар поднимается над поверхностью Земли, то давление воздуха на шар становиться меньше. Это происходит не только потому, что высота столба воздуха над ним уменьшается, но еще и потому, что уменьшается плотность воздуха. Вверху она меньше, чем внизу. Поэтому зависимость давления воздуха от высоты сложнее, чем жидкости.
Наблюдения показывают, что атмосферное давление в местностях, лежащих на уровне моря, в среднем равно 760 мм рт. ст.
Атмосферное давление, равное давлению столба ртути высотой 760 мм при температуре 0 °С, называется нормальным атмосферным давлением.
Нормальное атмосферное давление равно 101 300 Па = 1013 гПа.
Чем больше высота над уровнем моря, тем давление меньше.
При небольших подъемах, в среднем, на каждые 12 м подъема давление уменьшается на 1 мм рт. ст. (или на 1,33 гПа).
Зная зависимость давления от высоты, можно по изменению показаний барометра определить высоту над уровнем моря. Анероиды, имеющие шкалу, по которой непосредственно можно измерить высоту над уровнем моря, называются высотомерами. Их применяют в авиации и при подъеме на горы.
Манометры.
Мы уже знаем, что для измерения атмосферного давления применяют барометры. Для измерения давлений, бóльших или меньших атмосферного, используется манометры (от греч. манос – редкий, неплотный, метрео – измеряю). Манометры бывают жидкостные и металлические.
Рассмотрим сначала устройство и действие открытого жидкостного манометра. Он состоит из двухколенной стеклянной трубки, в которую наливается какая-нибудь жидкость. Жидкость устанавливается в обоих коленах на одном уровне, так как на ее поверхность в коленах сосуда действует только атмосферное давление.
Чтобы понять, как работает такой манометр, его можно соединить резиновой трубкой с круглой плоской коробкой, одна сторона которой затянута резиновой пленкой. Если надавить пальцем на пленку, то уровень жидкости в колене манометра, соединенном в коробкой, понизится, а в другом колене повысится. Чем это объясняется?
При надавливании на пленку увеличивается давление воздуха в коробке. По закону Паскаля это увеличение давления передается и жидкости в том колене манометра, которое присоединено к коробке. Поэтому давление на жидкость в этом колене будет больше, чем в другом, где на жидкость действует только атмосферное давление. Под действием силы этого избыточного давления жидкость начнет перемещаться. В колене со сжатым воздухом жидкость опустится, в другом – поднимется. Жидкость придет в равновесие (остановится), когда избыточное давление сжатого воздуха уравновесится давлением, которое производит избыточный столб жидкости в другом колене манометра.
Чем сильнее давить на пленку, тем выше избыточный столб жидкости, тем больше его давление. Следовательно, об изменении давления можно судить по высоте этого избыточного столба.
На рисунке показано, как таким манометром можно измерять давление внутри жидкости. Чем глубже погружается в жидкость трубочка, тем больше становится разность высот столбов жидкости в коленах манометра, тем, следовательно, и большее давление производит жидкость.
Если установить коробочку прибора на какой-нибудь глубине внутри жидкости и поворачивать ее пленкой вверх, вбок и вниз, то показания манометра при этом не будут меняется. Так и должно быть, ведь на одном и том же уровне внутри жидкости давление одинаково по всем направлениям.
На рисунке изображен металлический манометр. Основная часть такого манометра – согнутая в трубу металлическая трубка 1, один конец которой закрыт. Другой конец трубки с помощью крана 4 сообщается с сосудом, в котором измеряют давление. При увеличении давления трубка разгибается. Движение её закрытого конца при помощи рычага 5 и зубчатки 3 передается стрелке 2, движущейся около шкалы прибора. При уменьшении давления трубка, благодаря своей упругости, возвращается в прежнее положение, а стрелка – к нулевому делению шкалы.
Поршневой жидкостный насос.
В опыте, рассмотренном нами ранее (§ 40), было установлено, что вода в стеклянной трубке под действием атмосферного давления поднималась вверх за поршнем. На этом основано действие поршневых насосов.
Насос схематически изображен на рисунке. Он состоит из цилиндра, внутри которого ходит вверх и вниз, плотно прилегая к стенкам сосуда, поршень 1. В нижней части цилиндра и в самом поршне установлены клапаны 2, открывающиеся только вверх. При движении поршня вверх вода под действием атмосферного давления входит в трубу, поднимает нижний клапан и движется за поршнем.
При движении поршня вниз вода, находящаяся под поршнем, давит на нижний клапан, и он закрывается. Одновременно под давлением воды открывается клапан внутри поршня, и вода переходит в пространство над поршнем. При следующем движении поршня вверх в месте с ним поднимается и находящаяся над ним вода, которая и выливается в отводящую трубу. Одновременно за поршнем поднимается и новая порция воды, которая при последующем опускании поршня окажется над ним, и вся эта процедура повторяется вновь и вновь, пока работает насос.
Гидравлический пресс.
Закон Паскаля позволяет объяснить действие гидравлической машины (от греч. гидравликос – водяной). Это машины, действие которых основано на законах движения и равновесия жидкостей.
Основной частью гидравлической машины служат два цилиндра разного диаметра, снабженные поршнями и соединительной трубкой. Пространство под поршнями и трубку заполняют жидкостью (обычно минеральным маслом). Высоты столбов жидкости в обоих цилиндрах одинаковы, пока на поршни не действуют силы.
Допустим теперь, что силы F1 и F2 – силы, действующие на поршни, S1 и S2 – площади поршней. Давление под первым (малым) поршнем равно p1 = F1 / S1, а под вторым (большим) p2 = F2 / S2 . По закону Паскаля давление покоящейся жидкостью во все стороны передается одинаково, т. е. p1 = p2 или F1 / S1 = F2 / S2 , откуда:
F2 / F1 = S2 / S1 .
Следовательно, сила F2 во столько раз больше силы F1 , во сколько раз площадь большого поршня больше площади малого поршня. Например, если площадь большого поршня 500 см2, а малого 5 см2, и на малый поршень действует сила 100 Н, то на больший поршень будет действовать сила, в 100 раз бóльшая, то есть 10 000 Н.
Таким образом, с помощью гидравлической машины можно малой силой уравновесить бóльшую силу.
Отношение F1 / F2 показывает выигрыш в силе. Например, в приведенном примере выигрыш в силе равен 10 000 Н / 100 Н = 100.
Гидравлическая машина, служащая для прессования (сдавливания), называется гидравлическим прессом.
Гидравлические прессы применяются там, где требуется большая сила. Например, для выжимания масла из семян на маслобойных заводах, для прессования фанеры, картона, сена. На металлургических заводах гидравлические прессы используют для изготовления стальных валов машин, железнодорожных колес и многих других изделий. Современные гидравлические прессы могут развивать силу в десятки и сотни миллионов ньютонов.
Устройство гидравлического пресса схематически показано на рисунке. Прессуемое тело 1 (A) кладут на платформу, соединенную с большим поршнем 2 (B). При помощи малого поршня 3 (D) создается большое давление на жидкость. Это давление передается в каждую точку жидкости, заполняющей цилиндры. Поэтому такое же давление действует и на второй, большой поршень. Но так как площадь 2-го (большого) поршня больше площади малого, то и сила, действующая на него, будет больше силы, действующей на поршень 3 (D). Под действием этой силы поршень 2 (B) будет подниматься. При подъеме поршня 2 (B) тело (A) упирается в неподвижную верхнюю платформу и сжимается. При помощи манометра 4 (M) измеряется давление жидкости. Предохранительный клапан 5 (P) автоматически открывается, когда давление жидкости превышает допустимое значение.
Из малого цилиндра в большой жидкость перекачивается повторными движениями малого поршня 3 (D). Это осуществляется следующим образом. При подъеме малого поршня (D) клапан 6 (K) открывается, и в пространство, находящееся под поршнем, засасывается жидкость. При опускании малого поршня под действием давления жидкости клапан 6 (K) закрывается, а клапан 7 (K’) открывается, и жидкость переходит в большой сосуд.
Действие воды и газа на погруженное в них тело.
Под водой мы легко можем поднять камень, который с трудом поднимается в воздухе. Если погрузить пробку под воду и выпустить ее из рук, то она всплывет. Как можно объяснить эти явления?
Мы знаем (§ 38), что жидкость давит на дно и стенки сосуда. И если внутрь жидкости поместить какое-нибудь твердое тело, то оно также будет подвергаться давлению, как и стенки сосуда.
Рассмотрим силы, которые действуют со стороны жидкости на погруженное в нее тело. Чтобы легче было рассуждать, выберем тело, которое имеет форму параллелепипеда с основаниями, параллельными поверхности жидкости (рис.). Силы, действующие на боковые грани тела, попарно равны и уравновешивают друг друга. Под действием этих сил тело сжимается. А вот силы, действующие на верхнюю и нижнюю грани тела, неодинаковы. На верхнюю грань давит сверху силой F1 столб жидкости высотой h1 . На уровне нижней грани давление производит столб жидкости высотой h2. Это давление, как мы знаем (§ 37), передается внутри жидкости во все стороны. Следовательно, на нижнюю грань тела снизу вверх с силой F2 давит столб жидкости высотой h2. Но h2 больше h1, следовательно, и модуль силы F2 больше модуля силы F1. Поэтому тело выталкивается из жидкости с силой Fвыт, равной разности сил F2 – F1 , т. е.
Fвыт = F2– F1
Рассчитаем эту выталкивающую силу. Силы F1 и F2 , действующие на верхнюю и нижнюю грани параллелепипеда, можно вычислить, зная площади этих граней (S1 и S2) и давление жидкости на уровнях этих граней (p1 и p2):
F1 = p1·S1, а F2 = p2·S2, так как p1 = ρж·g·h1 , p2 = ρж·g·h2 , а S1 = S2 = S, где S – площадь грани параллелепипеда (все грани равны).
Тогда, Fвыт = F2 – F1 = ρ·g·h2·S – ρ·g·h1·S = ρ·g·S·(h2 – h1) = ρ·g·S·h, где h – высота параллелепипеда (h = h2 – h1).
Но S·h = V, где V – объем параллелепипеда, а ρж·V = mж – масса жидкости в объеме параллелепипеда. Следовательно,
Fвыт = g·mж = Pж ,
т. е. выталкивающая сила равна весу жидкости в объеме погруженного в нее тела (выталкивающая сила равна весу жидкости такого же объёма, как и объём погруженного в нее тела).
Существование силы, выталкивающей тело из жидкости, легко обнаружить на опыте.
На рисунке а изображено тело, подвешенное к пружине со стрелкой-указателем на конце. Стрелка отмечает на штативе растяжение пружины. При отпускании тела в воду пружина сокращается (рис., б). Такое же сокращение пружины получится, если действовать на тело снизу вверх с некоторой силой, например, нажать рукой (приподнять).
Следовательно, опыт подтверждает, что на тело, находящееся в жидкости, действует сила, выталкивающая это тело из жидкости.
К газам, как мы знаем, также применим закон Паскаля. Поэтому на тела, находящиеся в газе, действует сила, выталкивающая их из газа. Под действием этой силы воздушные шары поднимаются вверх. Существование силы, выталкивающей тело из газа, можно также наблюдать на опыте.
К укороченной чашке весов подвесим стеклянный шар или большую колбу, закрытую пробкой. Весы уравновешиваются. Затем под колбу (или шар) ставят широкий сосуд так, чтобы он окружал всю колбу. Сосуд наполняется углекислым газом, плотность которого больше плотности воздуха (поэтому углекислый газ опускается вниз и заполняет сосуд, вытесняя из него воздух). При этом равновесие весов нарушается. Чашка с подвешенной колбой поднимается вверх (рис.). На колбу, погруженную в углекислый газ, действует бóльшая выталкивающая сила, по сравнению с той, которая действует на нее в воздухе.
Сила, выталкивающая тело из жидкости или газа, направлена противоположно силе тяжести, приложенной к этому телу.
Поэтому пролкосмосе). Именно этим объясняется, что в воде мы иногда легко поднимаем тела, которые с трудом удерживаем в воздухе.
Архимедова сила.
Силу, с которой тело, находящееся в жидкости, выталкивается ею, можно рассчитать (как это сделано в § 48). А можно определить ее значение на опыте, используя для этого прибор, изображенный на рисунке.
К пружине подвешивается небольшое ведерко и тело цилиндрической формы (рис., а). Стрелка на штативе отмечает растяжение пружины. Она показывает вес тела в воздухе. Приподняв тело, под него подставляется отливной сосуд, наполненный жидкостью до уровня отливной трубки. После чего тело погружается целиком в жидкость (рис., б). При этом часть жидкости, объем которой равен объему тела, выливается из отливного сосуда в стакан. Пружина сокращается, и указатель пружины поднимается вверх, показывая уменьшение веса тела в жидкости. В данном случае на тело, кроме силы тяжести, действует еще одна сила, выталкивающая его из жидкости. Если в верхнее ведерко вылить жидкость из стакана (т. е. ту, которую вытеснило тело), то указатель пружины возвратится к своему начальному положению (рис., в).
На основании этого опыта можно заключить, что сила, выталкивающая целиком погруженное в жидкость тело, равна весу жидкости в объеме этого тела. Такой же вывод мы получили и в § 48.
Если подобный опыт проделать с телом, погруженным в какой-либо газ, то он показал бы, что сила, выталкивающая тело из газа, также равна весу газа, взятого в объеме тела.
Сила, выталкивающая тело из жидкости или газа, называется архимедовой силой, в честь ученого Архимеда, который впервые указал на ее существование и рассчитал ее значение.
Итак, опыт подтвердил, что архимедова (или выталкивающая) сила равна весу жидкости в объеме тела, т. е. FА = Pж = g·mж. Массу жидкости mж, вытесняемую телом, можно выразить через ее плотность ρж и объем тела Vт, погруженного в жидкость (так как Vж – объем вытесненной телом жидкости равен Vт – объему тела, погруженного в жидкость), т. е. mж = ρж·Vт. Тогда получим:
FA = g·ρж·Vт
Следовательно, архимедова сила зависит от плотности жидкости, в которую погружено тело, и от объема этого тела. Но она не зависит, например, от плотности вещества тела, погружаемого в жидкость, так как эта величина не входит в полученную формулу.
Определим теперь вес тела, погруженного в жидкость (или в газ). Так как две силы, действующие на тело в этом случае, направлены в противоположные стороны (сила тяжести вниз, а архимедова сила вверх), то вес тела в жидкости P1 будет меньше веса тела в вакууме P = g·m на архимедову силу FА = g·mж (где mж – масса жидкости или газа, вытесненной телом).
Таким образом, если тело погружено в жидкость или газ, то оно теряет в своем весе столько, сколько весит вытесненная им жидкость или газ.
Пример. Определить выталкивающую силу, действующую на камень объемом 1,6 м3 в морской воде.
Запишем условие задачи и решим ее.
Дано:
Vт =1,6 м3
ρж = 1030 кг/м3
g = 9,8 Н/кг
FА – ?
Решение:
FА = g·ρж·Vт,
FА = 9.8 Н/кг · 1030 кг/м3 · 1,6 м3 = 16 480 Н ≈ 16,5 кН.
Ответ: FА = 16,5 кН.
Плавание тел.
На тело, находящееся внутри жидкости, действуют две силы: сила тяжести, направленная вертикально вниз, и архимедова сила, направленная вертикально вверх. Рассмотрим, что будет происходить с телом под действием этих сил, если в начале оно было неподвижно. При этом возможны три случая:
1) если сила тяжести Fтяж больше архимедовой силы FА, то тело будет опускаться на дно, тонуть, т. е. если
Fтяж > FА, то тело тонет;
2) если сила тяжести равна архимедовой силе, то тело может находиться в равновесии в любом месте жидкости, т. е. если
Fтяж = FА, то тело плавает;
3) если сила тяжести меньше архимедовой силы, то тело будет подниматься из жидкости, всплывать, т. е. если
Fтяж < FА, то тело всплывает.
Рассмотрим последний случай подробнее.
Когда всплывающее тело достигнет поверхности жидкости, то при дальнейшем его движении вверх архимедова сила будет уменьшаться. Почему? А потому, что будет уменьшаться объем части тела, погруженной в жидкость, а архимедова сила равна весу жидкости в объеме погруженной в нее части тела.
Когда архимедова сила станет равной силе тяжести, тело остановится и будет плавать на поверхности жидкости, частично погрузившись в нее.
Полученный вывод легко проверить на опыте.
В отливной сосуд нальем воду до уровня отливной трубки. После этого погрузим в сосуд плавающее тело, предварительно взвесив его в воздухе. Опустившись в воду, тело вытесняет объем воды, равный объему погруженной в нее части тела. Взвесив эту воду, находим, что ее вес (архимедова сила) равен силе тяжести, действующей на плавающее тело, или весу этого тела в воздухе.
Проделав такие же опыты с любыми другими телами, плавающими в разных жидкостях – в воде, спирте, растворе соли, можно убедиться, что если тело плавает в жидкости, то вес вытесненной им жидкости равен весу этого тела в воздухе.
Легко доказать, что если плотность сплошного твердого тела больше плотности жидкости, то тело в такой жидкости тонет. Тело с меньшей плотностью всплывает в этой жидкости. Кусок железа, например, тонет в воде, но всплывает в ртути. Тело же, плотность которого равна плотности жидкости, остается в равновесии внутри жидкости.
Плавает на поверхности воды лед, так как его плотность меньше плотности воды.
Чем меньше плотность тела по сравнению с плотностью жидкости, тем меньшая часть тела погружена в жидкость.
При равных плотностях тела и жидкости тело плавает внутри жидкости на любой глубине.
Две несмешивающиеся жидкости, например вода и керосин, располагаются в сосуде в соответствии со своими плотностями: в нижней части сосуда – более плотная вода (ρ = 1000 кг/м3), сверху – более легкий керосин (ρ = 800 кг/м3).
Средняя плотность живых организмов, населяющих водную среду, мало отличается от плотности воды, поэтому их вес почти полностью уравновешивается архимедовой силой. Благодаря этому водные животные не нуждаются в столь прочных и массивных скелетах, как наземные. По этой же причине эластичны стволы водных растений.
Плавательный пузырь рыбы легко меняет свой объем. Когда рыба с помощью мышц опускается на большую глубину, и давление воды на нее увеличивается, пузырь сжимается, объем тела рыбы уменьшается, и она не выталкивается вверх, а плавает в глубине. Таким образом, рыба может в определенных пределах регулировать глубину своего погружения. Киты регулируют глубину своего погружения за счет уменьшения и увеличения объема легких.
Плавание судов.
Суда, плавающие по рекам, озерам, морям и океанам, построены из разных материалов с различной плотностью. Корпус судов обычно делается из стальных листов. Все внутренние крепления, придающие судам прочность, также изготовляют из металлов. Для постройки судов используют различные материалы, имеющие по сравнению с водой как бóльшие, так и меньшие плотности.
Благодаря чему суда держатся на воде, принимают на борт и перевозят большие грузы?
Опыт с плавающим телом (§ 50) показал, что тело вытесняет своей подводной частью столько воды, что по весу эта вода равна весу тела в воздухе. Это также справедливо и для любого судна.
Вес воды, вытесняемой подводной частью судна, равен весу судна с грузом в воздухе или силе тяжести, действующей на судно с грузом.
Глубина, на которую судно погружается в воду, называется осадкой. Наибольшая допускаемая осадка отмечена на корпусе судна красной линией, называемой ватерлинией (от голланд. ватер – вода).
Вес воды, вытесняемой судном при погружении до ватерлинии, равный силе тяжести, действующей на судно с грузом, называется водоизмещением судна.
В настоящее время для перевозки нефти строятся суда водоизмещением 5 000 000 кН (5 · 106 кН) и больше, т. е. имеющие вместе с грузом массу 500 000 т (5 · 105 т) и более.
Если из водоизмещения вычесть вес самого судна, то мы получим грузоподъемность этого судна. Грузоподъемность показывает вес груза, перевозимого судном.
Судостроение существовало еще в Древнем Египте, в Финикии (считается, что Финикийцы были одними из лучших судостроителей), Древнем Китае.
В России судостроение зародилось на рубеже 17-18 вв. Сооружались главным образом военные корабли, но именно в России были построены первый ледокол, суда с двигателем внутреннего сгорания, атомный ледокол “Арктика”.
Воздухоплавание.
С давних времен люди мечтали о возможности летать над облаками, плавать в воздушном океане, как они плавали по морю. Для воздухоплавания
вначале использовали воздушные шары, которые наполняли или нагретым воздухом, или водородом либо гелием.
Для того, чтобы воздушный шар поднялся в воздух, необходимо, чтобы архимедова сила (выталкивающая) FА, действующая на шар, была больше силы тяжести Fтяж, т. е. FА > Fтяж.
По мере поднятия шара вверх архимедова сила, действующая на него, уменьшается (FА = gρV), так как плотность верхних слоев атмосферы меньше, чем у поверхности Земли. Чтобы подняться выше, с шара сбрасывается специальный балласт (груз) и этим облегчает шар. В конце концов шар достигает своей своей предельной высоты подъема. Для спуска шара из его оболочки при помощи специального клапана выпускается часть газа.
В горизонтальном направлении воздушный шар перемещается только под действием ветра, поэтому он называется аэростатом (от греч аэр – воздух, стато – стоящий). Для исследования верхних слоев атмосферы, стратосферы еще не так давно применялись огромные воздушные шары – стратостаты.
До того как научились строить большие самолеты для перевозки по воздуху пассажиров и грузов, применялись управляемые аэростаты – дирижабли. Они имеют удлиненную форму, под корпусом подвешивается гондола с двигателем, который приводит в движение пропеллер.
Воздушный шар не только сам поднимается вверх, но может поднять и некоторый груз: кабину, людей, приборы. Поэтому для того, чтобы узнать, какой груз может поднять воздушный шар, необходимо определить его подъемную силу.
Пусть, например, в воздух запущен шар объемом 40 м3, наполненный гелием. Масса гелия, заполняющая оболочку шара, будет равна:
mГе = ρГе·V = 0,1890 кг/м3 · 40 м3 = 7,2 кг,
а его вес равен:
PГе = g·mГе ; PГе = 9,8 Н/кг · 7,2 кг = 71 Н.
Выталкивающая же сила (архимедова), действующая на этот шар в воздухе, равна весу воздуха объемом 40 м3, т. е.
FА = g·ρвоздV; FА = 9,8 Н/кг · 1,3 кг/м3 · 40 м3 = 520 Н.
Значит, этот шар может поднять груз весом 520 Н – 71 Н = 449 Н. Это и есть его подъемная сила.
Шар такого же объема, но наполненный водородом, может поднять груз 479 Н. Значит, подъемная сила его больше, чем шара, наполненного гелием. Но все же чаще используют гелий, так как он не горит и поэтому безопаснее. Водород же горючий газ.
Гораздо проще осуществить подъем и спуск шара, наполненного горячим воздухом. Для этого под отверстием, находящимся в нижней части шара, располагается горелка. При помощи газовой горелки можно регулировать температуру воздуха внутри шара, а значит, его плотность и выталкивающую силу. Чтобы шар поднялся выше, достаточно сильнее нагреть воздух в нем, увеличив пламя горелки. При уменьшении пламени горелки температура воздуха в шаре уменьшается, и шар опускается вниз.
Можно подобрать такую температуру шара, при которой вес шара и кабины будет равен выталкивающей силе. Тогда шар повиснет в воздухе, и с него будет легко проводить наблюдения.
По мере развития науки происходили и существенные изменения в воздухоплавательной технике. Появилась возможность использования новых оболочек для аэростатов, которые стали прочными, морозоустойчивыми и легкими.
Достижения в области радиотехники, электроники, автоматики позволили сконструировать беспилотные аэростаты. Эти аэростаты используются для изучения воздушных течений, для географических и медико-биологических исследований в нижних слоях атмосферы.
Ссылки
- Уроки по физике за 7 класс по школьной программе
Давление – это физическая величина, которая играет особую роль в природе и жизни человека. Это незаметное глазу явление не только влияет на состояние окружающей среды, но и очень хорошо ощущается всеми. Давайте разберемся, что это такое, какие виды его существуют и как находить давление (формула) в разных средах.
Что называется давлением в физике и химии
Данным термином именуется важная термодинамическая величина, которая выражается в соотношении перпендикулярно оказываемой силы давления на площадь поверхности, на которую она воздействует. Это явление не зависит от размера системы, в которой действует, поэтому относится к интенсивным величинам.
В состоянии равновесия, по закону Паскаля, давление одинаково для всех точек системы.
В физике и химии оное обозначается с помощью буквы «Р», что является сокращением от латинского названия термина – pressūra.
Если речь идет об осмотическом давлении жидкости (равновесие между давлением внутри и снаружи клетки), используется буква «П».
Единицы давления
Согласно стандартам Международной системы СИ, рассматриваемое физическое явление измеряется в паскалях (кириллицей – Па, латиницей – Ра).
Исходя из формулы давления получается, что один Па равен одному Н (ньютон – единица измерения силы) разделенному на один квадратный метр (единица измерения площади).
Однако на практике применять паскали довольно сложно, поскольку эта единица очень мала. В связи с этим, помимо стандартов системы СИ, данная величина может измеряться по-другому.
Ниже приведены наиболее известные ее аналоги. Большинство из них широко используется на просторах бывшего СССР.
- Бары. Один бар равен 105 Па.
- Торры, или миллиметры ртутного столба. Приблизительно один торр соответствует 133, 3223684 Па.
- Миллиметры водяного столба.
- Метры водяного столба.
- Технические атмосферы.
- Физические атмосферы. Одна атм равна 101 325 Па и 1,033233 ат.
- Килограмм-силы на квадратный сантиметр. Также выделяются тонна-сила и грамм-сила. Помимо этого, есть аналог фунт-сила на квадратный дюйм.
Общая формула давления (физика 7-го класса)
Из определения данной физической величины можно определить способ ее нахождения. Выглядит он таким образом, как на фото ниже.
В нем F – это сила, а S – площадь. Иными словами, формула нахождения давления – это его сила, разделенная на площадь поверхности, на которую оно воздействует.
Также она может быть записана так: Р = mg / S или Р = pVg / S. Таким образом, эта физическая величина оказывается связанной с другими термодинамическими переменными: объемом и массой.
Для давления действует следующий принцип: чем меньше пространство, на которое влияет сила – тем большее количество давящей силы на него приходится. Если, же площадь увеличивается (при той же силе) – искомая величина уменьшается.
Формула гидростатического давления
Разные агрегатные состояния веществ, предусматривают наличие у них отличных друг от друга свойств. Исходя из этого, способы определения Р в них тоже будут другими.
К примеру, формула давления воды (гидростатического) выглядит вот так: Р = pgh. Также она применима и к газам. При этом ее нельзя использовать для вычисления атмосферного давления, из-за разности высот и плотностей воздуха.
В данной формуле р – плотность, g – ускорение свободного падения, а h – высота. Исходя из этого, чем глубже погружается предмет или объект, тем выше оказываемое на него давление внутри жидкости (газа).
Рассматриваемый вариант является адаптацией классической примера Р = F / S.
Если вспомнить, что сила равна производной массы на скорость свободного падения (F= mg), а масса жидкости – это производная объема на плотность (m = pV), то формулу давление можно записать как P = pVg / S. При этом объем – это площад, умноженная на высоту (V = Sh).
Если вставить эти данные, получится, что площадь в числителе и знаменателе можно сократить и на выходе – вышеупомянутая формула: Р = pgh.
Рассматривая давление в жидкостях, стоит помнить, что, в отличие от твердых тел, в них часто возможно искривление поверхностного слоя. А это, в свою очередь, способствует образованию дополнительного давления.
Для подобных ситуаций применяется несколько другая формула давления: Р = Р0 + 2QH. В данном случае Р0 – давление не искривленного слоя, а Q – поверхность натяжения жидкости. Н – это средняя кривизна поверхности, которую определяют по Закону Лапласа: Н = ½ (1/R1+ 1/R2). Составляющие R1 и R2 – это радиусы главной кривизны.
Парциальное давление и его формула
Хотя способ Р = pgh применим как для жидкостей, так и для газов, давление в последних лучше вычислять несколько другим путем.
Дело в том, что в природе, как правило, не очень часто встречаются абсолютно чистые вещества, ведь в ней преобладают смеси. И это касается не только жидкостей, но и газов. А как известно, каждый из таких компонентов осуществляет разное давление, называемое парциальным.
Определить его довольно просто. Оно равно сумме давления каждого компонента рассматриваемой смеси (идеальный газ).
Из этого следует, что формула парциального давления выглядит таким образом: Р = Р1+ Р2+ Р3… и так далее, согласно количеству составляющих компонентов.
Нередки случаи, когда необходимо определить давление воздуха. Однако некоторые по ошибке проводят вычисления только с кислородом по схеме Р = pgh. Вот только воздух – это смесь из разных газов. В нем встречаются азот, аргон, кислород и другие вещества. Исходя из сложившейся ситуации, формула давления воздуха – это сумма давлений всех его составляющих. А значит, следует приметь вышеупомянутую Р = Р1+ Р2+ Р3…
Наиболее распространенные приборы для измерения давления
Несмотря на то что высчитать рассматриваемую термодинамическую величину по вышеупомянутым формулам не сложно, проводить вычисление иногда попросту нет времени. Ведь нужно всегда учитывать многочисленные нюансы. Поэтому для удобства за несколько столетий был разработан ряд приборов, делающих это вместо людей.
Фактически почти все аппараты такого рода являются разновидностями манометра (помогает определять давление в газах и жидкостях). При этом они отличаются по конструкции, точности и сфере применения.
- Атмосферное давление измеряется с помощью манометра, именуемого барометром. Если необходимо определить разряжение (то есть давление ниже атмосферного) – применяются другая его разновидность, вакуумметр.
- Для того чтобы узнать артериальное давление у человека, в ход идет сфигмоманометр. Большинству он более известен под именем неинвазивного тонометра. Таких аппаратов существуют немало разновидностей: от ртутных механических до полностью автоматических цифровых. Их точность зависит от материалов, из которых они изготавливаются и места измерения.
- Перепады давления в окружающей среде (по-английски – pressure drop) определяются с помощью дифференциальных манометров или дифнамометров (не путать с динамометрами).
Виды давления
Рассматривая давление, формулу его нахождения и ее вариации для разных веществ, стоит узнать о разновидностях этой величины. Их пять.
- Абсолютное.
- Барометрическое
- Избыточное.
- Вакуумметрическое.
- Дифференциальное.
Абсолютное
Так называется полное давление, под которым находится вещество или объект, без учета влияния других газообразных составляющих атмосферы.
Измеряется оно в паскалях и являет собою сумму избыточного и атмосферного давлений. Также он является разностью барометрического и вакуумметрического видов.
Вычисляется оно по формуле Р = Р2 + Р3 или Р = Р2 – Р4.
За начало отсчета для абсолютного давления в условиях планеты Земля, берется давление внутри емкости, из которой удален воздух (то есть классический вакуум).
Только такой вид давления используется в большинстве термодинамических формул.
Барометрическое
Этим термином именуется давление атмосферы (гравитации) на все предметы и объекты, находящие в ней, включая непосредственно поверхность Земли. Большинству оно также известно под именем атмосферного.
Его причисляют к термодинамическим параметрам, а его величина меняется относительно места и времени измерения, а также погодных условий и нахождения над/ниже уровня моря .
Величина барометрического давления равна модулю силы атмосферы на площади единицу по нормали к ней.
В стабильной атмосфере величина данного физического явления равна весу столпа воздуха на основание с площадью, равной единице.
Норма барометрического давления – 101 325 Па (760 мм рт. ст. при 0 градусов Цельсия). При этом чем выше объект оказывается от поверхности Земли, тем более низким становится давление на него воздуха. Через каждый 8 км оно снижается на 100 Па.
Благодаря этому свойству в горах вода в чайниках закивает намного быстрее, чем дома на плите. Дело в том, что давление влияет на температуру кипения: с его снижением последняя уменьшается. И наоборот. На этом свойстве построена работа таких кухонных приборов , как скороварка и автоклав. Повышение давления внутри их способствуют формированию в посудинах более высоких температур, нежели в обычных кастрюлях на плите.
Используется для вычисления атмосферного давления формула барометрической высоты. Выглядит она таким образом, как на фото ниже.
Р – это искомая величина на высоте, Р0 – плотность воздуха возле поверхности, g – свободного падения ускорение, h – высота над Землей, м – молярная масса газа, т – температура системы, r – универсальная газовая постоянная 8,3144598 Дж⁄(моль х К), а е – это число Эйклера, равное 2.71828.
Часто в представленной выше формуле давления атмосферного вместо R используется К – постоянная Больцмана. Через ее произведение на число Авогадро нередко выражается универсальная газовая постоянная. Она более удобна для расчетов, когда число частиц задано в молях.
При проведении вычислений всегда стоит брать во внимание возможность изменения температуры воздуха из-за смены метеорологической ситуации или при наборе высоты над уровнем моря, а также географическую широту.
Избыточное и вакуумметрическое
Разницу между атмосферным и измеренным давлением окружающей среды называют избыточным давлением. В зависимости от результата, меняется название величины.
Если она положительная, ее называют манометрическим давлением.
Если же полученный результат со знаком минус – его именуют вакуумметрическим. Стоит помнить, что он не может быть больше барометрического.
Дифференциальное
Данная величина является разницей давлений в различных точках измерения. Как правило, ее используют для определения падения давления на каком-либо оборудовании. Особенно это актуально в нефтедобывающей промышленности.
Разобравшись с тем, что за термодинамическая величина называется давлением и с помощью каких формул ее находят, можно сделать вывод, что это явление весьма важно, а потому знания о нем никогда не будут лишними.
 Температура кипения. Чем выше температура кипения, тем выше давление пара.
Температура кипения. Чем выше температура кипения, тем выше давление пара.