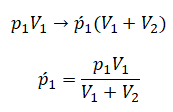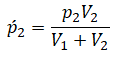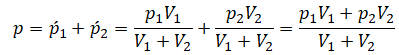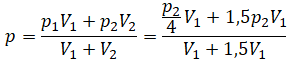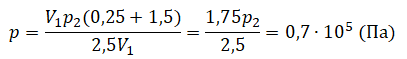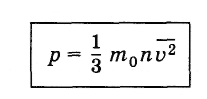Давление смеси газов равно сумме их парциальных давлений.
p = p1’ + p2’ + … .
К примеру, давление воздуха складывается из давления азота, кислорода, углекислого газа, водяного пара и т. д.
Определение
Парциальное давление — давление, которое производил бы данный газ, если бы другие газы отсутствовали.
Применение закона Дальтона при решении задач
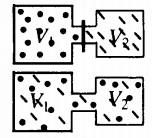
Самая популярная задача на закон Дальтона, это случай, когда газы находятся в сосудах, соединенных трубкой с краном. По условию этой задачи нужно найти давление, которое установится после того, как этот кран будет открыт.
После открытия крана первый и второй газы заполнят оба сосуда. Используем закон Бойля — Мариотта для первого газа (так как температура остается постоянной):
Этот же закон можем применить для второго газа. Тогда мы получим:
Применим закон Дальтона и получим:
Пример №1. Два сосуда соединены трубкой с краном. Определить давление, которое установится после того, как кран будет открыт. Считать, что объем второго сосуда в 1,5 раза больше первого. Давление во втором сосуде составляет половину от атмосферного давления. В первом сосуде оно меньше в 4 раза.
Проанализируем условия задачи и запишем:
V2 = 1,5V1
p2 = 4p1
p2 = 105 Па
Теперь можем применить выведенную ранее формулу:
Преобразуем выражение и найдем установившееся давление:
Задание EF17512
Три одинаковых сосуда, содержащих разреженный газ, соединены друг с другом трубками малого диаметра: первый сосуд – со вторым, второй – с третьим. Первоначально давление газа в сосудах было равно соответственно р, 3р и р. В ходе опыта сначала открыли и закрыли кран, соединяющий второй и третий сосуды, а затем открыли и закрыли кран, соединяющий первый сосуд со вторым. Как изменилось в итоге (уменьшилось, увеличилось или осталось неизменным) количество газа в первом сосуде? (Температура газа оставалась в течение всего опыта неизменной.)
Алгоритм решения
1.Записать исходные данные.
2.Применить закон Дальтона для определения давления в первом сосуде.
3.Применить закон Менделеева — Клапейрона для установления характера изменения количества газа в первом сосуде в ходе эксперимента.
Решение
Запишем исходные данные:
• Объемы сосудов равны: V1 = V2 = V3 = V.
• Температуры равны: T1 = T2 = T3 = T.
• Давления распределены следующим образом: p1 = p, p2 = 3p, p3 = p.
После того, как открыли кран между 2 и 3 сосудом, объем возрос вдвое, и давление распределилось по нему равномерно. Согласно закону Дальтона, оно стало равным сумме давлений, оказываемых газами в количестве вещества ν2 и ν3. Так как объем после открытия крана увеличивается вдвое, то парциальное давление каждого из количества вещества равно половине исходного давления:
p23=p2+3p2=2p
Потом кран 2–3 закрыли, но открыли кран 1–2. Применим закон Дальтона, получим:
p12=2p2+p2=3p2
Теперь применим закон Менделеева — Клапейрона:
pV=νRT
Для начального состояния газа в 1 сосуде:
pV=ν1RT
Для конечного состояния газа в 1 сосуде:
3p2V=ν2RT
Так как температура и объем неизменны, но давление увеличилось в 1,5 раза, то и количество газа в первом сосуде увеличилось в 1,5 раза.
Ответ: Увеличилось
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18873

Для каждой величины определите соответствующий характер изменения:
- увеличилась
- уменьшилась
- не изменилась
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
1.Записать исходные данные.
2.Установить характер изменения парциального давления неона.
3.Применить закон Менделеева — Клапейрона, чтобы установить характер изменения общего давления смеси газов.
Решение
Исходные данные:
• Количество неона: ν1 = 1 моль.
• Количество аргона: ν2 = 1 моль.
• Количество впущенного аргона: ν4 = 1 моль.
Сначала парциальное давление неона и аргона равно. Это объясняется тем, что давление газов при неизменном количестве вещества зависит только от объема и температуры. Эти величины постоянны.
Когда из сосуда выпустили половину газовой смеси, в нем оказалось по половине моля каждого из газов. Затем в сосуд впустили 1 моль аргона. Следовательно, в сосуде стало содержаться 0,5 моль неона и 1,5 моль аргона. Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Из уравнения видно, что давление и количество вещества — прямо пропорциональные величины. Следовательно, если количество неона уменьшилось, то его парциальное давление тоже уменьшилось.
Общая сумма количества вещества равна сумме количеств вещества 1 (неона) и 2 (аргона): 0,5 + 1,5 = 2 (моль). Изначально в сосуде тоже содержалось 2 моль газа. Так как количество вещества, температура и объем сохранились, давление тоже осталось неизменным.
Ответ: 23
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 3.5k
Давление является одним из трех основных термодинамических макроскопических параметров любой газовой системы. В данной статье рассмотрим формулы давления газа в приближении идеального газа и в рамках молекулярно-кинетической теории.
Идеальные газы
Каждый школьник знает, что газ является одним из четырех (включая плазму) агрегатных состояний материи, в котором частицы не имеют определенных положений и движутся хаотичным образом во всех направлениях с одинаковой вероятностью. Исходя из такого строения, газы не сохраняют ни объем, ни форму при малейшем внешнем силовом воздействии на них.
В любом газе средняя кинетическая энергия его частиц (атомов, молекул) больше, чем энергия межмолекулярного взаимодействия между ними. Кроме того, расстояния между частицами намного превышают их собственные размеры. Если молекулярными взаимодействиями и размерами частиц можно пренебречь, тогда такой газ называется идеальным.
В идеальном газе существует лишь единственный вид взаимодействия – упругие столкновения. Поскольку размер частиц пренебрежимо мал в сравнении с расстояниями между ними, то вероятность столкновений частица-частица будет низкой. Поэтому в идеальной газовой системе существуют только столкновения частиц со стенками сосуда.
Все реальные газы с хорошей точностью можно считать идеальными, если температура в них выше комнатной, и давление не сильно превышает атмосферное.
Причина возникновения давления в газах
Прежде чем записать формулы расчета давления газа, необходимо разобраться, почему оно возникает в изучаемой системе.
Согласно физическому определению, давление – это величина, равная отношению силы, которая перпендикулярно воздействует на некоторую площадку, к площади этой площадки, то есть:
P = F/S
Выше мы отмечали, что существует только один единственный тип взаимодействия в идеальной газовой системе – это абсолютно упругие столкновения. В результате них частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. Для этого случая применим второй закон Ньютона:
F*Δt = Δp
Именно сила F приводит к появлению давления на стенки сосуда. Сама величина F от столкновения одной частицы является незначительной, однако количество частиц огромно (≈ 1023), поэтому они в совокупности создают существенный эффект, который проявляется в виде наличия давления в сосуде.
Формула давления газа идеального из молекулярно-кинетической теории
При объяснении концепции идеального газа выше были озвучены основные положения молекулярно-кинетической теории (МКТ). Эта теория основывается на статистической механике. Развита она была во второй половине XIX века такими учеными, как Джеймс Максвелл и Людвиг Больцман, хотя ее основы заложил еще Бернулли в первой половине XVIII века.
Согласно статистике Максвелла-Больцмана, все частицы системы движутся с различными скоростями. При этом существует малая доля частиц, скорость которых практически равна нулю, и такая же доля частиц, имеющих огромные скорости. Если вычислить среднюю квадратичную скорость, то она примет некоторую величину, которая в течение времени остается постоянной. Средняя квадратичная скорость частиц однозначно определяет температуру газа.
Применяя приближения МКТ (невзаимодействующие безразмерные и хаотично перемещающиеся частицы), можно получить следующую формулу давления газа в сосуде:
P = N*m*v2/(3*V)
Здесь N – количество частиц в системе, V – объем, v – средняя квадратичная скорость, m – масса одной частицы. Если все указанные величины определены, то, подставив их в единицах СИ в данное равенство, можно рассчитать давление газа в сосуде.
Формула давления из уравнения состояния
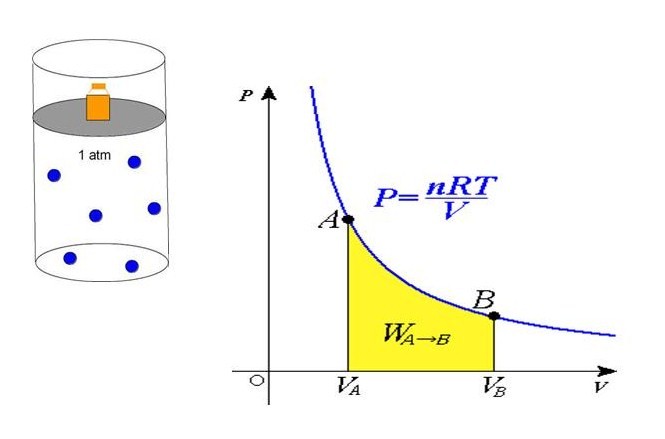
В середине 30-х годов XIX века французский инженер Эмиль Клапейрон, обобщая накопленный до него экспериментальный опыт по изучению поведения газов во время разных изопроцессов, получил уравнение, которое в настоящее время называется универсальным уравнением состояния идеального газа. Соответствующая формула имеет вид:
P*V = n*R*T
Здесь n – количество вещества в молях, T – температура по абсолютной шкале (в кельвинах). Величина R называется универсальной газовой постоянной, которая была введена в это уравнение русским химиком Д. И. Менделеевым, поэтому записанное выражение также называют законом Клапейрона-Менделеева.
Из уравнения выше легко получить формулу давления газа:
P = n*R*T/V
Равенство говорит о том, что давление линейно возрастает с температурой при постоянном объеме и увеличивается по гиперболе с уменьшением объема при постоянной температуре. Эти зависимости отражены в законах Гей-Люссака и Бойля-Мариотта.
Если сравнить это выражение с записанной выше формулой, которая следует из положений МКТ, то можно установить связь между кинетической энергией одной частицы или всей системы и абсолютной температурой.
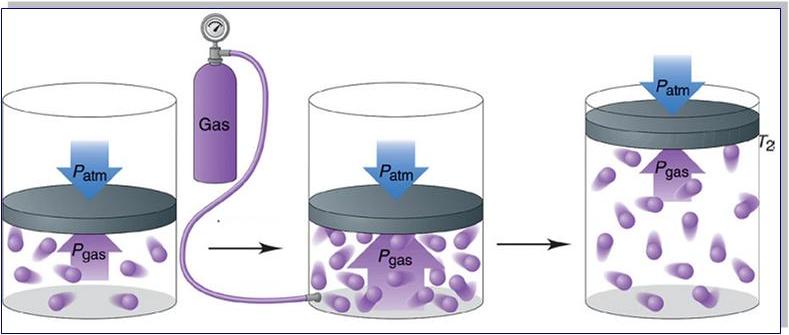
Давление в газовой смеси
Отвечая на вопрос о том, как найти давление газа и формулы, мы ничего не говорили о том, является ли газ чистым, или речь идет о газовой смеси. В случае формулы для P, которая следует из уравнения Клапейрона, нет никакой связи с химическим составом газа, в случае же выражения для P из МКТ эта связь присутствует (параметр m). Поэтому при использовании последней формулы для смеси газов становится непонятным, какую массу частиц выбирать.
Когда необходимо рассчитать давление смеси идеальных газов, следует поступать одним из двух способов:
- Рассчитывать среднюю массу частиц m или, что предпочтительнее, среднее значение молярной массы M, исходя из атомных процентов каждого газа в смеси;
- Воспользоваться законом Дальтона. Он гласит, что давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример задачи
Известно, что средняя скорость молекул кислорода составляет 500 м/с. Необходимо определить давление в сосуде объемом 10 литров, в котором находится 2 моль молекул.
Ответ на задачу можно получить, если воспользоваться формулой для P из МКТ:
P = N*m*v2/(3*V)
Здесь содержатся два неудобных для выполнения расчетов параметра – это m и N. Преобразуем формулу следующим образом:
m = M/NA;
n = N/NA;
m*N = M*n;
P = M*n*v2/(3*V)
Объем сосуда в кубических метрах равен 0,01 м3. Молярная масса молекулы кислорода M равна 0,032 кг/моль. Подставляя в формулу эти значения, а также величины скорости v и количества вещества n из условия задачи, приходим к ответу: P = 533333 Па, что соответствует давлению в 5,3 атмосферы.
Давление газа
Содержание:
- Давление газа — что это за параметр
- Причина возникновения давления в газах
- Формула давления идеального газа из молекулярно-кинетической теории
- Второй способ записи основного уравнения МКТ
Давление газа — что это за параметр
Определение
Давление в физике представляет собой один из трех ключевых термодинамических макроскопических характеристик для измерения любой газовой системы.
Определение
Газ — это одно из четырех, включая плазму, агрегатных состояний материи, характеризующееся очень слабыми связями между составляющими его частицами, а также их большой подвижностью.
В газообразной среде частицы в определенной концентрации расположены не упорядоченно и перемещаются в хаотичном порядке в разных направлениях с одинаковой вероятностью. Подобное строение не позволяет газам сохранять стабильность объема и формы даже при малом внешнем силовом воздействии. Для любого газа, включая одноатомный, значение средней кинетической энергии его частиц в виде атомов и молекул будет превышать энергию межмолекулярного взаимодействия между ними.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Кроме того, расстояние, на которое удалены частицы, значительно превышает их собственные размеры. В том случае, когда молекулярными взаимодействиями и габаритами частиц допускается пренебрегать, газ считают идеальным. Для такой формы материи характерен только один тип внутреннего взаимодействия в виде упругих столкновений. Так как размер частиц пренебрежимо мал по сравнению с расстоянием, на которое они удалены, вероятность столкновений частиц между собой будет низкой.
Примечание
По этой причине в идеальной газовой среде можно наблюдать лишь столкновения частиц со стенками сосуда. Какой-либо реальный газ с хорошей точностью можно отнести к идеальному, когда их температура выше, чем комнатная, а давление несущественно больше, чем атмосферное.
Причина возникновения давления в газах
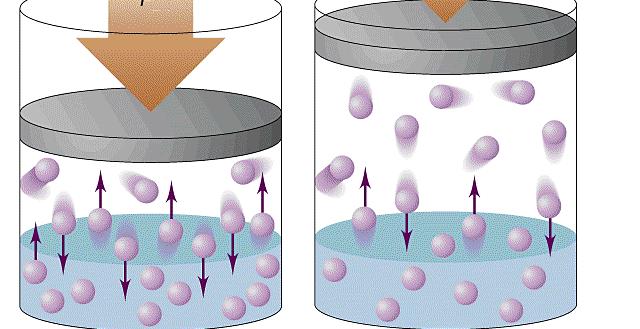
Давление газа нельзя объяснить теми же причинами, что и давление твердого тела на опору. Расстояние, на которое удалены молекулы газообразной среды, существенно больше. В результате хаотичного движения они сталкиваются между собой и со стенками сосуда, который они занимают. Давление газа на стенки сосуда и вызвано ударами его молекул.
Данный параметр увеличивается по мере того, как нарастает сила ударов молекул о стенки. Газ характеризуется одинаковым давлением во всех направлениях, которое является следствием хаотичного движения огромного числа молекул.
Примечание
Важно отметить, что газ оказывает давление на дно и стенки сосуда, объем которого он занимает, во всех направления равномерно. В связи с этим, воздушный шарик сохраняет форму, несмотря на то, что его оболочка достаточно эластична.
Перед тем как транспортировать или отправить на хранение газообразные вещества, их сильно сжимают. В этом случае давление газа увеличивается. Его помещают в специальные баллоны из стали высокой прочности. Такие емкости необходимы для хранения сжатого воздуха на подводных лодках и кислорода, предназначенного для сварки металлов.
Свойства давления газа:
- Если объем уменьшается, то давление газа возрастает, а во время увеличения объема, давление будет снижаться при постоянных величинах массы и температуры вещества.
- Газ, находящийся в закрытом сосуде, характеризуется давлением, которое возрастает по мере увеличения температуры вещества при условии постоянства его массы и объема.
- В том случае, когда масса газа увеличивается, его давление также будет возрастать и наоборот.
Запись формул для определения давления газа начинают с выяснения причин, по которым оно возникает в рассматриваемой системе. Исходя из физического смысла, давление представляет собой величину, равную отношению силы, перпендикулярно воздействующей на некоторое основание, к площади этого основания:
(P=frac{F}{S})
Как было отмечено ранее, для идеальной газовой системы характерен лишь один тип взаимодействия — это абсолютно упругие столкновения. В процессе частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. В данном случае применим второй закон Ньютона:
(F*Δt = Δp)
Таким образом, конкретно сила F является причиной формирования давления на стенки сосуда. Данная величина F, производимая одной частицей, незначительна. Однако, когда количество частиц огромно, они в совокупности создают ощутимый эффект, проявляемый в виде наличия давления в сосуде.
Формула давления идеального газа из молекулярно-кинетической теории
Объяснение концепции идеального газа построено на основных положениях молекулярно-кинетической теории, которая вытекает из принципов статистической механики. Наука получила активное развитие во второй половине XIX, благодаря таким ученым, как Джеймс Максвелл и Людвиг Больцман. Основы дисциплины были заложены еще Бернулли в первой половине XVIII века.
Исходя из статистики Максвелла-Больцмана, все частицы в системе обладают разными скоростями движения. При этом можно наблюдать небольшой процент частиц со скоростями, приближенными к нулю, и малую долю частиц, обладающих огромной скоростью. Средняя квадратичная скорость в этом случае будет соответствовать некоторой величине, не изменяющейся с течением времени.
Средняя квадратичная скорость частиц однозначно характеризует температуру газа. Используя приближения молекулярно-кинетической теории в виде невзаимодействующих безразмерных и хаотично движущихся частиц, получают формулу для расчета давления газа в сосуде:
(P=frac{N*m*v^{2}}{3*V})
где N является количеством частиц в системе; V обозначает объем; v представляет собой среднюю квадратичную скорость; m является массой одной частицы.
При наличии указанных в формуле параметров, выраженных в единицах СИ, можно вычислить давление газа в сосуде.
Второй способ записи основного уравнения МКТ
Определение
В середине 30-х годов XIX столетия французскому инженеру Эмилю Клапейрону удалось обобщить накопленный до этого времени экспериментальный опыт изучения поведения газов во время разнообразных изопроцессов и получить формулу, которую в будущем назвали универсальным уравнением состояния идеального газа:
(P*V = n*R*T )
n является количеством вещества в молях; T представляет собой температуру по абсолютной шкале и обозначается в кельвинах.
Величина R является универсальной газовой постоянной. Этот термин был введен в уравнение русским химиком Д.И. Менделеевым. Исходя из этого, запись уравнения называют законом Клапейрона-Менделеева.
Определение
С помощью данного выражения можно определить формулу для расчета давления газа:
(P=frac{n*R*T}{V})
Полученное уравнение объясняет линейный рост давления при увеличении температуры в условиях стабильности объема. Если объем уменьшается с сохранением температуры, то давление увеличивается по гиперболе. Данные закономерности явления отражены в законах Гей-Люссака и Бойля-Мариотта.
Сравнивая представленное выражение с записью формулы, которая вытекает из положений молекулярно-кинетической теории, можно установить связь кинетической энергии одной частицы, либо системы в общем, и абсолютной температуры.
Важно отметить, что при расчетах с использованием формулы для Р, вытекающей из уравнения Клапейрона, связь с химическим составом газа отсутствует. Если давление определяют с помощью выражения, согласно понятию молекулярно-кинетической теории, то данную связь следует учитывать в виде параметра m. В том случае, когда определяют давление смеси идеальных газов, применяют один из следующих методов:
- Расчет средней массы частиц m, либо среднего значения молярной массы М с учетом атомных процентов каждого газа в смеси.
- Применение закона Дальтона, согласно которому давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример
Предположим, что молекулы кислорода движутся со средней скоростью в 500 м/с. Требуется рассчитать, каково давление в сосуде, объем которого равен 10 литров, содержащий 2 моль молекул.
Для того чтобы найти ответ, следует применить формулу для Р из молекулярно-кинетической теории:
(P=frac{N*m*v^{2}}{3*V})
Из-за неизвестных параметров m и N требуется выполнить некоторые преобразования формулы:
(m=frac{M}{NA})
(n=frac{N}{NA})
(m*N= M*n)
(P=frac{M*n*v^{2}}{3*V})
Таким образом, удельный объем сосуда в кубических метрах равен 0,01. Молярная масса молекулы кислорода М составляет 0,032 кг/моль. Данные параметры можно подставить в уравнение вместе со скоростью и количеством вещества. Тогда Р = 533333 Па, что представляет собой давление в 5,3 атмосферы.
Давление газа
Разделив
левую и правую части уравнения (4.4.8) на
SΔt
и
учитывая соотношение (4.3.6), найдем
давление газа
(4.4.9)
Это и есть основное
уравнение молекулярно-кинетической
теории идеального газа*.
* Это уравнение —
первое количественное соотношение,
полученное в молекулярно-кинетической
теории. Поэтому его принято называть
основным.
Давление идеального
газа пропорционально произведению
массы молекулы на концентрацию молекул
и средний квадрат их скорости.
Формула (4.4.9)
связывает макроскопическую величину
— давление, которое может быть измерено
манометром, — с микроскопическими
величинами, характеризующими молекулы,
и является как бы мостом между двумя
мирами: макроскопическим и микроскопическим.
Если
через
обозначить
среднюю кинетическую энергию
поступательного движения молекулы:
,
то уравнение (4.4.9) можно записать в форме:
(4.4.10)
Отметим в заключение,
что хотя расчет произведен без явного
учета столкновений молекул, это не
означает, что столкновения совсем не
учитывались нами. Именно огромное число
столкновений приводит к тому, что
движение молекул является хаотическим.
Равенства (4.3.4) и (4.3.6) выполняются с
большой точностью как раз вследствие
громадного числа столкновений.
Нам удалось
вычислить давление идеального газа на
стенки сосуда. Оно зависит от концентрации
молекул. Кроме того, давление газа
пропорционально средней кинетической
энергии молекул. Это и есть главный
факт.
§ 4.5. Температура— мера средней кинетической энергии молекул
Из основного
уравнения молекулярно-кинетической
теории газа вытекает важное следствие:
температура есть мера средней кинетической
энергии молекул. Докажем это.
Для
простоты будем считать количество газа
равным 1 моль. Молярный объем газа
обозначим через VM.
Произведение
молярного объема на концентрацию молекул
представляет собой постоянную Авогадро
NA,
т.
е. число молекул в 1 моль.
Умножим
обе части уравнения (4.4.10) на молярный
объем VM
и
учтем, что nVM
= NA.
Тогда
(4.5.1)
Формула
(4.5.1) устанавливает связь макроскопических
параметров — давления р
и
объема VM
—
со средней кинетической энергией
поступательного движения молекул.
Вместе с тем
полученное опытным путем уравнение
состояния идеального газа для 1 моль
имеет вид:
(4.5.2)
Левые части
уравнений (4.5.1) и (4.5.2) одинаковы, значит,
должны быть равны и их правые части, т.
е.
Отсюда вытекает
связь между средней кинетической
энергией поступательного движения
молекул и температурой:
(4.5.3)
Средняя
кинетическая энергия хаотического
движения молекул
газа пропорциональна
абсолютной температуре. Чем
выше температура, тем быстрее движутся
молекулы.
Соотношение
между температурой и средней кинетической
энергией поступательного движения
молекул (4.5.3) установлено для разреженных
газов. Однако оно оказывается справедливым
для любых веществ, движение атомов или
молекул которых подчиняется законам
механики Ньютона. Оно верно для жидкостей,
а также для твердых тел, у которых атомы
могут лишь колебаться возле положений
равновесия в узлах кристаллической
решетки.
При приближении
температуры к абсолютному нулю энергия
теплового движения молекул также
приближается к нулю*.
* При очень низких
температурах (вблизи абсолютного нуля)
движение атомов и молекул уже не
подчиняется законам Ньютона. Согласно
более точным законам движения микрочастиц
— законам квантовой механики — абсолютный
нуль соответствует минимальному значению
энергии движения, а не полному прекращению
какого-либо движения вообще.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
На прошлых уроках мы с вами рассмотрели идеальный газ с
позиций молекулярно-кинетической теории. И выяснили, как зависит давление
идеального газа от концентрации его молекул и температуры.
Однако состояние макроскопической системы считается полностью
определённым, если известны все её макроскопические параметры — давление,
температура и объём. Поэтому нам необходимо установить, как связаны между собой
эти макроскопические параметры.
Уравнение, связывающее температуру, давление и объем
идеального газа в состоянии теплового равновесия, называют уравнением состояния
идеального газа. Несмотря на то, что это уравнение было получено
экспериментально, его легко можно вывести из основного уравнения МКТ:
p
= nkT.
Как известно, концентрация газа — это число молекул газа в
единице объёма:
Тогда мы можем записать, что давление газа прямо
пропорционально температуре и числу молекул и обратно пропорционально его
объёму:
Теперь давайте соберём в левой части уравнения все
макропараметры газа: его давление, объём и температуру:
Обратите внимание на правую часть записанного равенства: «Ка»
(k) — это постоянная Больцмана, а N — число молекул газа, которое
при неизменной массе газа тоже является величиной постоянной. Поэтому правая
часть уравнения является константой. Отсюда следует, что при неизменной
массе и неизменном химическом составе газа отношение произведения его давления
и объёма к абсолютной температуре является величиной постоянной:
Это и есть уравнение состояния идеального газа.
Впервые оно было получено французским физиком Бенуа Клайпероном в 1834 году,
поэтому его называют уравнением Клайперо́на.
В справедливости уравнения можно убедиться на таком опыте.
Возьмём гофрированный сосуд, объём которого можно менять при помощи винта.
Объём газа измеряется с помощью линейки, а давление — при помощи манометра,
подключённого к сосуду. Температура газа в сосуде равна температуре окружающей
среды и может быть измерена термометром.
Теперь при помощи винта изменим объём сосуда. А сам сосуд
поместим в горячую воду, тем самым изменив температуру газа и его давление.
Дождёмся теплового равновесия.
Нетрудно заметить, что в пределах погрешности эксперимента отношение
произведения давления и объёма газа к абсолютной температуре действительно
является постоянной величиной:
Реальные газы тоже можно описать при помощи уравнения состояния.
Но для этого необходимо выполнение двух условий. Во-первых, давление газа
должно быть таково, чтобы собственный объём всех молекул газа был пренебрежимо
мал по сравнению с вместимостью сосуда, в котором находится газ. А во-вторых,
температура газа должна быть не слишком низкой и не слишком высокой, чтобы абсолютное
значение потенциальной энергии межмолекулярного взаимодействия было пренебрежимо
мало́ по сравнению с кинетической энергией теплового движения молекул.
Получим ещё одно уравнение, связывающее все три
макропараметра. Для этого вернёмся к формуле, в которой мы уже расписали концентрацию
газа через отношение числа его молекул к занимаемому объёму:
Давайте выразим число молекул газа через постоянную
Авога́дро, массу и молярную массу газа из формул для количества вещества:
И подставим это значение в исходную формулу: .
Произведение двух постоянных (Больцмана и числа Авогадро)
называют универсальной (или молярной) газовой постоянной. О её физическом
смысле этой постоянной мы с вами будем говорить немного позднее.
Тогда с учётом введённого обозначения можно записать, что
произведение давления идеального газа и его объёма равно произведению отношения
массы газа к его молярной массе, универсальной газовой постоянной и абсолютной
температуры газа:
Это уравнение впервые было получено выдающимся русским учёным
Дмитрием Ивановичем Менделеевым в 1874 году. Оно тоже является уравнением
состояния идеального газа, и поэтому его называют уравнением Клайперона —
Менделеева.
Из него вытекают два очень важных следствия. Во-первых, если
выразить из уравнения число молекул газа, то можно заметить, что если различные
газы занимают равные объёмы при одинаковых температурах и давлениях, то число
молекул в них тоже одинаково. Иными словами, из него вытекает установленный
опытным путём закон Авогадро, о котором мы упоминали на прошлых уроках: при
равных давлениях и температурах в одинаковых объёмах любых газов содержится
одинаковое число молекул.
А второе следствие мы рассмотрим на таком примере. Пусть у
нас есть смесь химически не реагирующих разрежённых газов, находящихся в сосуде
вместимостью V. Тепловое движение частиц каждого газа равномерно
распределяет их по всему объёму сосуда. В результате столкновений частиц друг с
другом в смеси устанавливается тепловое равновесие.
Общее число частиц газов в сосуде равно сумме частиц каждого
из газов:
Конечно же, каждый газ в отдельности будет создавать давление
на стенки сосуда. Оно называется парциальным давлением. То есть парциальное
давление — это давление газа, входящего в состав газовой смеси, если бы он один
занимал весь объём, предоставленный смеси, при той же температуре.
Запишем для каждого газа уравнение состояния:
Можно записать, что давление смеси химически не
реагирующих между собой газов равно сумме парциальных давлений каждого из
газов.
Этот закон называют законом Дальтона, так как открыт
он был экспериментальным путём в 1801 году английским учёным Джоном
Дальтоном.
Для закрепления нового материала решим с вами задачу. Баллон
вместимостью 20 л, содержащий газ при давлении 3 МПа и температуре 320 К,
соединили с пустым баллоном вместимостью 5,0 л. Определите давление газа,
которое установилось в баллонах после расширения, если температура газа стала
равной 285 К.
В заключение отметим, что уравнение Клайперона — Менделеева справедливо
для любой массы газа и связывает между собой параметры одного состояния газа.
Использование этого уравнения позволяет описать различные процессы,
происходящие в идеальном газе.